トップページ > 広報活動 > プレスリリース > 子宮がん肉腫でトラスツズマブ デルクステカンによる抗HER2療法の有効性を確認 PDXモデルでの効果予測とも一致し希少がんの治療開発への道を開く
子宮がん肉腫でトラスツズマブ デルクステカンによる抗HER2療法の有効性を確認 PDXモデルでの効果予測とも一致し希少がんの治療開発への道を開く
2023年4月10日
国立がん研究センター
埼玉医科大学国際医療センター
In English
注:記載の一部の情報(本文赤字部分)に誤りがございましたので訂正いたしました(2023年4月13日)。
発表のポイント
- 希少かつ難治性がんである子宮がん肉腫の切除不能、進行期および再発の患者さんに対して、世界で初めてトラスツズマブ デルクステカンによる抗HER2療法の有効性を確認しました。
- 治験参加者の検体から作成したPDX(Patient-Derived Xenograft)モデルにおいても患者さんと同様にトラスツズマブ デルクステカンの有効性を確認しました。
- 患者さんが少なく、大規模な臨床試験の実施が困難な希少がんにおいて、今回用いたベイズ統計学に基づく統計手法やPDXモデルでの薬理効果の確認が、新しい治療法の開発に役立つことが期待されます。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)中央病院(病院長:島田和明)は、がん細胞の増殖に関連するタンパク質HER2を持っている子宮がん肉腫の患者さんに対して抗HER2抗体薬物複合体トラスツズマブ デルクステカン(注1)の有効性を評価する第II相医師主導治験のSTATICE(スターチス)試験を国内7施設で実施しました。その結果、高発現の患者さんの54.5%、低発現の患者さんの70%で、腫瘍の30%以上の縮小(奏効)が認められました。本試験結果は、子宮がん肉腫に対し抗HER2療法が有効である可能性を世界で初めて示したもので、米国学術雑誌「Journal of Clinical Oncology」に米国時間2023年3月28日付(日本時間3月29日)で発表されました。
また、同時に国立がん研究センター研究所(所長:間野博行)は、埼玉医科大学国際医療センター(病院長:佐伯俊昭、埼玉県日高市)と協力し、子宮がん肉腫の患者さんの腫瘍組織を重度免疫不全マウスに移植したPDX(Patient-Derived Xenograft)モデル(注2)を作製し、STATICE試験でトラスツズマブ デルクステカンを投与した2名の患者さんについて、PDXモデルでの効果と患者さんでの実際の効果を比較しました。その結果、PDXモデルと患者さんで同一(有効)の結果が得られ、PDXモデルで化学療法の効果を予測できることが示されました。本研究の成果は、米国学術雑誌「Clinical Cancer Research」に同日付で発表されました。
本研究成果により、HER2タンパクの発現を有する子宮がん肉腫患者さんにおいて、トラスツズマブ デルクステカンが新たな治療選択肢となり得ることが示され、さらに大規模な臨床試験の実施が難しい希少がんでのさらなる有効な治療法の開発の加速化が期待されます。
背景
子宮がん肉腫は、子宮内膜細胞に由来するがんですが、その名前が示す通り、病理所見では上皮細胞(臓器などをおおう細胞)から発生する癌腫成分と非上皮性細胞(筋肉などを作る細胞)から発生する肉腫成分の両方が確認されることが最大の特徴です。そのため、以前は子宮体がんではなく子宮肉腫の一種として考えられており、その特殊性から子宮体がんの治療開発からはしばしば除外されていました。現在の子宮がん肉腫の治療は、腫瘍が局所に限局していて手術で完全に腫瘍を取り除くことが可能な場合は切除を検討しますが、早期例に術後化学療法を実施しても、約半数の患者さんで再発することが知られています。切除不能な再発・進行例では、パクリタキセル+カルボプラチン(TC療法)やパクリタキセル+イホマイド(TI療法)が第一選択の薬剤とされているものの、第二選択以降の薬剤選択肢は限られており、新たな薬剤の開発が急務と考えられていました。また、子宮がん肉腫は、日本での年間罹患数は600例ほどの希少がんで、その希少性から大規模な臨床試験の実施は難しく、治療開発は進んできませんでした。
国立がん研究センター中央病院では、2014年に希少がんセンターを設立して以来、希少がんの研究開発およびゲノム医療を推進するMASTER KEYプロジェクト(注3)を基盤とし、希少がん領域でのバイオマーカー(遺伝子異常、タンパク発現等)に基づいた、複数の臨床試験を実施してきました。一方で、これまでの臨床試験では、統計学的に決められた数の患者さんが参加されなければ研究を完了することができず、患者さんの数が少ない希少がん領域においては治療開発におけるウィークポイントとなっていました。
さらに、中央病院では国立がん研究センター研究所で見いだされた新しい医療シーズを臨床に応用するトランスレーショナルリサーチの推進も進めることで、希少がんの開発基盤を整備することも目指してきました。PDXモデルは、抗がん剤の臨床効果予測においてこれまで汎用されている培養細胞株と比較し、予測性能は高いとされていますが、はっきりとした結果は得られていませんでした。そこで本試験に参加された患者さんから採取し樹立したPDXモデルで、治療効果の比較実証研究を行いました。
研究概要
第II相医師主導治験(STATICE試験)
STATICE試験は、国立研究開発法人日本医療研究開発機構(AMED)臨床研究・治験推進研究事業(がん領域Clinical Innovation Network事業による超希少がんの臨床開発と基盤整備を行う総合研究/研究代表者:米盛 勧)の支援を受けて開始し、MASTER KEYプロジェクトの始動以降は副試験としても実施されました。
参加施設
7施設 (国がん研究センター中央病院、埼玉医科大学国際医療センター、静岡がんセンター、愛知県がんセンター、兵庫県立がんセンター、四国がんセンター、九州がんセンター)
登録期間
2018年2月から2020年6月
主な登録条件
- 化学療法歴のある、切除不能な子宮がん肉腫患者さん
- HER2陽性
- 年齢20歳以上
登録数
84人(解析対象34人)
トラスツズマブ デルクステカンの投与量
STATICE試験開始時は当時の推奨投与量であった6.4mg/kgが投与されましたが、推奨投与量の変更に伴い、試験中盤から5.4mg/kgが投与されました。
主目的
- HER2タンパク発現を有する子宮がん肉腫患者さんでのトラスツズマブ デルクステカンの有効性ならびに安全性の評価
- HER2タンパクの発現程度とトラスツズマブ デルクステカンの有効性の関係についての検討
副次的目的
無増悪生存期間、全生存期間、安全性
観察研究方法
第II相単群試験
子宮がん肉腫の患者さんの腫瘍組織を用い免疫組織化学染色によってHER2タンパク発現をスコア0からスコア3+の4段階で評価し、高発現ならびに低発現(HER2スコア0を除く)を認めた患者さんに対し、トラスツズマブ デルクステカンの有効性ならびに安全性を確認する目的とし、第II相医師主導治験を実施しました(図1)。
本試験では、ベイズ統計学(注4)に基づく統計手法を用いて、期間内に参加可能と考えられる患者さんの数の範囲を研究開始前に設定し、期間内に実際に参加された患者さんの数がその範囲内であれば治験薬の有効性を検討できることが最大の特徴となっています。今回はHER2スコア2+から3+の患者さんについて15~25名の参加を、HER2スコア1+の患者さんについて0~10名の参加を仮定し、研究を開始しました。また本試験ではHER2タンパク発現の程度とトラスツズマブ デルクステカンの有効性の関係についても検討するため、婦人科悪性腫瘍を専門とする病理医による病理中央判定を行いました。この評価方法については既に報告され、子宮悪性腫瘍では世界で最も頻用されるNCCNガイドライン(注5)に採択されています。
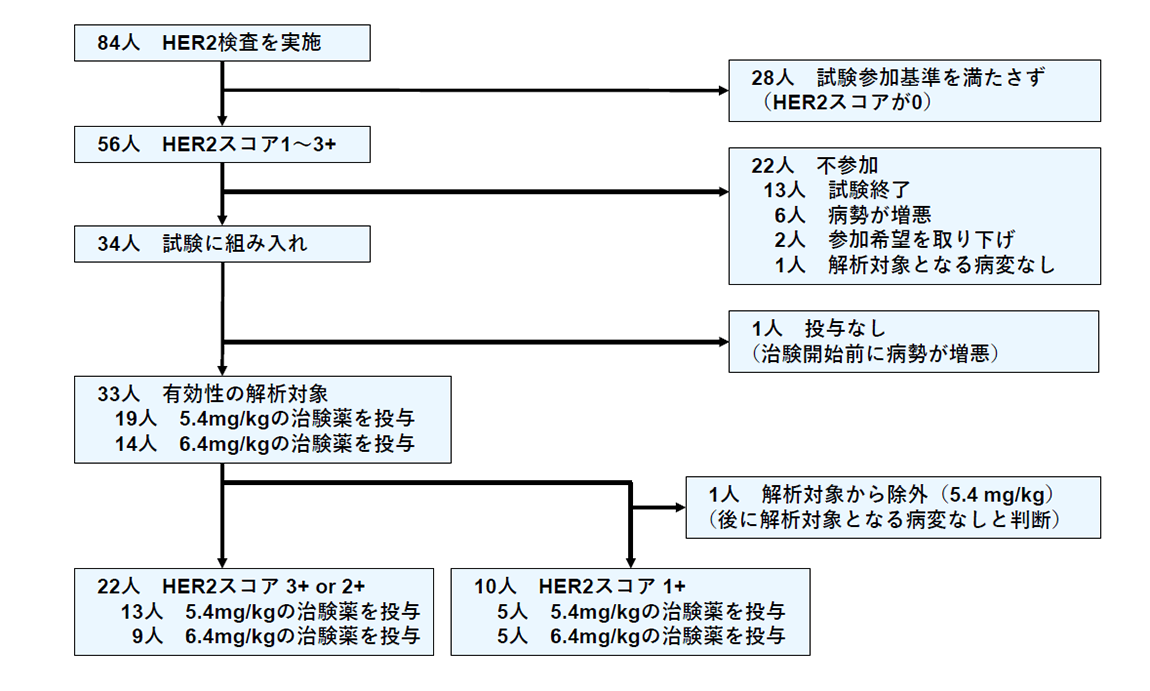
(図1)STATICE試験の流れ
子宮がん肉腫PDXモデルを用いたトラスツズマブ デルクステカンの非臨床試験
埼玉医科大学国際医療センターで子宮がん肉腫の外科的手術を受けた患者さん6名にご協力いただき、それぞれの患者さんの腫瘍組織を重度免疫不全マウスに移植したPDXモデルを作製し、トラスツズマブ デルクステカンの有効性を確認しました。このうち2名の患者さんについては、STATICE試験に参加し、実際にトラスツズマブ デルクステカンが投与され、PDXモデルと患者さんでの実際の効果について比較を行いました。
研究結果
STATICE試験(第II相医師主導治験)
標準化学療法の投与歴のある切除不能な子宮がん肉腫の患者さん84名が参加され、56名の方にHER2タンパクの発現を認めました。そのうちHER2タンパク高発現を認める22名とHER2タンパク低発現を認める10名にトラスツズマブ デルクステカンが投与されました。
その結果、主要評価項目である画像中央判定での奏効率(腫瘍が30%以上縮小する確率)は、HER2タンパク高発現群で54.5%(図2)、HER2タンパク低発現群で70%(図3)でした。副次評価項目である無増悪生存期間と全生存期間の中央値はそれぞれ6.7カ月と15.8カ月であり、子宮がん肉腫の標準治療以降の薬物療法に関する報告(それぞれ奏効率約5%、無増悪生存期間約2カ月、全生存期間3~8カ月*)と比較し、良好な結果であることが確認されました。また、副作用については既にトラスツズマブ デルクステカンが保険適用となっている乳がんや胃がんにおける報告と相違のない結果でありました。
*Matsuzaki S, Klar M, Matsuzaki S, Roman LD, Sood AK, Matsuo K. Uterine carcinosarcoma: Contemporary clinical summary, molecular updates, and future research opportunity. Gynecol Oncol. 2021;160(2):586-601.
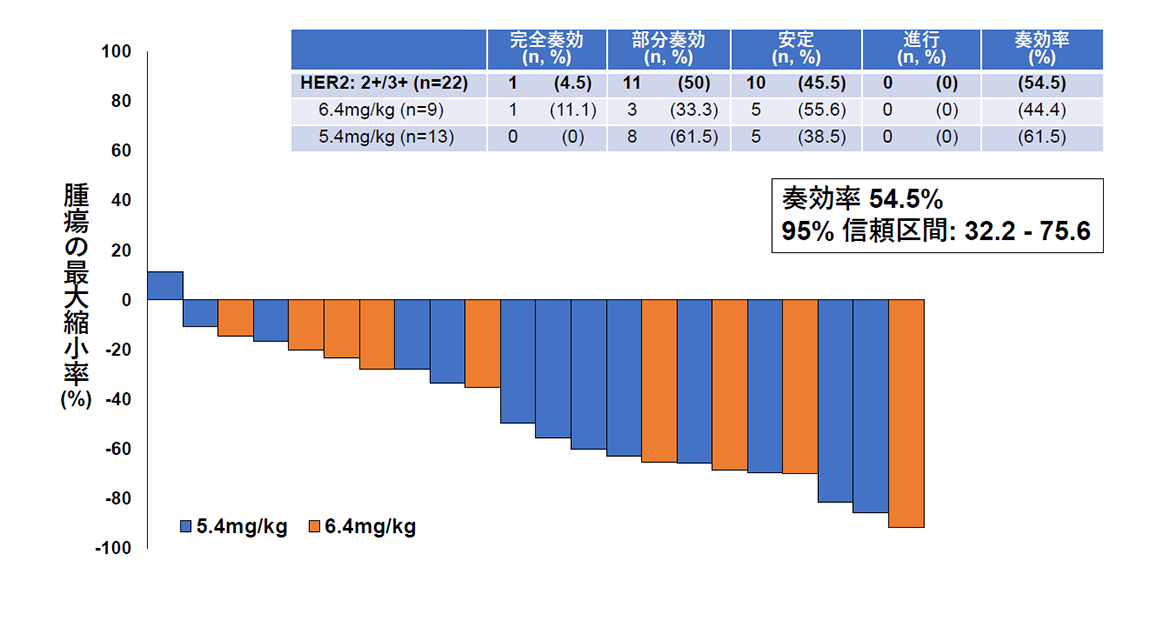
(図2)HER2タンパク高発現を認める22名のトラスツズマブ デルクステカンの有効性
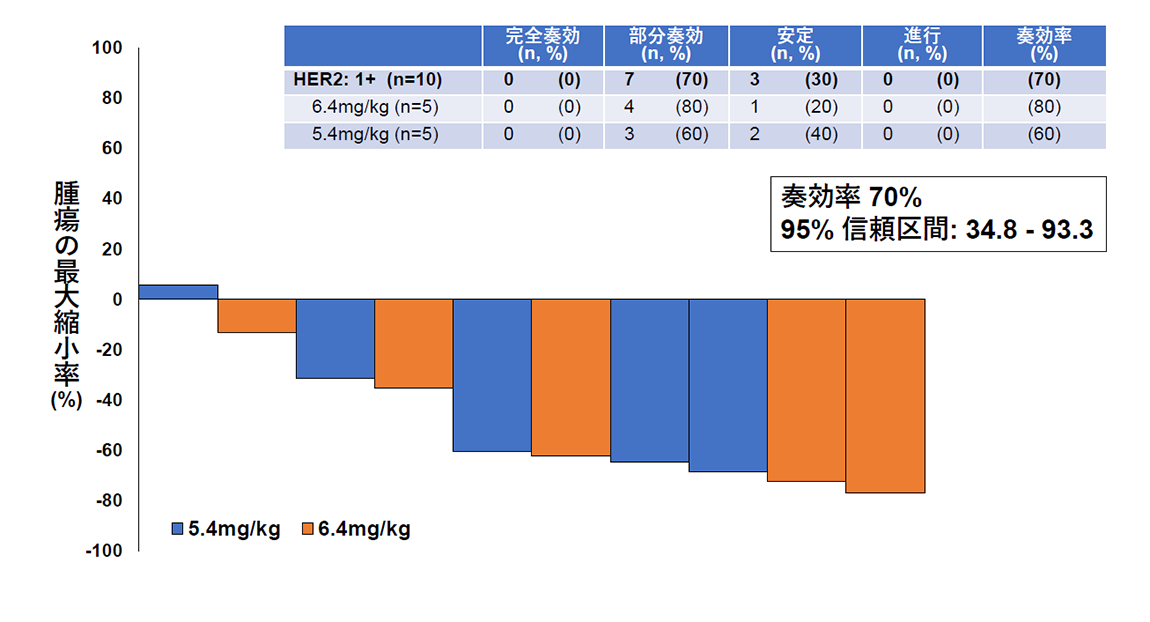
(図3)HER2タンパク低発現を認める10名のトラスツズマブ デルクステカンの有効性
子宮がん肉腫PDXモデルを用いたトラスツズマブ デルクステカンの非臨床試験
本試験に参加され腫瘍の縮小を認めた患者さん2名の腫瘍組織から作製された2例のPDXモデルにおいても、PDXにおけるトラスツズマブ デルクステカンの薬理効果と患者さんのSTATICE試験での治療効果を比較いたしました。患者さんAでは肝臓の病変が治療開始後より著明に縮小が得られ、PDXにおいてもトラスツズマブ デルクステカンにより腫瘍がほぼ消失し有効性が確認されました。患者さんBでは治療により肝臓の病変が一旦縮小したものの、患者さんAと比べ短期間で病変の増大が認められています。PDXでも腫瘍の増殖が抑えられましたが、患者さんAと比べ縮小効果は小さく、患者さんにおける治療効果と相関していることが確認されました(図4)。
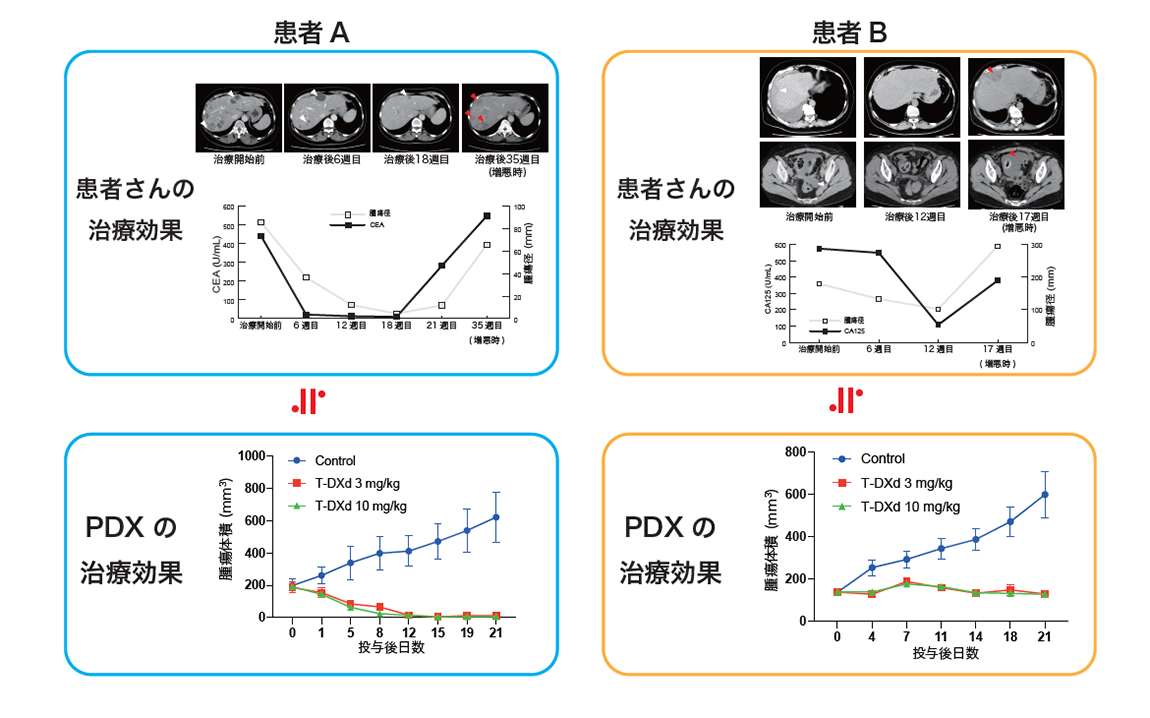
(図4)子宮がん肉腫の患者さんの検体を移植したPDXモデルでのトラスツズマブ デルクステカンの薬理効果
展望
本医師主導治験により、HER2タンパクの発現を有する子宮がん肉腫患者さんにおいて、トラスツズマブ デルクステカンが新たな治療選択肢となり得ることが示されました。また、PDXモデルでの非臨床試験の結果により、PDXモデルで実際の患者さんでの治療効果を精緻に予測できる可能性が示され、患者さんが少なく大規模な臨床試験の実施が困難ながんでの新しい治療法の開発に役立つことが期待されます。
本研究においてはベイズ統計学に基づく統計手法を用いた治療開発であることも一つの特徴であり、とりわけ大規模な臨床試験の実施が困難な希少がんにおいては意義の大きい研究成果であると考えられます。今後、同様の手法を用いて、さらなる希少がんに対する治療開発を計画中です。さらに、国立がん研究センター中央病院を中心とした臨床研究と国立がん研究センター研究所の非臨床(基礎)研究が緊密に連携することで、PDXモデルの作製と評価を実施することができました。
国立がん研究センターでは日本人がん患者由来PDXライブラリー(J-PDXライブラリー)(外部サイトにリンクします)の構築を進めており、治験に参加された患者さんから樹立されたPDXモデルで同様の薬理効果が確認されたことから、他の未承認抗がん薬においても同様の取り組みを採用することで、アンメットメディカルニーズにおける治療開発がさらに加速されることが期待されます。
発表論文
STATICE試験(第II相医師主導治験)
雑誌名
Journal of Clinical Oncology
タイトル
Trastuzumab Deruxtecan for HER2-Expressing Advanced or Recurrent Uterine Carcinosarcoma (NCCH1615): The STATICE Trial
著者
Tadaaki Nishikawa, Kosei Hasegawa, Koji Matsumoto, Masahiko Mori, Yasuyuki Hirashima, Kazuhiro Takehara, Kazuya Ariyoshi, Tomoyasu Kato, Shigehiro Yagishita, Akinobu Hamada, Mamiko Kawasaki, Satoshi Kawashima, Sawako Tomatsuri, Yukari Nagasaka, Hiroshi Yoshida, Ryunosuke Machida, Akihiro Hirakawa, Kenichi Nakamura, Kan Yonemori
掲載日
米国時間2023年3月28日付(日本時間3月29日)
DOI
10.1200/JCO.22.02558
URL
https://ascopubs.org/doi/full/10.1200/JCO.22.02558(外部サイトにリンクします)
子宮がん肉腫PDXモデルを用いたトラスツズマブ デルクステカンの非臨床試験
雑誌名
Clinical Cancer Research
タイトル
Co-clinical study of [fam-] trastuzumab deruxtecan (DS8201a) in patient-derived xenograft models of uterine carcinosarcoma and its association with clinical efficacy
著者
Shigehiro Yagishita, Tadaaki Nishikawa, Hiroshi Yoshida, Daisuke Shintani, Sho Sato, Maiko Miwa, Mikiko Suzuki, Masanori Yasuda, Yusuke Ogitani, Takahiro Jikoh, Kan Yonemori, Kosei Hasegawa, Akinobu Hamada
掲載日
米国時間2023年3月28日付(日本時間3月29日)
DOI
10.1158/1078-0432.CCR-22-3861
URL
https://doi.org/10.1158/1078-0432.CCR-22-3861(外部サイトにリンクします)
研究費
平成28年度 国立研究開発法人日本医療研究開発機構(AMED) JP16lk0201044
「がん領域Clinical Innovation Network事業による超希少がんの臨床開発と基盤整備を行う総合研究」
臨床研究・治験推進事業
研究代表者:米盛 勧
がん研究開発費(28-A-12)
「トランスレーショナルリサーチの標準化に関する研究」
研究代表者:米盛 勧
がん研究開発費
患者腫瘍組織移植モデルマウスの生物学的特性に関する研究(29-E-5)
ヒト腫瘍内多様性を正しく反映するPDX樹立手法の開発(31-A-3)
研究代表者:濱田哲暢
第一三共株式会社共同研究費(2016年5月から2021年3月)
DS-8201aの患者由来xenograft model (PDX model)などに対する抗腫瘍活性評価及びイメージングを用いた薬物分布評価
研究代表者:濱田哲暢(国立がん研究センター)、扇谷祐輔、杉原潔(第一三共株式会社)
薬剤提供
第一三共株式会社
用語解説
(注1)トラスツズマブ デルクステカン
第一三共株式会社によって開発された抗体薬物複合体であり、抗HER2抗体にトポイソメラーゼ阻害薬と呼ばれる薬剤が結合した抗がん剤。乳がんと胃がんで保険が適用されています。
(注2)PDX(Patient-Derived Xenograft)モデル
免疫による拒否反応を起こさせないようにするため、人工的に重度免疫不全状態としたマウスに患者さんから採取した組織を移植したマウスモデルです。
(注3)MASTER KEYプロジェクト
希少がんの研究開発およびゲノム医療を推進する、レジストリ研究と副試験の2つのパートに分かれた産学共同プロジェクト。これまでに3,000名以上の患者さんの登録と、副試験パートでは27件(16件の医師主導治験、11件の企業治験)の臨床試験を実施しています。(2023年3月時点)
(注4)ベイズ統計学
実施した治験で得られた薬剤効果に関するデータだけでなく、過去に得られた情報等も用いて効果を評価する統計手法の総称です。
(注5)NCCNガイドライン
米国のNational Comprehensive Cancer Networkが作成し、年に1回以上の改訂を行い、世界的に広く利用されているがん診療ガイドライン です。
お問い合わせ先
研究に関する問い合わせ
国立がん研究センター中央病院
腫瘍内科 西川 忠曉
電話番号:03-3547-5201(内線 7846)
Eメール:tnishika●ncc.go.jp
国立がん研究センター 研究所
分子薬理研究分野 柳下 薫寛
電話番号:03-3547-5201(内線 4477)
Eメール:syagishi●ncc.go.jp
広報窓口
国立がん研究センター
企画戦略局 広報企画室
電話番号:03-3542-2511(代表)
Eメール:ncc-admin●ncc.go.jp
埼玉医科大学
広報室
電話番号:049-276-2125
Eメール:koho●saitama-med.ac.jp
関連ファイル
関連リンク
- 中央病院 腫瘍内科
- 研究所 分子薬理研究分野
- J-PDXライブラリ (外部サイトにリンクします)

