トップページ > 研究組織一覧 > 分野・独立ユニットグループ > 独立ユニットグループ > がん細胞内トラフィック研究ユニット > 研究プロジェクト
研究プロジェクト
1.変異レセプター全般の局在異常研究への波及的展開 ~シグナルの時空間的解析~
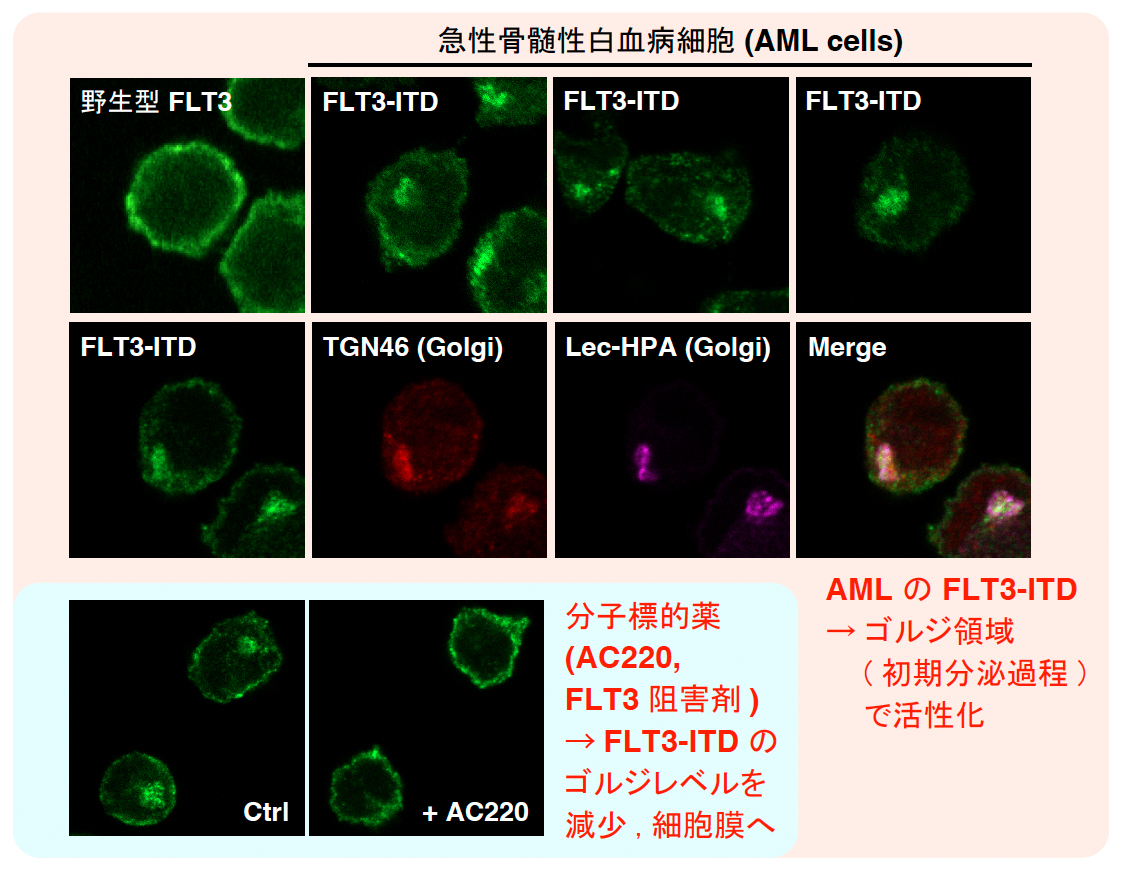
「局在異常は、KIT変異体に特別な現象なのだろうか?」, この疑問に答える最初の研究として、急性骨髄性白血病 (acute myelogenous leukemia: AML) の30%で認められ、分子標的薬のターゲットとなっているFLT3-ITD (internal tandem duplication) の細胞内局在について検討しました。下図に示すように、野生型FLT3が細胞膜に分布するのに対し、興味深いことに、FLT3-ITDは核近傍領域に停留しています。この領域は、ゴルジマーカーの位置とよく一致し、他の検討結果と併せると、AMLのFLT3-ITDはゴルジ領域に異常局在し、そこから無限細胞増殖シグナルを発信することを示唆するデータが得られました (Sci. Rep., 2021)。さらに、ゴルジ領域におけるシグナル発信に着目し、そこでの機能を抑制する戦術構築について取り組んでいます。局在異常を示す変異レセプターが、KITのみではなかったことから、現在、肺腺がんのEGFR/MET, 多発性骨髄腫のFGFR3, GISTのPDGFRA等の細胞内局在についての研究を進めています。
2.消化器がん, 血液がん等におけるRAS変異体のオルガネラ局在, シグナル発信メカニズム
チロシンキナーゼのみではなく、RAS変異体の細胞内局在とシグナル発信の関係についての研究も展開しています。全がんの約30%のケースでRASの活性化変異が認められ、治療薬のターゲットとして重要であるとされていますが、分子表面に化合物が結合する余地が少なく、undruggable targetと呼ばれています。がん細胞において、「いつ・どこで・どのように無限細胞増殖シグナルを発信しているのか」 の大部分は正確に理解されておらず、我々は、変異チロシンキナーゼ研究のノウハウを活かし、RASの細胞内局在・輸送経路とシグナルの時空間的解析を試みています。主なRASメンバーとして、KRAS4A/B, NRAS, HRASが知られており、それぞれの局在は異なるとされていますし、また、同じ分子種でもがん種が異なると局在が異なることを示唆するデータが得られているので、内在性レベルの各変異体を各がん種で丁寧に解析する必要があります。RASのシグナル発信が、特定オルガネラに限局しているならば、そこへの移行ブロックまたは停留解除が新たな機能阻害戦術の構築の一助となると考えています。
3.がん原性シグナル分子の局在異常の原因となる分子メカニズムの解明
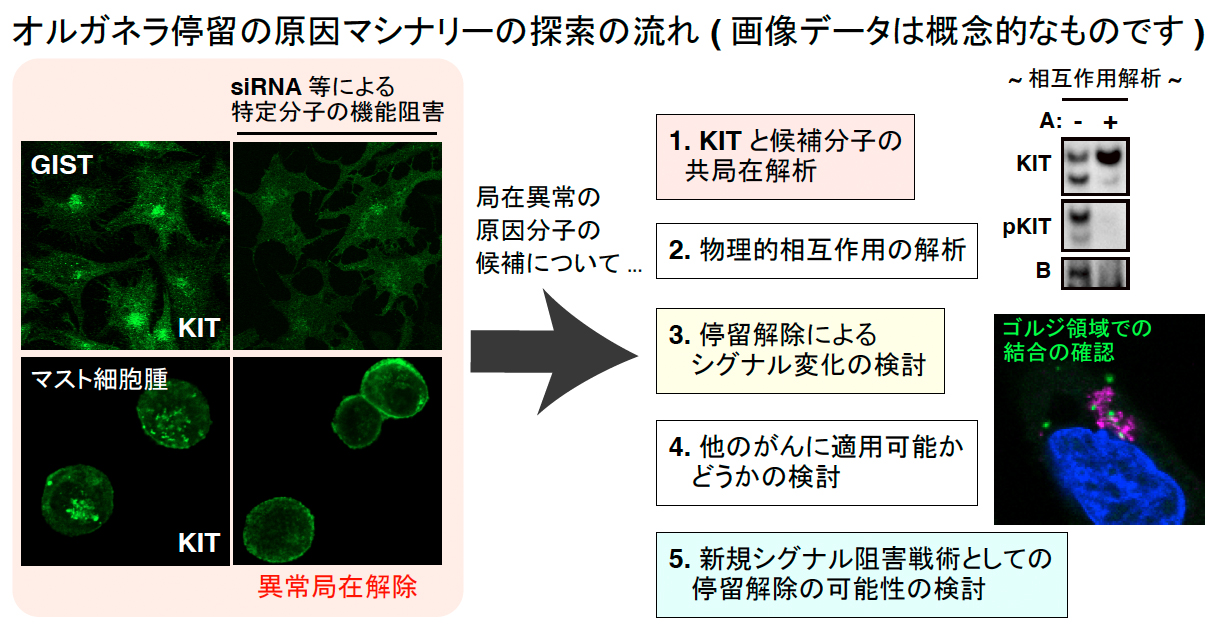
「変異チロシンキナーゼがエンドソームやゴルジ体に異常局在する原因となるマシナリーは何か?」, この疑問に答える研究を進めています。数十種類のアクティベータまたはインヒビターから、異常局在を解除するものをスクリーニングし、化合物のターゲット分子をsiRNA/shRNAでノックダウンし、フェノコピー探索を試みています。さらに、候補分子の機能解析をおこない, その分子と変異KITやFLT3-ITDとの物理的相互作用を検討しています。GISTのKIT変異体のゴルジ停留については、候補分子を絞ることができ、KITと候補分子群がどのように 「ゴルジ領域で機能的に相互作用しているのか」 について、KIT-EGFPと、RFPタグした候補分子のライブイメージングに取り組んでいます。局在異常の原因分子群の中には、低分子化合物でブロック可能なものが含まれており、それらをターゲットとした新規分子標的薬の探索も計画しています。
4.局在異常のメカニズムの理解に基づいた新規分子標的薬の基盤的開発および概念実証
治験中の分子標的薬や前臨床段階の治療薬候補について、共同研究に基づいてターゲット分子の細胞内分布の変化, 生化学的な評価をおこない、Proof-of-Concept (POC), Mode-of-Action (MOA) 研究を実施しています。治療薬存在下、ターゲット分子や関連分子を可視化することで、予想外の移動や代謝プロセスに気づくことがあります。その理解を化合物のプロデューサーにフィードバックし、治療薬候補の改良等に繋げることにおいて役割を果たしたいと考えています。

