トップページ > グループ紹介 > 免疫トランスレーショナルリサーチ分野(柏) > 主な研究内容 > 全体の紹介
全体の紹介
当研究室では、がん細胞に対するT細胞の免疫応答がどのように制御性T細胞によって抑制されているのかを解析しています。
がんと免疫の関係 ~Cancer Immunoediting~
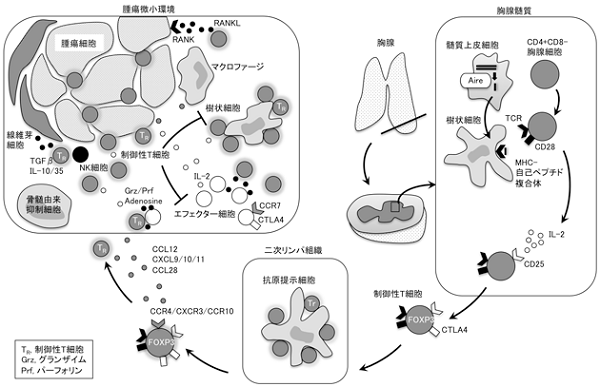
がん細胞と生体の免疫応答の関係は、がん免疫編集 (Cancer Immunoediting) という概念にまとめられています。紫外線や放射線といった日常生活で受ける刺激によって生体に生じるがん細胞は、免疫系によって認識されて排除されます(排除相)。次第に免疫系によって排除されにくいがん細胞が発生してくるようになり、がん細胞の発生と免疫系による排除は平衡に達します(平衡相)。さらにがん細胞は、免疫系の攻撃を抑制する分子を取り込むことにより、免疫監視をくぐり抜けて増殖し、臨床的に診断される「がん」になります(逃避相)。このようにがん微小環境では、がん細胞に対する免疫系の攻撃は、さまざまなメカニズムによって抑制された状態となっています。
がんと制御性T細胞
がん細胞に対する免疫応答のなかでも注目を集めているのが、制御性T細胞と呼ばれる免疫抑制細胞です。制御性T細胞とは、本来は自己免疫病などにならないように、自己に対する免疫応答の抑制(免疫寛容)を司っている細胞で、健康人のCD4+T細胞のなかの約5%を占めています。しかし、がん細胞はこの制御性T細胞を利用して、免疫系からの攻撃を回避しています。実際、悪性黒色腫や肺がんなどの多くのがん微小環境では、活性化して免疫抑制機能が強くなった制御性T細胞が、CD4+T細胞の20~50%に増加しています。 当研究室では、制御性T細胞ががん微小環境でどのように免疫抑制効果を発揮しているかを研究することによって、制御性T細胞をコントロールして、がんに対する免疫応答を強化することで新たながん免疫療法の開発を目指しています。
図1 がんにおける制御性T細胞1
制御性T細胞の同定法
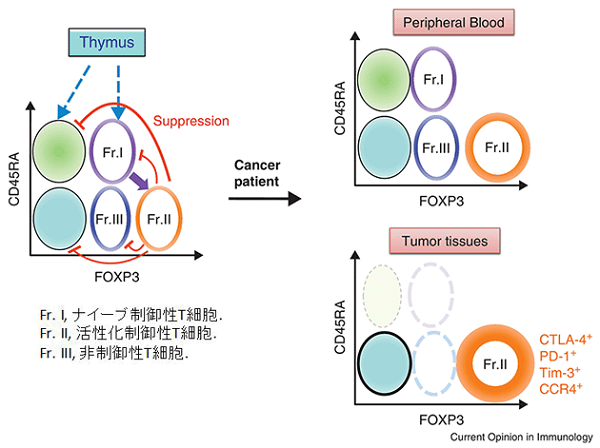
制御性T細胞は、転写因子のFoxP3がマスターレギュレーターであることが知られています。しかし、ヒトでは、FoxP3+CD4+T細胞中には一時的に活性化されたエフェクターCD4+T細胞も含まれています。そこで、私たちの研究室では、ナイーブ細胞のマーカーであるCD45RAとFoxP3を組み合わせて、ヒト制御性T細胞の精密な同定を試みています(図2)。つまり、活性化していないナイーブ制御性T細胞 (CD45RA+FoxP3lowCD4+T細胞)、活性化して強い抑制活性を有する活性化制御性T細胞 (CD45RA-FoxP3highCD4+T細胞)、FoxP3陽性にもかかわらず制御性T細胞ではないCD45RA-FoxP3lowCD4+T細胞に分けることによって、FoxP3+T細胞をその細胞機能と相関するように分類しています。
図2 ヒト制御性T細胞の同定と分類2
制御性T細胞による自己反応性CD8+T細胞の不応答化 (anergy) 機構の解明
これまでに、ヒトの制御性T細胞によって抑制された自己反応性CD8+T細胞が、特徴的なフェノタイプを有する不応答細胞になっていることを明らかにしてきました3。皮膚色素細胞の自己抗原であるMelan-A/MART-1に特異的なCD8+T細胞は、制御性T細胞による抑制を受けると、ナイーブマーカーであるCCR7と免疫抑制分子CTLA-4を共に発現する特徴的なフェノタイプをもち、抗原刺激を受けても反応しない不可逆的な不応答状態 (anergy) に陥ることを示しました。したがって、有効ながん細胞に対する免疫応答を惹起するためには、制御性T細胞を除去した上で、がん抗原に対するエフェクターT細胞を誘導する必要があると考えられました。
CCR4を標的とした制御性T細胞除去による新規のがん免疫療法の開発
CCR4とは、主に皮膚に遊走するリンパ球上に発現しているケモカインレセプターです。私たちの研究室では、CCR4が一部のヒト制御性T細胞上に選択的に発現しており、抗CCR4抗体によってCCR4陽性細胞を除去することで、活性化した制御性T細胞が選択的に除去されることを示しました4。この活性化制御性T細胞のみを選択的に除去することによって、すべての制御性T細胞を除去した場合と同等の抗腫瘍免疫活性の増加効果が得られました。また、ナイーブ制御性T細胞を残存させることができるため、自己免疫性の有害事象の軽減が期待されます。この基礎データをもとに、2013年から国内6施設で進行・再発固形がんを対象に、抗CCR4抗体モガムリズマブの安全性、薬物動態、制御性T細胞の除去効果を検討する第I相臨床試験 CliinicalTrials.gov ID: NCT01929486(外部サイトにリンクします)が開始されています5。
がんの免疫原性による層別化と今後の研究課題
近年、がんが免疫系から逃避するために獲得するCTLA-4やPD-1といった免疫チェックポイント分子に対するブロッキング抗体によって、悪性黒色腫、非小細胞肺がん、腎細胞がん、胃がんなどの患者さんの生存期間が大きく延長されることがわかり、がん治療の新たな選択肢となってきています。しかし、全体の約30%の患者さんにしか有効でないため、治療に対して効果がみられる可能性が高い患者さん(レスポンダー)を層別化するためのバイオマーカーの検討が進められており、我々も実際の患者さんの検体を解析し、さらに実験で検証するなどして取り組んでおります。 がん細胞は、細胞の構成成分を抗原として細胞表面に提示しています。T細胞は細胞表面に提示されたこれらの抗原を認識することによって、攻撃するかどうかを決定しています。がん細胞が提示している抗原には、自己に由来する分子と、がん細胞の遺伝子不安定性によって生じた遺伝子変異に由来する分子があります。遺伝子変異によって生じた分子は、免疫系がこれまで出会ったことがない分子であるため、がん細胞に特異的な新たな抗原 (neo-antigens)、すなわち異物として認識され、強いT細胞応答が誘導されるため、これらの抗原を多く発現している場合は、免疫チェックポイント抗体治療が効果を発揮しやすいこと報告されました。一方、冒頭で述べたように、免疫編集によってこのような免疫原性が高い異物として認識されるような抗原を脱落させたがん細胞も存在し、このような場合は免疫チェックポイント抗体治療が効果を発揮しにくいことが示されています。 すなわち、がんは免疫原性と免疫逃避機構によって2つに大別できます。
- neo-antigenを多く発現し、T細胞がready-to-goの状態であるにも関わらず、制御性T細胞や免疫チェックポイント分子などの免疫抑制機構を活用し、増殖しているようながん
- がん細胞自身が、免疫系に認識されないように免疫原性の高い抗原を脱落させ、自己もどきとなることで免疫系から逃避しているがん
1. が主な免疫抑制機構のがんでは、免疫チェックポイント分子による抑制を外すことで十分な抗腫瘍免疫応答を活性化できると考えられます。これらのバランスについての解析が進めば、がん免疫療法を選択する上でより適切なバイオマーカーを得ることができます。 一方、2. の機構が主にかかわっているがんでは、多くのがん抗原は自己由来であり、私たちのグループが示したような自己免疫寛容機構が抗腫瘍免疫応答を抑制していると考えられるため、制御性T細胞を除去した上で、免疫応答を活性化する必要があると考えられます。またがん自身が重要な遺伝子異常やシグナルを用いて積極的に抗腫瘍免疫応答を抑制するようなシステムを持っていることも見出しつつあります。私たちの研究室では、これらの機構をさらに詳細に解明することにより、免疫チェックポイント抗体治療に効果を示す患者さんを層別化するバイオマーカーの同定、さらに、制御性T細胞などの免疫抑制機構を解明することにより、がんに対する免疫抑制を効率的に解除するような、有効で安全ながん免疫治療を開発するための研究を進めています。
- 竹内美子,西川博嘉:がん免疫療法における制御性T細胞の意義.腫瘍内科 16:360-366, 2015
- Nishikawa H, Sakaguchi S. Regulator T cells in cancer immunotherapy. Curr Opin Immunol, 27:1-7, 2014 [PubMed(外部サイトにリンクします)]
- Maeda Y, Nishikawa H, Sugiyama D, Ha D, Hamaguchi M, Saito T, Nishioka M, Wing JB, Adeegbe D, Katayama I, Sakaguchi S. Detection of self-reactive CD8⁺ T cells with an anergic phenotype in healthy individuals. Science, 346:1536-1540, 2014 [PubMed(外部サイトにリンクします)]
- Sugiyama D, Nishikawa H, Maeda Y, Nishioka M, Tanemura A, Katayama I, Ezoe S, Kanakura Y, Sato E, Fukumori Y, Karbach J, Jäger E, Sakaguchi S. Anti-CCR4 mAb selectively depletes effector-type FoxP3+CD4+ regulatory T cells, evoking antitumor immune responses in humans. Proc Natl Acad Sci USA, 110:17945-17950, 2013 [PubMed(外部サイトにリンクします)]
- Phase Ia/Ib Multicenter Trial of Mogamulizumab for Advanced or Recurrent Cancer. ClinicalTrials.gov ID: NCT01929486 [ClinicalTrials.gov(外部サイトにリンクします)]
