トップページ > グループ紹介 > 免疫トランスレーショナルリサーチ分野(柏) > 主な研究内容 > がん微小環境へのT細胞浸潤機構の解明
がん微小環境へのT細胞浸潤機構の解明
がん細胞によって形成されるがん微小環境では正常組織とは異なる生体反応が認められます。その一つとして、血管新生因子の放出による血管新生の促進がみられ、がん細胞が無限に増殖するための栄養素の運搬に寄与しています。一方で、がん細胞の排除に関わるキラーT細胞やがん細胞の生存を助ける免疫抑制細胞も新生血管を通して流出もしくは流入しています(図1)。
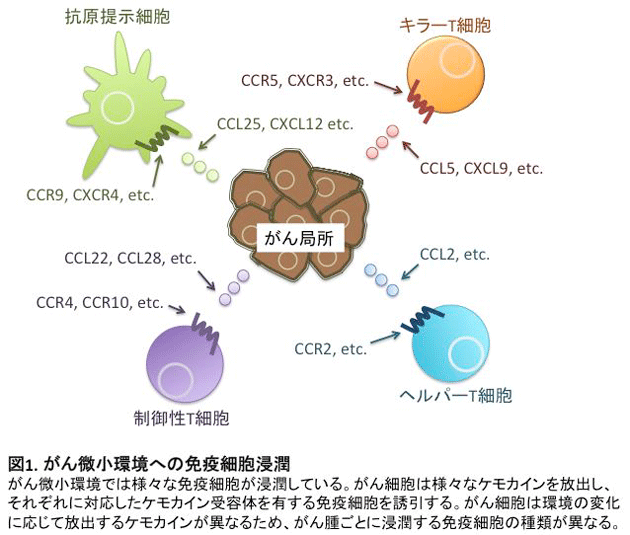
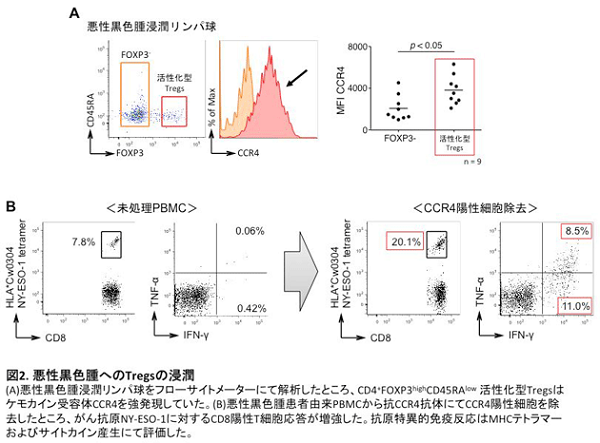
これらの細胞輸送に関わる因子として、ケモカインと呼ばれる化学走化性因子が関係しています。免疫担当細胞はさまざまなケモカイン受容体を発現し、それぞれの受容体に対応するケモカインに引き付けられ組織に遊走し、集積します。現在まで、約50種類のケモカインと約20種類のケモカイン受容体が同定され、それらを産生・発現する細胞も明らかにされてきています。近年では、がん細胞のがん化およびそれに関連するシグナル伝達とケモカイン産生の関連性が詳細に解析され、がん微小環境への免疫担当細胞の浸潤機構に関する研究が盛んに行われています1,2。これまでに私たちは、悪性黒色腫患者検体を用いた研究において、悪性黒色腫局所に浸潤しているCD4+FOXP3highCD45RAlo制御性T細胞(活性化型制御性T細胞)がケモカイン受容体4(CCR4)を強発現していることを見出しました。さらに抗CCR4抗体を用いることでがん局所のTregsを選択的に除去することが可能であり、その結果として抗腫瘍免疫応答が増強することを報告しました3(図2)。この研究成果は、がん微小環境へのT細胞浸潤機構の一部を解明したものですが、がん種ごとのT細胞浸潤機構やT細胞およびがん細胞におけるケモカイン、ケモカイン受容体の発現制御機構について未だに解明されていないことが数多く存在します。
私たちの研究室では、がん患者検体およびマウスモデルを用いて、がん微小環境への新たなT細胞浸潤機構について研究を進めています。特にがん自身が重要な遺伝子異常やシグナルによって積極的に抗腫瘍免疫応答を抑制するようなシステムを持っていることも見出しつつあります。この研究成果から、がん微小環境へのキラーT細胞浸潤を促進し、かつ免疫抑制細胞の浸潤をブロックする細胞浸潤の制御機構を明らかにし、新規がん免疫療法の開発につなげることを目指しています。
- Spranger S, Bao R, Gajewski TF. Melanoma-intrinsic β-catenin signalling prevents anti-tumour immunity. Nature, 523:231-235, 2015 [PubMed(外部サイトにリンクします)]
- Serrels A, Lund T, Serrels B, Byron A, McPherson RC, von Kriegsheim A, et al. Nuclear FAK controls chemokine transcription, Tregs, and evasion of anti-tumor immunity. Cell, 163:160-173, 2015[PubMed(外部サイトにリンクします)]
- Sugiyama D, Nishikawa H, Maeda Y, Nishioka M, Tanemura A, Katayama I, et al. Anti-CCR4 mAb selectively depletes effector-type FoxP3+CD4+ regulatory T cells, evoking antitumor immune responses in humans. Proc Natl Acad Sci USA, 110:17945-17950, 2013 [PubMed(外部サイトにリンクします)]
