トップページ > 研究組織一覧 > 分野・独立ユニットグループ > 医療AI研究開発分野 > 研究プロジェクト > ヒトがん細胞におけるヒストンメチル化異常の解析
ヒトがん細胞におけるヒストンメチル化異常の解析
タンパク質メチル化とは
メチル化はタンパク質翻訳後修飾の一つであり、タンパク質メチル化という現象自体は1950年代に既に報告されていた。一方、その機能に関しては長い間不明であったが、21世紀に入り、我々のグループを含め複数のグループからタンパク質メチル化酵素の存在が報告され、ヒストンメチル化を介したエピジェネティクス制御を中心に、急速にその機能解析が進んだ。その結果タンパク質メチル化は、リン酸化などと同様、タンパク質の機能制御において重要な翻訳後修飾であることが、現在では解明されている。主要なメチル基供与体であるS-adenosyl-L-methionine (AdoMet, SAM)が、生体内でATPに次いで多い補酵素であるという事実も、メチル化という修飾の重要性を示唆している。必須アミノ酸の中では、リジン残基とアルギニン残基のメチル化の解析が進んでおり、リジン残基にはmono-methylation、di-methylation、tri-methylationという3種類の修飾タイプが存在し(図1)、アルギニン残基には、NG-mono-methyl arginine、asymmetric NG,NG-di-methyl arginine (ADMA), symmetric NG,NG’-di-methyl arginine (SDMA)(図1)という3種類の修飾タイプが存在する。アルギニンメチル化酵素は、ADMAを産生するType I酵素群とSDMAを産生するType II酵素群に大別される(図1)。
タンパク質メチル化の基質としては、ヒストンが活発に研究されており、図2に示す通りに、メチル化される部位または修飾タイプの違いにより、異なる機能を有する。また、長い間タンパク質メチル化は不可逆的な現象と考えられていたが、近年タンパク質脱メチル化酵素が多数報告され、タンパク質メチル化はダイナミックな現象であることが解明されている。脱メチル化のメカニズムは2つに大別され、一つはLSD1のようにFAD依存性のアミンオキシダーゼによる酸化・還元反応に基づく脱メチル化機構である(図3)。もう一つは、JmjCドメインを持つ脱メチル化酵素群によるメチル基除去機構で、水酸化反応に基づき脱メチル化反応が司られる(図3)。
ヒトがんとヒストンメチル化異常
近年の大量の臨床検体を用いた、大規模遺伝子発現解析及び体細胞変異解析の結果、ヒトがんにおいて、複数のタンパク質メチル化酵素及び脱メチル化酵素の発現異常、または体細胞変異が検出されている。これらの酵素の中には、がん特異的に高発現している酵素や、体細胞変異の結果がん特異的に活性が顕著に上昇する酵素も含まれており、新規がんの分子標的治療の標的として注目されている。がん細胞におけるヒストンメチル化異常に関しては、我々のグループも含め、世界中で活発に研究されてきたが、未だ不明な点が多いのも事実である。我々は、がん特異的に発現異常または体細胞変異を起こしているメチル化酵素及び脱メチル化酵素に焦点をあて、網羅的な機能解析を行うことにより、新規がんの分子標的治療法創生に発展させていくことを目標としている。
Polycomb Repressive Complex 2 (PRC2)と発がん(担当:金子)
ヒストンメチル化を介した遺伝子発現制御機構の解明が活発に進められている酵素の1つとして、ポリコーム群タンパク質複合体2(PRC2)が挙げられる(図4)。近年の高感度質量分析技術や次世代シークエンシングによって、様々なPRC2関連因子及びその下流遺伝子群が同定されているが、触媒活性に必須な因子としてEZH01月02日, SUZ12, EEDが挙げられる。さらに、EZH01月02日のSETドメインが直接ヒストンH3のリジン27番目をメチル化する活性を持つ。転写抑制因子と共にヒストンH3K27番目の異常なメチル化が、がん抑制遺伝子の転写抑制状態の維持に寄与していると考えられている。近年EZH2のSETドメインを標的にしたがん治療薬の開発が活発に行われており、次世代のがん分子標的治療薬として期待されている。
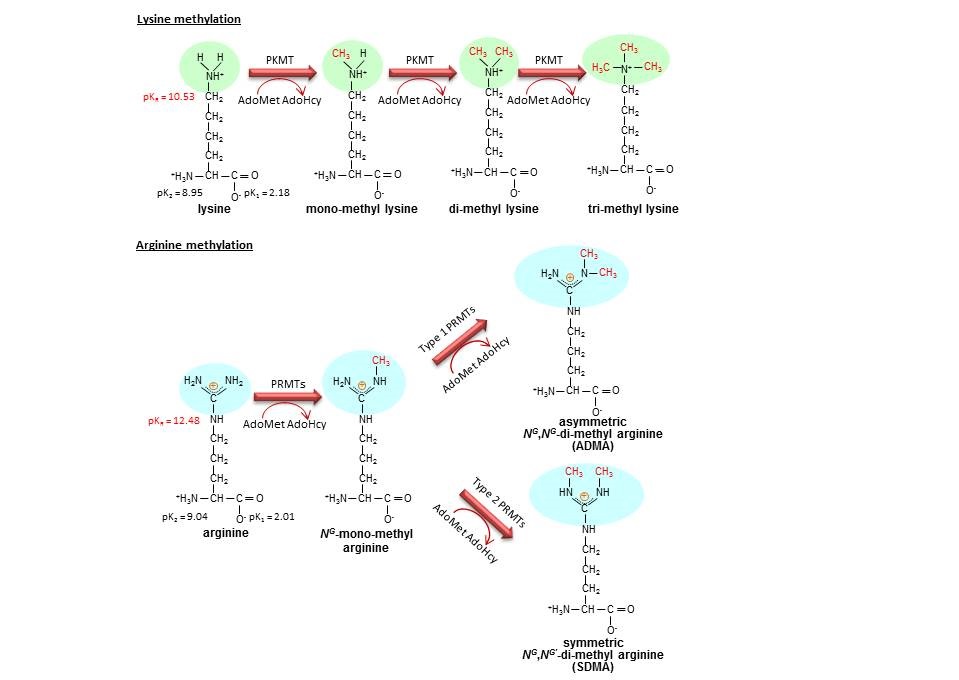
図1:リジン及びアルギニンメチル化の分子メカニズム
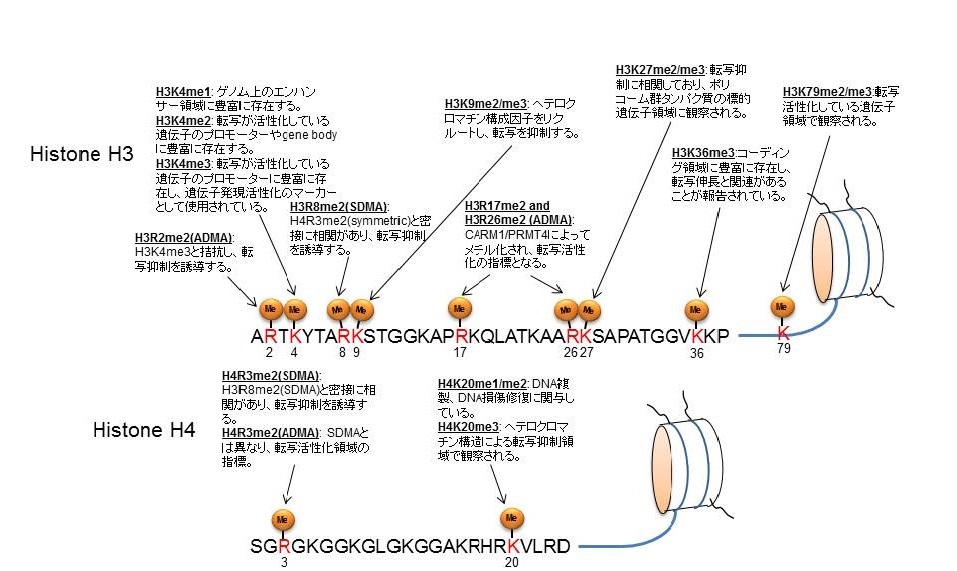
図2:ヒストンメチル化部位とその機能
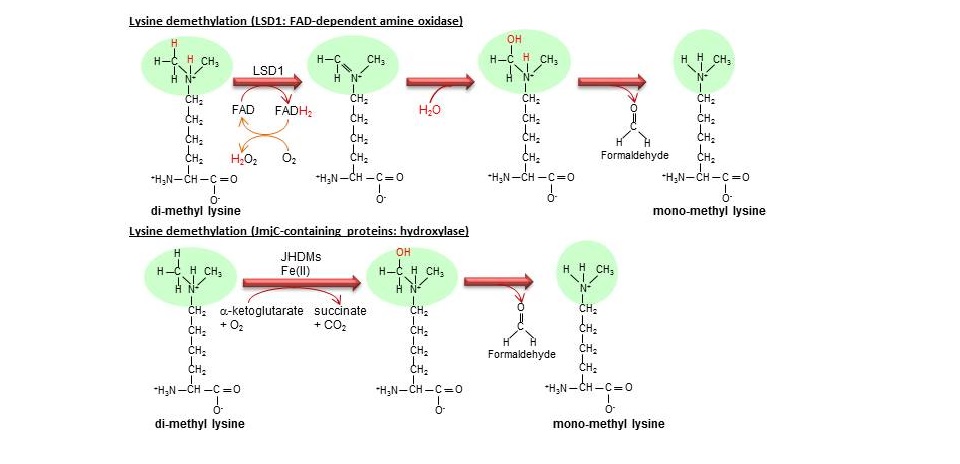
図3:タンパク質脱メチル化の分子メカニズム
![]()
記述、画像、写真の無断転載・転用を禁止します。

