トップページ > 研究組織一覧 > 分野・独立ユニットグループ > 分子薬理研究分野 > 研究プロジェクト > 質量分析技術を用いた薬物血中濃度測定法の開発
質量分析技術を用いた薬物血中濃度測定法の開発
更新日 : 2021年9月29日
LC-MS/MS測定による薬物濃度分析法開発
液体クロマトグラフ質量分析計(High Performance Liquid Chromatography - Mass Spectrometer: HPLC-MS/MS)とは高速液体クロマトグラフにより分離された有機成分をイオン化、MSに取り込み原子や分子を電場や磁場を利用し分析する技術です。本技術は短時間にm/z 5-2000の幅広い分子スペクトラムが取得できることから、有機化学や生化学などの分野で広く普及し重要な分析法となっています。
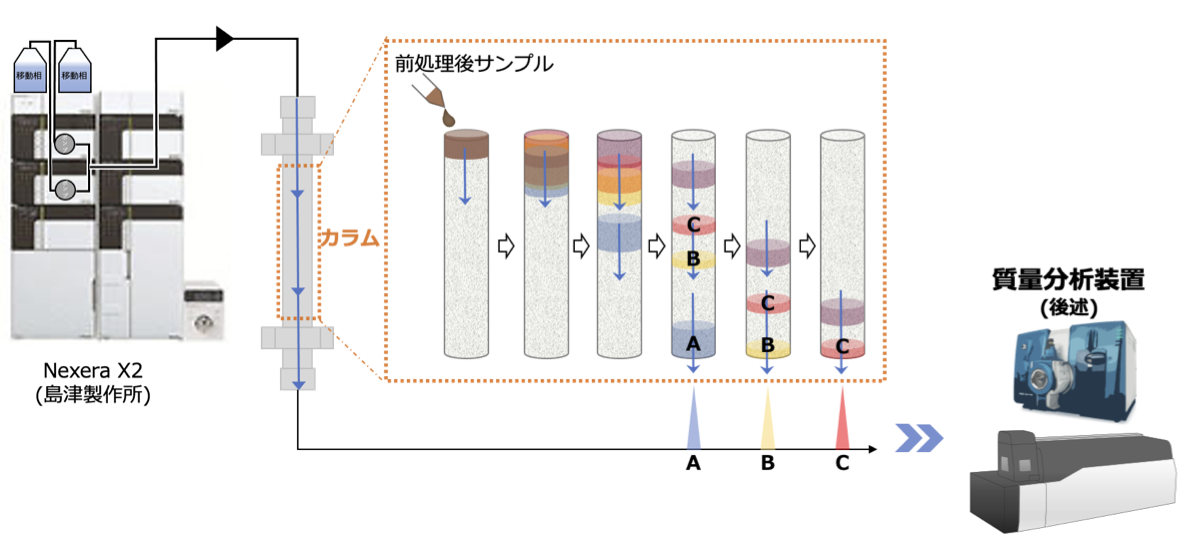
HPLCは、下記の図に示すようにカラム導入前は混合状態だった化合物が、移動相にのってカラム充填剤との相互作用によりカラム内を進む速度に違いが生じた結果分離させる技術です。充填材にはオクタデシルシリル基で表面が修飾された多孔性球状シリカゲルが頻用され、化合物ごとの疎水性相互作用の違いにより効率よく分離されます。当ラボでは高圧条件のもと短時間に分離させ、サンプル内の夾雑物と測定対象物質の分離分析を行なっています。
低分子医薬品微量濃度測定におけるトリプル四重極リニアイオントラップ質量分析装置(QTRAP)の活用について
QTRAPはサンプル溶液を高電圧下にてイオン化し、トリプル四重極注釈1により優れた定量結果が得られます。オプションでQTRAP機能を作動させれば、装置はリニアイオントラップ注釈2(LIT)として機能し、高感度な測定を可能とします。当ラボでは低分子医薬品微量濃度測定においてHPLCと接続したQTRAPサンプル測定により多成分多検体の高スループットな測定を実行しています。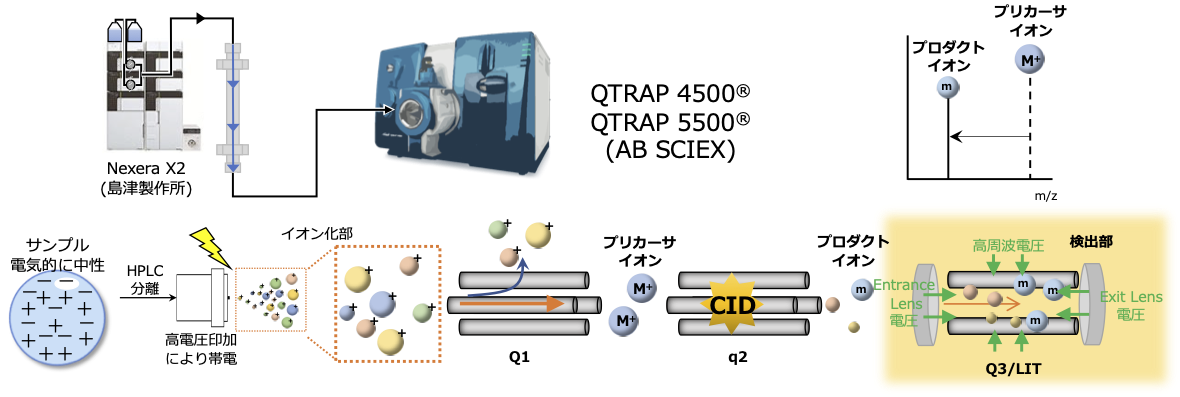
注釈1:トリプル四重極分析モード(質量範囲:m/z 5-2,000) : 微量定量に最も汎用されています。
注釈2:リニアイオントラップ(LIT)分析モード(質量範囲:m/z 50-1,000):q2を通過したイオンを電場により空間補足(トラップ)する技術です。任意のイオンを一定時間蓄積させてから検出でき、高分解能で良質なスペクトル取得が可能です。
生体試料中低分子医薬品測定実績一覧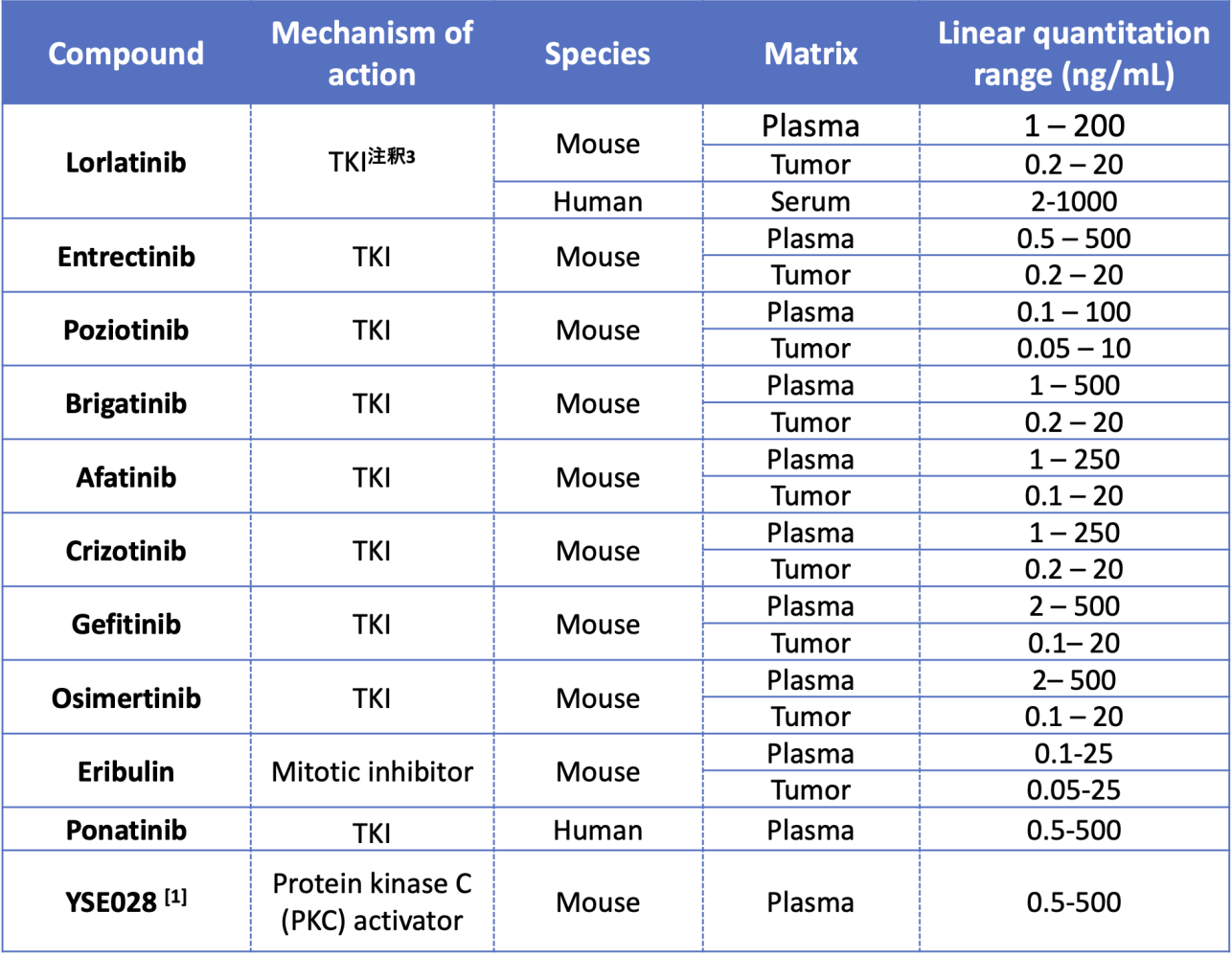
注釈3 TKI: Tyrosine kinase inhibitor
[1] 本測定法はMatsuda K, Kobayakawa T, Kariya R, Tsuchiya K, Ryu S, Tsuji K, Ishii T, Gatanaga H, Yoshimura K, Okada S, Hamada A, Mitsuya H, Tamamura H, Maeda K. A Therapeutic Strategy to Combat HIV-1 Latently Infected Cells With a Combination of Latency-Reversing Agents Containing DAG-Lactone PKC Activators. Front Microbiol. 2021 Mar 17;12:636276. doi: 10.3389/fmicb.2021.636276. PMID: 33815322; PMCID: PMC8010149. にて掲載された論文に用いられています。
- 低分子LC-MS/MSの応用例1
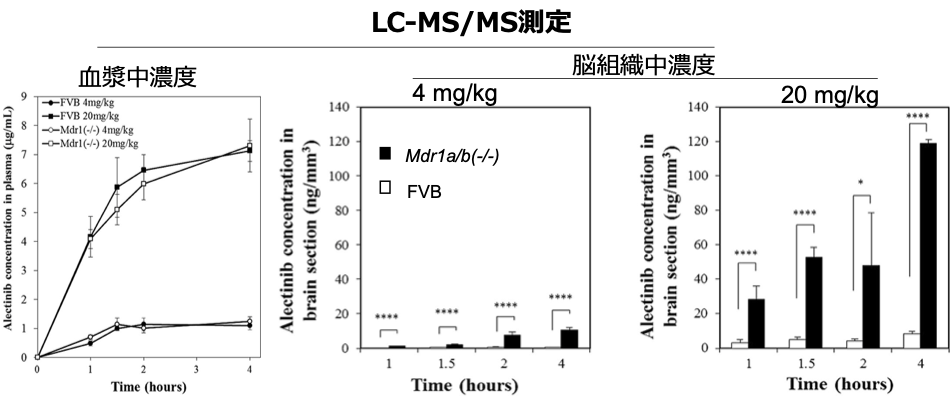
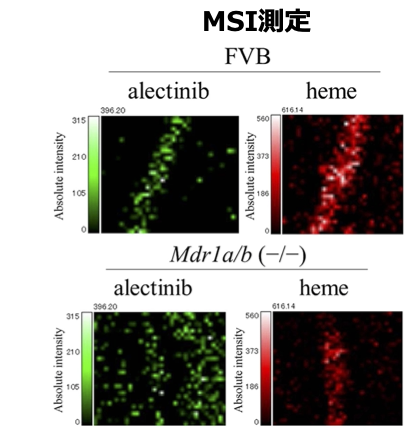
Mass Spectrometry Imaging (MSI)測定との組み合わせでアレクチニブ脳内の薬物動態の解明
FVB (野生型) マウス、Mdr1a/b(-/-)( P糖タンパク質欠損)マウスにアレクチニブを経口投与し、経過時間ごとの血中濃度、脳内濃度をLC-MS/MS法により定量しました。FVB群とMdr1a/b欠損群を比較すると、血中濃度には差が見られませんでしたが、脳内濃度はMdr1a/b欠損群において有意に高濃度のアレクチニブ蓄積が見られました。MSI測定により血中濃度および脳内濃度測定でFVB群においてわずかに脳内移行しているように見られたアレクチニブが脳内の血管に留まっていたことを示唆しました。(Aikawa H., et al. Sci Rep. 2016,30;6時23分749.)
- 低分子LC-MS/MSの応用例2
MSIによる半定量分析の評価への応用
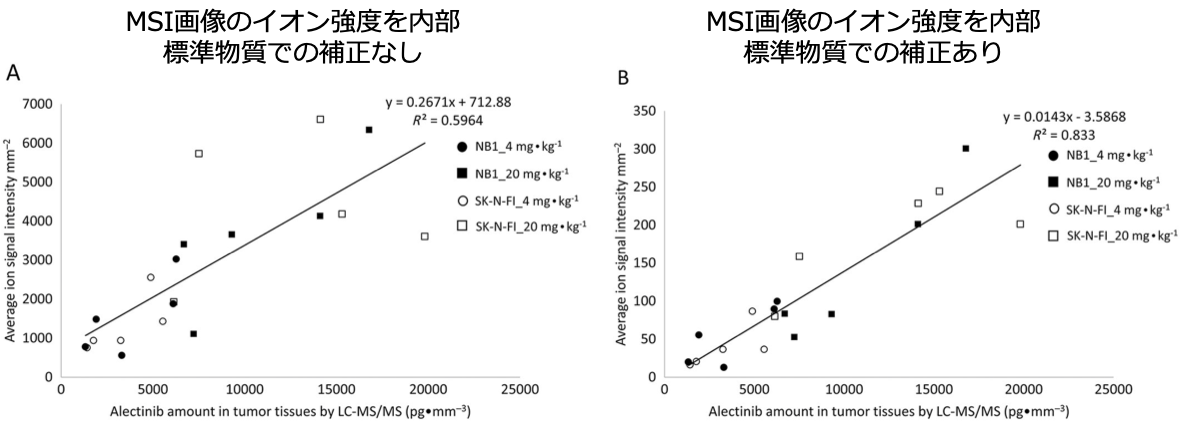
LC-MS/MSにて測定した腫瘍組織中アレクチニブの濃度とMSI画像イオン強度の相関を比較しました。内部標準物質で補正したMSI画像のイオン強度がLC-MS/MSで定量した単位面積当たりの薬剤含量と良好な相関を示しました。LC-MS/MS測定をMSI測定と並行して行うことで、MSIによる半定量分析を評価できます。(Ryu S, et al. Br J Pharmacol. 2018 Jan;175(1):29-37.)
タンデム四重極型質量分析装置を用いた抗体濃度定量分析
◎ 抗体医薬品をLC-MS/MSで測定するメリット抗体濃度測定にはELISA法による抗原抗体反応による蛍光分析が行われてきました。しかし、ELISA法は抗体それぞれにキャプチャー用抗体やリガンド開発のコストが掛かること、また交差反応による非特異的シグナル発生の可能性など欠点が挙げられます。
当ラボではLCMS8050を用いた抗体濃度分析により以下のメリットを提示致します。
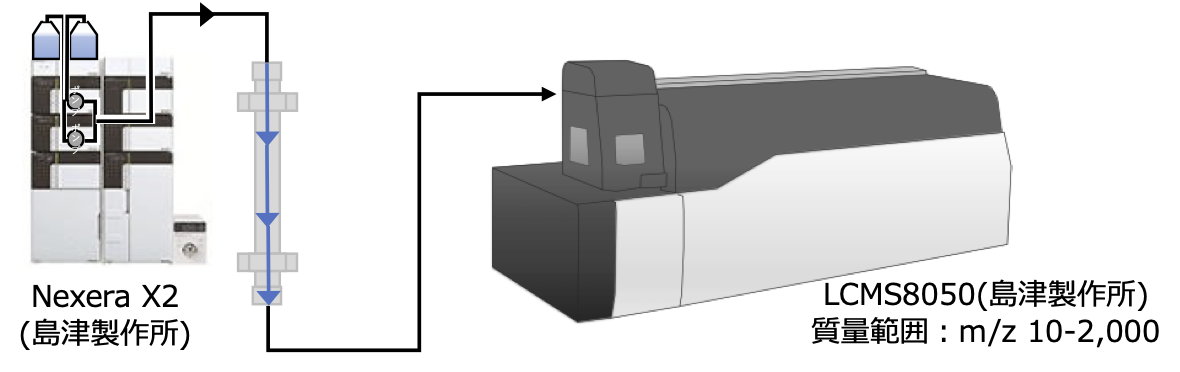
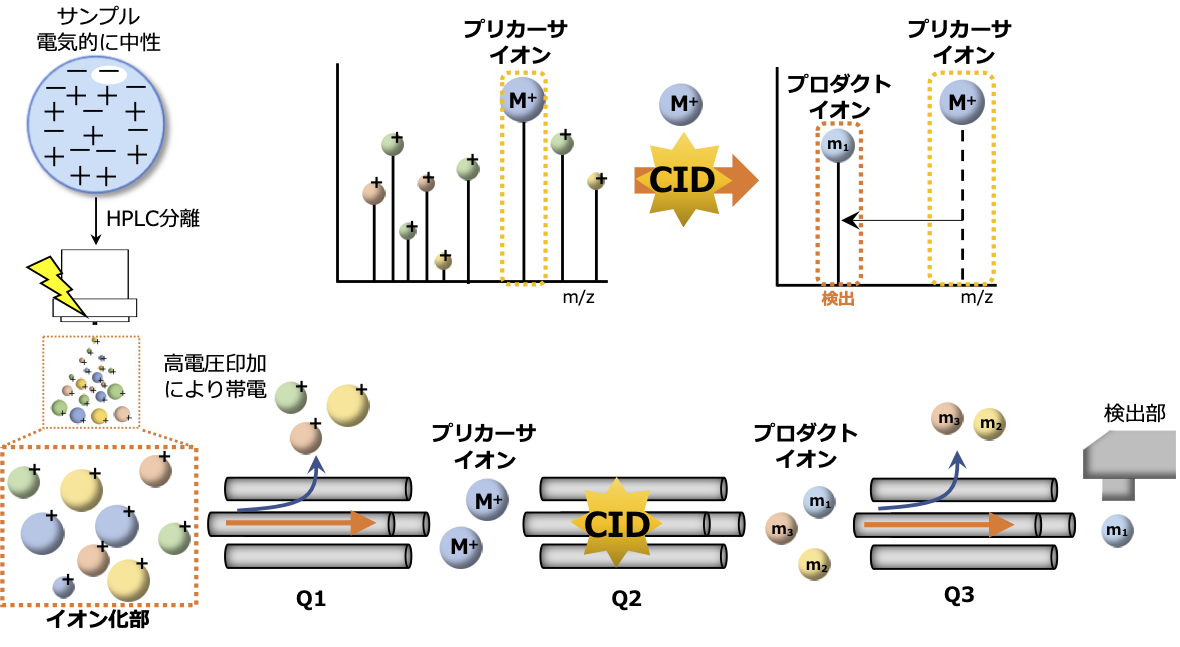
◎ LCMS8050の特徴:四重極(Quadrupole : Q)を3連続接続した質量分析装置です。
多重反応モニタリング(multiple reaction monitoring: MRM)による測定:Q1でプリカーサイオンを選択し、衝突誘起解離(Collision-induced dissociation:CID)により生じる構造情報が反映されたプロダクトイオンをQ3で選択します。プリカーサイオンとプロダクトイオンの両方を特定しモニターするため夾雑成分の少ない選択性の高い定量分析が可能です。
- 生体試料中における抗体医薬品濃度測定技術開発例 (例:Nivolumab)

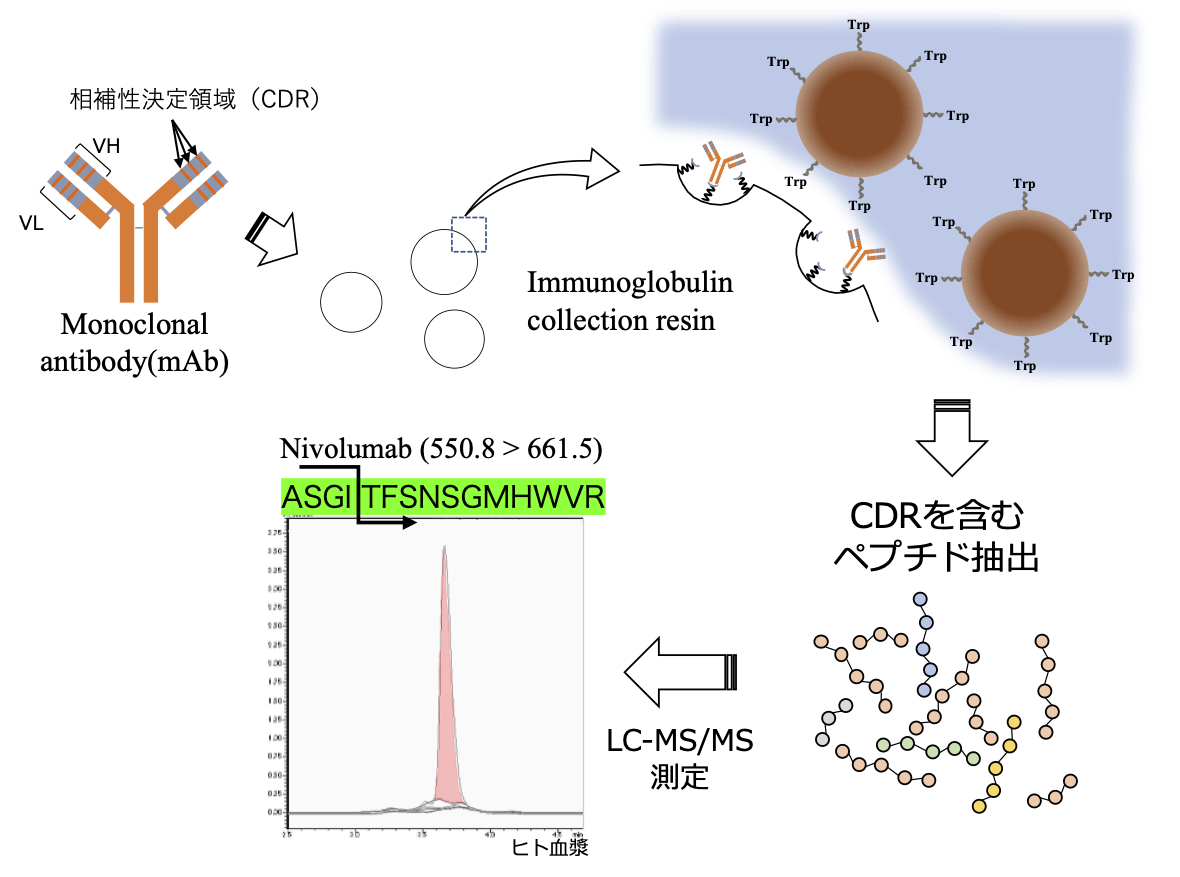
◎ 抗体シグネチャーペプチド測定による定量分析
- 抗体H鎖とL鎖のN末端サブユニットを可変領域(V領域)と呼び、それ以外の領域を定常領域(C領域)と呼びます。
- V領域には抗原と結合し特異性を定める相補性決定領域(complementarity determining region:CDR)が存在するため、本領域を含むアミノ酸配列(シグネチャーペプチド)はモノクローナル抗体に特有となります。
- nSMOL(nano-surface and molecular-orientation limited proteolysis)法は樹脂(resin)細孔部に抗体C領域が結合し、抗体の向きが固定されることで溶液方向に向いたV領域が効率よくトリプシン消化されます。
- 1つのモノクローナル抗体には通常、H鎖とL鎖両方にCDR領域が3つずつ含まれます。これら複数のシグネチャーペプチド候補のどれを測定系に組み込むかは、生体試料マトリックスのバックグラウンドやnSMOL法におけるペプチド抽出効率によって決定されます。当ラボでは選択性と定量性のバリデーションを実施し、再現性を重視した定量分析を行なっています。
生体試料中の抗体濃度測定測定実績一覧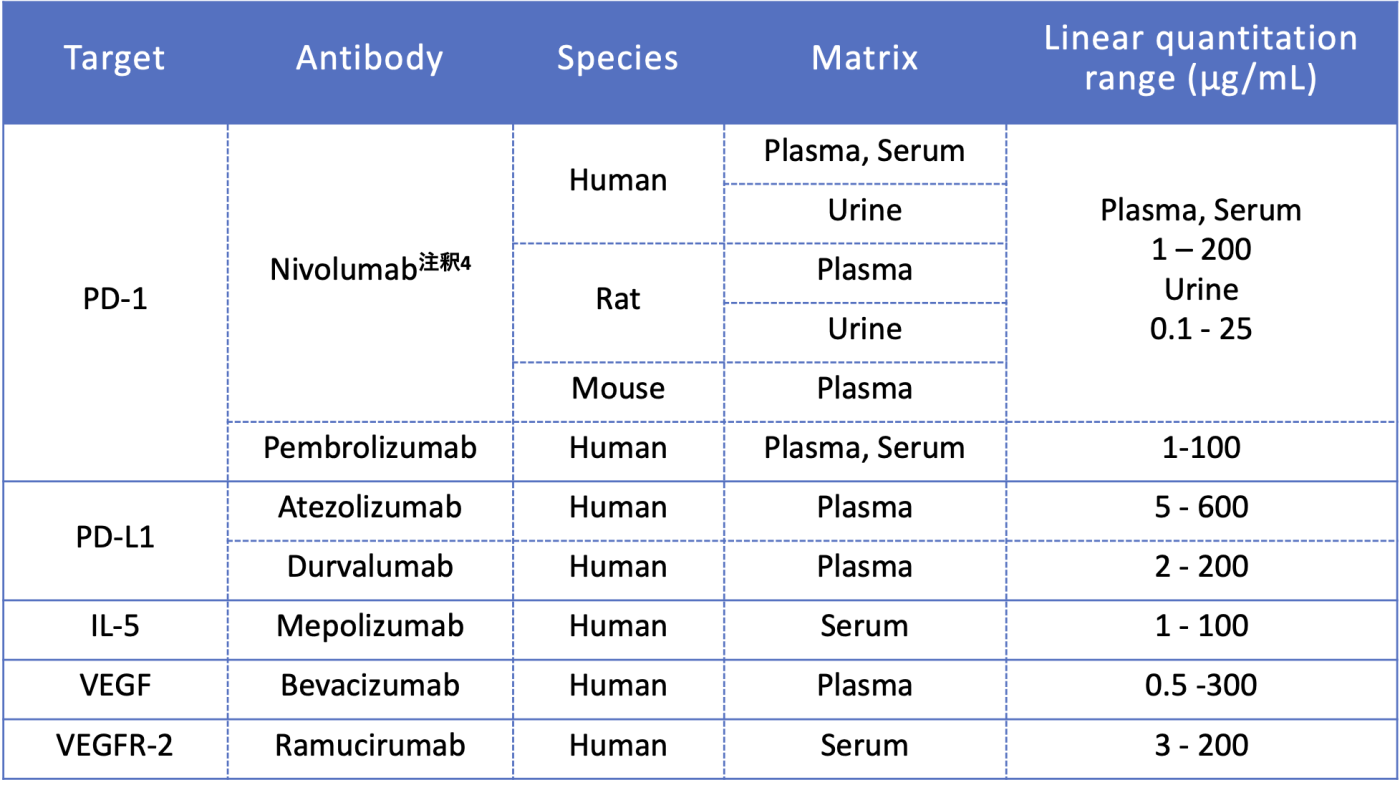
注釈4:本測定法はM. Ohuchi et al. J Chromatogr B Analyt Technol Biomed Life Sci 2021 Vol. 1162 Pages 122489とK. Taguchi, Y. Hayashi, M. Ohuchi et al. Drug Metab Dispos 2021にて掲載された論文に用いられています。
低分子または抗体医薬品薬物濃度分析を検討されている方へ
当分野での薬物濃度分析は厚生労働省が示す「医薬品開発における生体試料中薬物濃度分析法のバリデーションに関するガイドライン」もしくはアメリカ食品医薬品局が示すガイドライン“Bioanalytical Method Validation Guidance for Industry”に準拠した判断基準に従い、精度と再現性の高い測定を実施しております。
当分野ではイメージング質量顕微鏡(iMScope)や高輝度蛍光ナノ粒子による免疫染色イメージングを実施しています。これらのイメージング技術の連携により血中、組織、腫瘍中薬物濃度測定及び分布の可視化を実現します。
薬物動態解析にご関心をお持ちで共同研究をご希望の場合には、ぜひ当分野への連絡をお願いいたします。
文責:大内麻由、劉晶楽