日米国際連携による希少がんの本態解明研究十二指腸乳頭部がんの大規模ゲノム解読を実施
がんゲノムの「進化」も新たな手法で実証
2016年1月26日
国立研究開発法人 国立がん研究センター
国立大学法人 東北大学
学校法人 東京女子医科大学
公立大学法人 和歌山県立医科大学
国立大学法人 広島大学
国立大学法人 香川大学
今回の公表ポイント
- 希少がんである十二指腸乳頭部がん(ファーター乳頭部がん)について、日米の国際連携により大規模なゲノム解読を実施。ゲノム異常の観点から、世界で初めて十二指腸乳頭部がんの本態解明が行われた。
- 十二指腸乳頭部がんのゲノム異常を解明し、特徴的ながん関連遺伝子(ELF3)を発見。がんの運動能や浸潤能と関連するがん抑制遺伝子であることを明らかにした。
- 組織・形態学的亜型分類に基づく解析の結果、腸型は大腸がんに、膵胆型は膵臓がんに類似したゲノム異常を有していることがわかった。
- 十二指腸乳頭部がんの約半数に、治療標的となり得る遺伝子異常を検出。個別化治療への応用が期待される。
- 十二指腸乳頭部がんの同一腫瘍内のがんゲノムの不均一性(Heterogeneity)と「進化」を実証した。
国立研究開発法人国立がん研究センター(理事長:堀田知光、東京都中央区、略称:国がん)研究所・がんゲノミクス研究分野の谷内田真一ユニット長らの研究グループは、希少がんである十二指腸乳頭部がん(ファーター乳頭部がん)について、世界で初めて全エクソン・シーケンス解析(注1、注2)をはじめとする大規模ゲノム解読を行い、特徴的ながん関連遺伝子(ELF3)と治療標的となり得る遺伝子異常を同定し、さらに新技術の導入により同一腫瘍内のゲノムの不均一性とその「進化」を実証しました。がんゲノムの「進化」とは、ダーウィン的理論にしたがい、発がんから治療に至る時間経過のなかでがん細胞が競合的選択に曝されることで自然淘汰され、抗がん剤が効かなくなる薬剤耐性を獲得するなど同一腫瘍内でも遺伝子異常を蓄積しながら変化し続けることです。
本研究成果は、米国専門誌「Cancer Cell」2月号の掲載に先行し、オンライン版にて公開されました。
本研究は、文部科学省科学研究費補助金 新学術領域研究(システムがん:領域代表 宮野 悟 東京大学医科学研究所 教授)などの支援を受け、日本の6施設(国立がん研究センター中央病院、東北大学、東京女子医科大学、和歌山県立医科大学、広島大学、香川大学)と米国メリーランド州・ジョンズホプキンス大学との国際連携で収集した172例の十二指腸乳頭部がんの手術検体(凍結サンプル)を用いて、同がん種の本態解明に挑むべく実施しました。また、がんの進展メカニズムの解明においては、オリンパス株式会社が新開発した組織分取機器(Glass Chip Macrodissection:GCM)を用いました。
今後の展望
本研究成果により、希少がんである十二指腸乳頭部がんの個別化治療や、標準治療の層別化、さらに創薬に向けた基盤データの蓄積につながることが期待されます。
また、希少がんに関する本態解明研究や創薬開発研究には、さまざまな研究機関のネットワークを構築し、特殊な技術・機能を有する企業の技術力も積極的に活用することで、「希少がんに対する個別化医療の実現(実装)研究」を促進できることが実証できました。国立がん研究センターは、このような連携により、今後さらに、希少がんの個別化医療実現を目指した研究を強化してまいります。
十二指腸乳頭部(ファーター乳頭部)がんとは
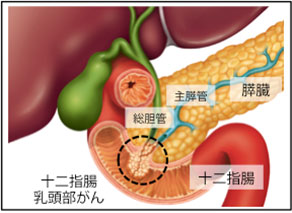
十二指腸乳頭は、膵臓内を通過する総胆管と主膵管が合流した共通管が十二指腸に開口する部分を指し、乳頭状にわずかに膨隆しています。ファーター乳頭部とも呼ばれ、18世紀のドイツ人解剖学者のAbraham Vaterが記載したことに由来しています。
十二指腸乳頭部がんは、本邦では胆道がんに分類されていますが、WHO分類では小腸がんを経て、2010年からは独立した疾患として分類されるなど、疾患概念も明確でなく、また手術や内視鏡切除以外の標準治療法も確立していません。
発症率は、香川県全体における後ろ向きコホート研究の報告(Okano K et al, J Surg Oncol 2014)では1人未満/10万人であり、希少ながんといえます。
また、本邦では上部消化管内視鏡検査(胃カメラ)が普及し、検査で十二指腸乳頭部を観察することから比較的早期に発見されることが多い一方、欧米の5年生存率は十二指腸乳頭部にとどまる場合は45%、周囲組織に浸潤した場合は31%、リンパ節や遠隔転移を伴う場合はわずかに4%で難治がんともいえます(Bosman FT et al, WHO classification of Tumour of the Digestive System 2010)。
組織・形態学的には、1994年にKimura(現:山形大学医学部・第1外科 木村 理 教授)らによって腸型と膵胆型に亜型分類され、(Kimura W et al, Jpn J Cancer Res 1994)、その後この亜型分類は世界で広く普及し、膵胆型は腸型と比較して悪性度が高いことが知られています。しかし、希少なため大規模な検体収集が困難で、亜型分類に基づく分子遺伝学的な異常(ゲノム異常)の差異はほとんどわかっておらず、次世代シーケンサー(注3)などの最新技術を用いた網羅的なゲノム解読を行うことでの本態解明が求められていました。
本研究成果の概要
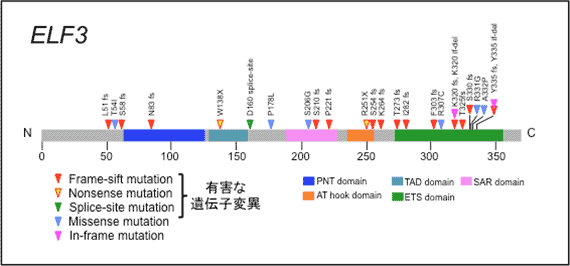
十二指腸乳頭部がんに特徴的な遺伝子(ELF3)変異を発見し、機能解析によりELF3はがんの運動能や浸潤能に関連するがん抑制遺伝子であることがわかりました。
172例の十二指腸乳頭部がんの全エクソンならびにターゲット・シーケンス解析の結果、統計学的な解析で有意にがんの発生・進展と関連のある24個のドライバー遺伝子が同定されました。 また、KRASやTP53などよく知られているがん遺伝子・がん抑制遺伝子に加え、これまでにほとんど報告のない遺伝子であるELF3を6番目に認めました(下表参照)。
ELF3の遺伝子変異パターン
| 遺伝子 | 頻度(%) | p値 | q値 | |
|---|---|---|---|---|
| 1 | KRAS | 47.7 | 1.14-118 | 1.06-11 |
| 2 | TP53 | 55.8 | 5.88-117 | 2.73-115 |
| 3 | CTNNB1 | 23.3 | 2.71-22 | 8.40-21 |
| 4 | SMAD4 | 16.3 | 4.37-16 | 1.02-14 |
| 5 | APC | 33.7 | 1.89-14 | 3.52-13 |
| 6 | ELF3 | 12.2 | 1.15-11 | 1.78-10 |
| 7 | GNAS | 11.6 | 5.58-08 | 7.41-07 |
| 8 | ACVR2A | 7.6 | 1.34-05 | 0.000147192 |
| 9 | ERBB3 | 10.5 | 1.42-05 | 0.000147192 |
| 10 | ACVR1B | 8.1 | 4.60-05 | 0.000428017 |
ELF3はアミノ酸が371個の小さな遺伝子ですが、十二指腸乳頭部がんでは遺伝子のさまざまな部位に変異を認め、その変異の多く(17/25、68%)はタンパクを短縮させるような有害な遺伝子変異であったため、がん抑制遺伝子と考えられました。
さらに、正常の胆管細胞株や十二指腸細胞株(共同著者:清野 透 発がん・予防研究分野 主任分野長が樹立)を用いた実験では、ELF3遺伝子の働きを阻害すると細胞の運動能や浸潤能が亢進し、上皮間葉転換(注4)に関連する遺伝子発現の変動が観察されました。これらの機能解析から、十二指腸乳頭部がんで検出された変異はがんの浸潤や転移に関連している遺伝子異常である可能性が示唆されました。また、ELF3の遺伝子変異は日米の患者さんにおいてほぼ同頻度で検出されたことから、人種差を超えて共通したゲノム異常であることが示されました。
組織・形態学的分類に基づく解析の結果、腸型は大腸がんに、膵胆型は膵臓がんに類似したゲノム異常を有していることがわかりました。
(1)腸型の十二指腸乳頭部がんと大腸がんはAPC、TP53、KRASの順、(2)膵胆型の十二指腸乳頭部がんと膵臓がんはKRAS、TP53、SMAD4の順で、遺伝子変異がみられることが分かりました。つまり、組織・形態学的な亜型分類はゲノム異常も類似していることが実証され、亜型分類に基づく治療の層別化の可能性が示唆されました。また、今回新たに同定したELF3遺伝子の変異は、(1)腸型と(2)膵胆型のいずれの亜型にもほぼ同じ頻度で観察されました。
| (1)腸型の 十二指腸乳頭部がん | 大腸がん | (2)膵胆型の 十二指腸乳頭部がん | 膵臓がん | |
|---|---|---|---|---|
| 1 | APC(50%) | APC(81%) | KRAS(68%) | KRAS(99%) |
| 2 | TP53(46%) | TP53(60%) | TP53(67%) | TP53(33%) |
| 3 | KRAS(39%) | KRAS(43%) | SMAD4(20%) | SMAD4(16%) |
注1:Cancer Genome Atlas Network, Nature 2012
注2:Biankin AV et al, Nature 2012
十二指腸乳頭部がんの約半数に、治療標的となり得る遺伝子異常が見つかり、十二指腸乳頭部がんの個別化治療への応用が期待されます。
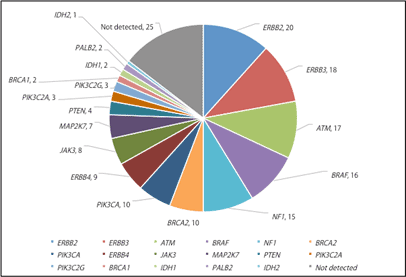
本研究で同定した十二指腸乳頭部がんにおけるゲノム異常の中には、右図に示すように多くの治療標的となり得る遺伝子(他のがん種において米国で治療薬として認められているものや、他のがん種の臨床試験において効果が認められているもの)が含まれていました。さらにそれらのゲノム異常を少なくとも1つ持つがんは全体の約50%を占めていました(右図では同一症例に重複して起こっている遺伝子についても分けて表示しているためにさらに高い割合になっています)。
これらのゲノム異常を標的とした治療薬が十二指腸乳頭部がんに対して有効かどうかは、検討を重ねる必要がありますが、十二指腸乳頭部がんの治療開発を国際連携で進めていく上で、今回の研究成果は重要な情報基盤となります。
十二指腸乳頭部がんの組織切片を用いて遺伝子変異地図を作成し、がんゲノムの不均一性(注5)とがんの「進化」(注6)を実証しました。
がんにはさまざまな遺伝子変異が生じることが分かっており、本研究においても特徴的な遺伝子変異や治療標的となり得る遺伝子異常を報告しています。
しかし、これらの遺伝子変異は一患者(同一腫瘍)において普遍的なものではなく、発がんから治療に至る時間経過のなかで、抗がん剤が効かなくなる薬剤耐性の獲得など、さまざまな遺伝子異常を蓄積しながら変化すると考えられています。これは、ダーウィン的理論にしたがい、がん細胞が生存に適するか否かの競合的選択に曝されることで、自然淘汰され「進化」し続けていることが考えられます。
これまで谷内田ユニット長らは、膵臓がんにおいてがん細胞は遺伝子変異などのゲノム異常を蓄積しながらがん細胞は「進化」することを報告してきました(Yachida S et al, Nature 2010;Campbell PJ et al, Nature 2010)が、依然として不明な点も多く、さらなる研究が求められていました。
そこで本研究においては、全く新しい組織分取技術を導入することでがんゲノムの多様性を正確に解析する手法を開発し、病理組織学的に多様性を認めた症例を例として、前がん病変である腺腫から粘膜内のがんと、腫瘍の最深部である浸潤部のゲノム解析を行い、その不均一性によるがんの「進化」を実証しました(下図参照)。
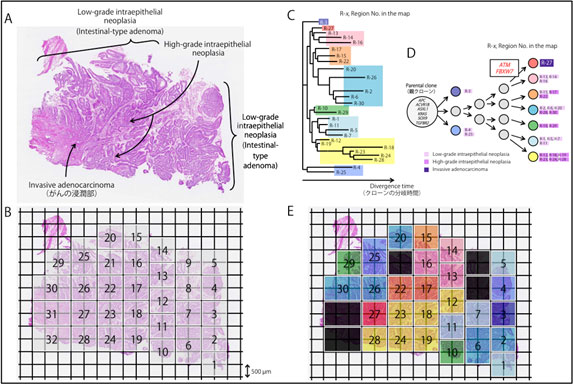
図A
腸型十二指腸乳頭部がんのある一例の組織切片を示しています。病理・形態学的に、この切片では前がん病変であるLow-grade intraepithelial neoplasia(いわゆる腸型腺腫)からHigh-grade intraepithelial neoplasia(いわゆる粘膜内のがん)を経て、Invasive adenocarcinoma(浸潤がん)に進行している様子が観察できます。
図B
この組織断片を、オリンパス社が新開発した組織分取法(GCM)の技術を用いて、500マイクロメートル(0.5ミリメートル)角でさいの目に切り各組織を回収し、正確な位置情報に基づき部位(region)ごとの全エクソン・シーケンス解析を行いました。
図C
がんの進展の過程では、がんは細胞増殖速度が速いために偶然に(二次的に)突然変異が生じます。この偶然に起きたと考えられる、アミノ酸が変わらない(synonymous)変異の遺伝情報に基づいて進化系統樹を作成しました。右に進むにつれて、時間とともにクローン(同じ遺伝情報をもつ細胞集団)が分岐し、別のクローン(サブクローン)に分かれていきます。
図E
図Cの同じ枝葉にあるがんクローンを色分けし、図Bにその色を付けたものが、図Eになります。同じ色で示したがんクローンは、近くの場所に存在することがわかります。
注:黒色の部位(region)は採取したDNA量の不足等で全エクソン・シーケンス解析ができなかったところです。
図D
さらに、図Cの進化系統樹を簡略化し、アミノ酸が変わる変異(nonsynonymous)をもつドライバー遺伝子(発がんやがん悪性化の直接的な原因となることが知られている遺伝子)の変異を加え、進化モデルを作成しました。
以上の結果、解析した腸型十二指腸乳頭部がんにおいては、Lowからhigh grade intraepithelial neoplasia(腺腫から粘膜内のがん)成分が安定して増殖し、組織切片の大部分を占め、これらは同一のドライバー遺伝子変異(APC遺伝子やKRAS遺伝子など)を有していました。
腫瘍の最深部であるがんの浸潤部(赤色)においてのみ、ドライバー遺伝子であるATMやFBXW7遺伝子の変異の蓄積がみられました。これらの遺伝子変異はがんの浸潤に影響し、これらの変異を有するクローンが、本患者の臨床経過において、リンパ節転移や遠隔転移と関連するドミナントな(優勢な)ものになっていくと考えられます。ATM変異はPARP(poly[ADP] –ribosepolymerase)阻害剤などの分子標的薬剤の標的となることから、現時点ではマイナーながんクローンかもしれませんが、再発・転移の治療の際にはこの変異を把握しておくことは重要と考えられます。
このように十二指腸乳頭部がんにおいても、同一腫瘍においてがんゲノムは不均一であり、組織・形態学的な変化とパラレルに遺伝子異常を蓄積することで、がんゲノムは「進化」することが証明されました。
用語解説
注1 全エクソン・シーケンス解析
全ゲノムのうち、エクソン配列のみを網羅的にシーケンス解析する手法である。ヒトゲノムのうち、全エクソンが占める割合はわずかに1から2%に過ぎないが、エクソンはタンパク質に翻訳される領域であるために機能的に重要である。
注2 シーケンス解析
ゲノムは染色体DNAの4種類の塩基[アデニン(A)、グアニン(G)、シトシン(C)、チミン(T)]配列を合わせたものである。DNAの塩基配列を解読することをシーケンス解析、もしくは単にシーケンスという。ヒトゲノムはおおよそ31億塩基対のDNAにコードされる遺伝情報をもっている。
注3 次世代シーケンサー
米国NIH(アメリカ国立衛生研究所)が主導した1,000ドルゲノムプロジェクトによって開発された新しいシーケンス技術の総称であり、独自の技術によって大量シーケンスを可能にした技術が複数実用化されている。従来のサンガー・シーケンス法と比べて、超大量のDNAシーケンス反応を並列して行う技術である。
注4 上皮間葉転換
がん細胞は上皮細胞由来でお互いの細胞が接着して存在しているが、上皮間葉転換が起こると、間葉細胞様、すなわち紡錘状の形態をとり細胞同士の接着が減弱する。その結果、移動可能な形質へと変換し浸潤や転移を可能にする。
注5 腫瘍内(がん)の不均一性(Heterogeneity)
がん細胞の形質を変化させる新たな遺伝子変異や、酸化ストレス・低酸素刺激をはじめとする微小環境からのストレスにより、がん細胞に新たな遺伝子異常を蓄積することで、生物学的特性の異なった多様ながん細胞が出現する。このようにがん組織は細胞レベルにおいて不均一性を有している。以下のがんクローンの進化と強く関係している。
注6 がんクローンの進化
共通の細胞より生じたがん(親クローン)の個々の細胞に、遺伝子変異などの異常が無秩序に生じてサブクローンが形成され、それがダーウィン的理論にしたがい生存に適するか否かの競合的選択に曝されることで、自然淘汰されがんが変化していくという仮説をいう。Peter Nowell 教授が1976年に固形がんにおけるダーウィン的進化論を初めて提唱し(Science, 1976)、Bert Vogelstein教授(共同著者)が提唱した大腸がんにおける多段階発がんモデル(Cell, 1990)はその一つの実証となった。最近の次世代シーケンス技術により、詳細なゲノム解析が可能となり、これらのモデルが大規模に検証され脚光を浴びている研究領域である。がんの不均一性とがんクローンの進化が、がんが難治である理由の一つであると考えられている。
発表論文
雑誌名
「Cancer Cell」2月号
タイトル
Genomic sequencing identifies ELF3 as a driver of ampullary carcinoma
著者
Shinichi Yachida(責任著者), Laura D. Wood, Masami Suzuki, Erina Takai, Yasushi Totoki, Mamoru Kato, Claudio Luchini, Yasuhito Arai, Hiromi Nakamura, Natsuko Hama, Asmaa Elzawahry, Fumie Hosoda, Tomoki Shirota, Nobuhiko Morimoto, Kunio Hori, Jun Funazaki, Hikaru Tanaka, Chigusa Morizane, Takuji Okusaka, Satoshi Nara, Kazuaki Shimada, Nobuyoshi Hiraoka, Hirokazu Taniguchi, Ryota Higuchi, Minoru Oshima, Keiichi Okano, Seiko Hirono, Masamichi Mizuma, Koji Arihiro, Masakazu Yamamoto, Michiaki Unno, Hiroki Yamaue, Matthew J. Weiss, Christopher L. Wolfgang, Toru Furukawa, Hitoshi Nakagama, Bert Vogelstein, Tohru Kiyono, Ralph H. Hruban, and Tatsuhiro Shibata
Doi
10.1016/j.ccell.2015.12.012
URL
http://www.sciencedirect.com/science/article/pii/S1535610815004766(外部サイトにリンクします)
研究費
文部科学省科学研究費補助金・新学術領域研究(システムがん:領域代表 宮野 悟 東京大学医科学研究所 教授):システム生物学的アプローチによる希少がんの分子病態解明と臨床病態の予測
国立研究開発法人 日本医療研究開発機構(AMED)革新的がん医療実用化研究事業:「国際連携を基盤とした日本人難治固形がんゲノム統合解析による新たな治療標的の同定と予防戦略への展開研究」・「臨床検体の三次元的複層分子解析によるがん多様性創出機構の実証的解明とその克服に向けた臨床応用研究」
- 公益財団法人武田科学振興財団
- 公益財団法人持田記念医学薬学振興財団
- 公益財団法人高松宮妃癌研究基金
など
各施設研究担当
- 東北大学大学院 医学系研究科 外科病態学講座 消化器外科学分野 助教 水間正道
- 東京女子医科大学 統合医科学研究所 教授 古川 徹
- 和歌山県立医科大学 第2外科 教授 山上裕機
- 広島大学病院 病理診断科 教授 有廣光司
- 香川大学医学部 消化器外科 准教授 岡野圭一
プレスリリース
- 日米国際連携で希少がんの十二指腸乳頭部がん大規模ゲノム解読を実施
関連ファイルをご覧ください。
報道関係からのお問い合わせ先
- 国立研究開発法人 国立がん研究センター
郵便番号:104-0045
東京都中央区築地5-1-1 研究所・がんゲノミクス研究分野 ユニット長 谷内田(やちだ)真一
電話番号:03-3542-2511(内4213)
Eメール: syachida●ncc.go.jp(●を@に置き換えください) - 企画戦略局 広報企画室
電話番号:03-3542-2511(代表)
ファクス番号:03-3542-2545
Eメール: ncc-admin●ncc.go.jp(●を@に置き換えください)
