希少がんの研究開発・ゲノム医療を産学共同で推進「MASTER KEYプロジェクト」開始
2017年7月31日
国立研究開発法人 国立がん研究センター
国立研究開発法人国立がん研究センター(理事長:中釜 斉、所在地:東京都中央区)中央病院(病院長:西田俊朗)は、希少がんの研究開発およびゲノム医療を推進する産学共同プロジェクト「MASTER KEYプロジェクト」を開始しました。(Marker Assisted Selective ThErapy in Rare cancers: Knowledge database Establishing registrY Project)
希少がんは、一つ一つのがんの患者数が少なくまとまった診療データが存在しないことが、研究開発や臨床試験の実施を困難にしています。「MASTER KEYプロジェクト」は、この世界共通の課題に国立がん研究センターと製薬企業が共同で取り組み、希少がんにおけるゲノム医療の推進を目指す、世界でも初めての試みです。
本プロジェクトを通じて、希少がんの患者さんに、より早く、より多くの新薬を届けることを目指します。
「MASTER KEYプロジェクト」は、大きく二つの取り組みから成ります。一つは、希少がん患者さんの遺伝子情報や診療情報、予後データなどを網羅的に収集し、研究の基礎データとなる大規模なデータベースを構築するレジストリ研究です。データは、参加企業にも共有し、バイオマーカー探索や薬剤開発に役立てられます。
もう一つは、バスケット型デザインと呼ばれる新しい手法の臨床試験の実施です。この臨床試験は、がん種を限定せず特定のバイオマーカー(遺伝子異常・蛋白発現等)を有する患者さんの集団に対して、そのバイオマーカーに適した薬剤を用いるもので、医師主導治験または企業治験で実施します。本プロジェクトの意義に賛同いただいた11社の製薬企業より治験薬と共同研究費を提供いただき、成果を共有し、プロジェクトを推進してまいります。
レジストリ研究は本年2017年5月より開始しており、今後年間100例の登録と今秋からの臨床試験の実施を目指して準備を進めています。また、今後は西日本の研究施設として京都大学医学部附属病院とも協力し、国内での実施体制の拡大も図ってまいります。
背景
希少がんとは、欧州では「年間発生数が人口10万人あたり6例未満の悪性腫瘍」、米国では「年間発生数が人口10万人あたり15例未満の悪性腫瘍」と定義されるがん種です。日本においては、これまで明確な定義が存在していませんでしたが、2015年3月に厚生労働省の「希少がん医療・支援のあり方についての検討会」が設置され、(1)概ね罹患率(発生率)人口10万人当たり6例未満、かつ、(2)数が少ないため診療・受療上の課題が他のがん種に比べて大きいがん種を希少がんとして扱うようになりました。
このように、希少がんの患者さんは限られるため、多くの製薬企業では希少がんに対する抗がん剤開発は必ずしも積極的に行われてきませんでした。
国立がん研究センターでは、希少がん・難治がん等の治療法が限られた疾患に対する研究・診療体制の強化や、ゲノム情報に基づく個々人に最適化された医療の提供、それらに関連した政策提言を、当センターが重点的に取り組むべき課題として掲げています。
2014年6月には希少がんの研究、診療に積極的に取り組むため「希少がんセンター」を設置し、現在、中央病院では年間1,000から1,500名の希少がん患者さんに対し、質の高い診療と数多くの臨床試験を行っています。また中央病院では、2015年11月に米国の臨床検査室の品質保証基準である注1:CLIAに準拠した遺伝子検査室を設置し、「TOP-GEARプロジェクト」によりゲノム医療の実装に取り組んでいます。
このような取り組みにより、希少がんの診療・研究の集約と遺伝子検査体制の構築が進み、今後さらに研究開発、ゲノム医療を強力に推進するため企業参画型の「MASTER KEYプロジェクト」を立ち上げました。
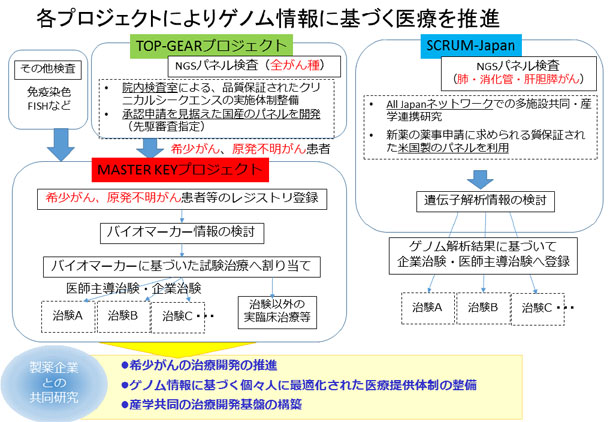
MASTER KEYプロジェクトの概要
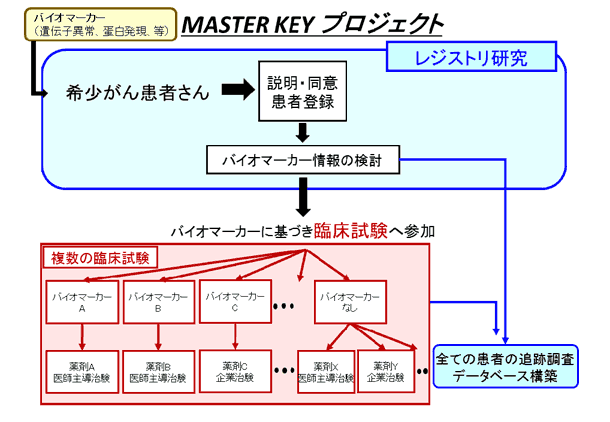
レジストリ研究の対象患者
バイオマーカー情報(遺伝子異常・蛋白発現等)の結果を有し中央病院で診療を受けている以下の固形希少がん患者さんが対象となります。
- 希少がん(年間発生数が人口10万人あたり6例未満)
- 原発不明がん
- 5大がん(胃がん、大腸がん、肺がん、乳がん、肝臓がん)のうち希少な病理組織型のもの(年間発生数が人口10万人あたり6例未満)
注:現在は対象患者さんを固形がんに限定していますが、今後は血液がんへ対象を拡大することを検討中です。
臨床試験の概要
- 上記の患者さん対象がん種において、バイオマーカー情報(遺伝子異常・蛋白発現等)の結果を有する患者さんを対象にがん種を限定せず、特定のバイオマーカーを有する患者さんの集団で、特異的に効果が見込まれる分子標的薬を用いて医師主導治験または企業治験を行います。
- 特定のバイオマーカーがない場合は、より広い対象に効果が期待できる薬剤を用います。
- 臨床試験から提供される検体を活用したトランスレーショナル研究を研究所との連携で実施します。
参加企業(2017年7月31日現在 11社)
- アステラス製薬株式会社
- エーザイ株式会社
- 小野薬品工業株式会社
- 杏林製薬株式会社
- 第一三共株式会社
- 大鵬薬品工業株式会社
- 武田薬品工業株式会社
- 中外製薬株式会社
- ノバルティスファーマ株式会社
- ファイザー株式会社
- ブリストル・マイヤーズスクイブ株式会社
最新情報は、ページ下部の関連リンクからプロジェクトページをご覧ください。
用語解説
注1:CLIA(Clinical Laboratory Improvement Amendment; 米国臨床検査室改善法)呼称「クリア」
米国の臨床検査室改善法で検査の精度管理を行うもの。その認証を受けたラボは、定期的な査察などによって品質維持を図ることが求められ、検査における品質管理を保証するものとなる。
医療関係者のお問い合わせ先
国立研究開発法人国立がん研究センター
中央病院 臨床研究支援部門 研究企画推進部 臨床研究支援室
郵便番号:104-0045
東京都中央区築地5-1-1
電話番号:03-3542-2511(代表)
Eメール:NCCH1612_office●ml.res.ncc.go.jp( ●を@に置き換えください)
報道関係者のお問い合わせ先
企画戦略局 広報企画室
電話番号:03-3542-2511(代表)
Eメール:ncc-admin●ncc.go.jp( ●を@に置き換えください)
患者様のお問い合わせ先
がん相談支援センター
電話番号:03-3547-5293
希少がんセンター
電話番号:03-3543-5601
