希少がんの本態解明研究粘液線維肉腫のゲノム・エピゲノム異常の全体像を解明
2018年7月18日
国立研究開発法人国立がん研究センター
本研究のポイント
- 軟部組織(筋肉や脂肪組織)から発生する希少がんである粘液線維肉腫の遺伝子異常、ゲノム構造変化、DNAメチル化異常の全体像を明らかにした。
- 粘液線維肉腫ではp53経路および細胞周期関連遺伝子(RB1経路)に高頻度に異常がみられることを明らかにした。
- 粘液線維肉腫における分子遺伝学的な予後因子を明らかにした。さらに、37%に治療標的となり得る遺伝子異常があることを明らかにした。これらの知見は、今後、個別化治療への応用が期待される。
- 粘液線維肉腫はDNAメチル化パターンから3つのサブグループに分類でき、それらのサブグループは特定のドライバー遺伝子(注)異常や予後、免疫細胞浸潤と密接に関連していることを明らかにした。
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区) 研究所がんゲノミクス研究分野(分野長 柴田 龍弘)並びに希少がんセンター(センター長 川井章)らの研究グループは、希少がんである粘液線維肉腫99例について、世界に先駆けて全エクソン解読、ターゲットシークエンス、全トランスクリプトーム(RNA)解読、DNAメチル化解析(注)によるゲノム・エピゲノム統合的解析(注)を行い、さらに米国TCGA(The Cancer Genome Atlas)のデータベースに登録されている粘液線維肉腫17例も加え、合計116例のデータを解析することで、体細胞レベルで起こる遺伝子異常(突然変異、遺伝子増幅、遺伝子欠損)・新たな融合遺伝子・DNAメチル化異常の全体像を解明しました。
本研究において、粘液線維肉腫ではp53経路および細胞周期関連遺伝子(G1期からS期への移行:いわゆるRB1経路)に高頻度に異常がみられ(66%)、これらの経路の調節異常が粘液線維肉腫の発生に深く関与していることを見出しました。他にもATRX、 JAK1、NF1、NTRK1といった新規ドライバー変異やBRAFがん遺伝子を含む新規融合遺伝子SLC37A3–BRAF融合遺伝子を同定しました。
さらに、DNAメチル化のパターンにもとづいて症例を分類したところ、粘液線維肉腫は3つのサブグル―プに分類され、これらのクラスターがドライバー遺伝子変異や生命予後、更に腫瘍内に浸潤する免疫細胞の特徴と関連していることを見出しました。
粘液線維肉腫は肉腫の中でも薬剤抵抗性かつ難治性であり、これまで有効な薬物療法がないのが現状でしたが、今回の研究では、治療標的となりうる遺伝子異常が37%の症例で見られることも明らかになりました。本研究成果により、粘液線維肉腫において分子遺伝学的背景に基づいた個別化治療の開発と臨床現場への導入につながることが期待されます。
本研究は、国立がん研究センター がん研究開発費・日本学術振興会 科学研究費助成事業の支援を受け行われたもので、研究成果は英国専門誌「Nature Communications」の掲載に先行し、オンライン版にて7月17日に公開されました。
背景
粘液線維肉腫とは
粘液線維肉腫は軟部組織(筋肉や脂肪組織)に発生する悪性腫瘍である軟部肉腫の一つです。かつて悪性線維性組織球腫の一亜型として扱われていましたが、特徴的な臨床病理像から、2002年のWHO分類の改訂以来、明確に定義された独立した疾患概念として扱われるようになりました。粘液線維肉腫は強い局所浸潤性を示し、その局所再発率は30%から59%と報告されています。化学療法や放射線治療には抵抗性であり、現状では、手術による完全切除以外に有効な治療法がない難治がんといえます。
軟部肉腫のゲノム異常
これまで、軟部肉腫のゲノム解析は染色体分析を中心に行われており、滑膜肉腫におけるSS18-SSX融合遺伝子や粘液型脂肪肉腫におけるFUS/DDIT3-CHOP融合遺伝子をはじめとし、約1/3の肉腫において特異的な融合遺伝子が同定されています。一方、粘液線維肉腫を含む残りの2/3の肉腫では特異的な遺伝子異常は報告されていませんでした。
近年、一部の軟部肉腫に対して次世代シークエンサーを用いた網羅的解析技術を利用した全ゲノム・エクソン解読、全トランスクリプトーム解読の結果が報告され、血管肉腫におけるPTPRB、PLCG1変異、胎児型横紋筋肉腫におけるMYOD1変異、孤在性線維性腫瘍におけるNAB2-STAT6融合遺伝子、MPNSTにおけるPRC2変異など、重要なドライバー遺伝子が次々と明らかになってきました。しかしながら、軟部肉腫は代表的な希少がんであり、さらに組織型は約50種類にも及ぶため、軟部肉腫のほとんどで網羅的な遺伝子変異の探索は十分に行われておらず、これまでのがんゲノム解析から得られた知識は未だ断片的、部分的なものでした。
粘液線維肉腫のゲノム異常
粘液線維肉腫では、一部の症例にコピー数変異(CDKN2A、CDKN2B、TP53などのがん抑制遺伝子の欠失)や体細胞変異(NF1やPTENの不活性型変異)があることが報告されていますが、これらの知識は未だ断片的なものであり、それらがどの程度の頻度で見られるのか、それ以外のゲノム異常がどのように腫瘍発生に寄与しているのかは、全く未知のままでした。この理由として、疾患自体の希少性に加え、前述のような疾患概念の変遷のため、これまで網羅的かつ探索的なゲノム異常の解析は十分に行われていないことがあげられます。したがって、次世代シークエンス技術などの最新技術を用いた網羅的なゲノム解読を行うことで、その本態を解明することが期待されていました。
研究概要
本研究の流れ(図1)
本研究では、まず1つ目の症例群(探索セット:Discovery set)として、国立がん研究センターバイオバンク(NCCバイオバンク)に保管されている粘液線維肉腫の凍結検体41症例を用いて、全エクソン解読、全トランスクリプトーム解読、メチル化解析を行いました。Discovery setで得られた結果を独立した多数の症例群(検証セット:Validation set)で検証するため、さらにNCCバイオバンクに保管されている粘液線維肉腫の凍結検体およびホルマリン固定パラフィン包埋(FFPE)検体58例分についてターゲットシークエンスを行いました。さらに、米国TCGA(The Cancer Genome Atlas)データベースに登録・公開されている粘液線維肉腫 17例のデータも統合し、合計116例分の粘液線維肉腫について解析を行いました。これらのゲノム・エピゲノム統合データを臨床病理学的なデータと対比することで腫瘍発生や悪性化機構の分子遺伝学的解明を行いました。
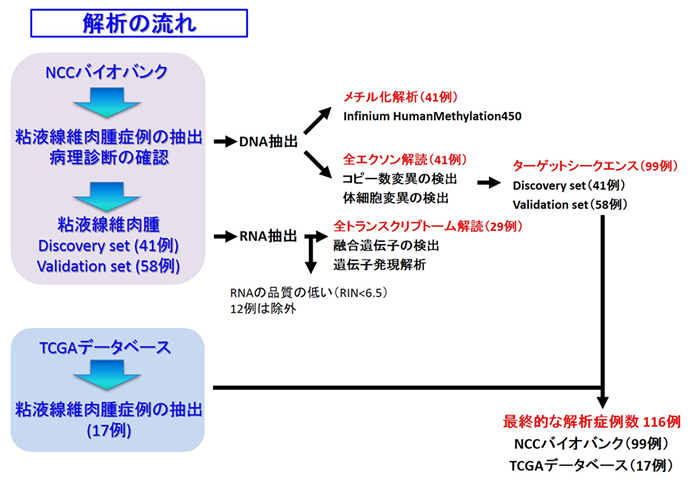
図1 解析の流れ
研究結果
1.粘液線維肉腫の体細胞変異・コピー数変異の全体像(図2)
探査セット 41例の粘液線維肉腫の全エクソン解読の結果、統計学的な解析で有意にがんの発生・進展と関連のある14個のドライバー遺伝子を同定しました(表1)。これらについて、検証セット 58例およびTCGAに登録されている17例をあわせた116例で検討した結果、図2に示した通り、p53経路(TP53、MDM2)および細胞周期関連遺伝子(RB1経路)(RB1、CDKN2A、CDKN2B、CCND1、CDK6)に高頻度に異常がみられ、66%の症例でこれらのいずれかに異常がみられました。さらに、p53経路および細胞周期関連遺伝子(RB1経路)の変異はほぼ相互排他的に生じており、これらの経路の異常が粘液線維肉腫の発生に深く関与していることが示唆されました。
その他にも、受容体チロシンキナーゼ(RTK)-RAS-PI3K経路(31%)(NTRK1、NF1、KRAS、PTENなど)およびエピゲノム制御に関与する遺伝子群(16%)(ATRX、TET2、SETD2など)にも高頻度かつほぼ相互排他的に異常が見られることが明らかになりました(図2)。
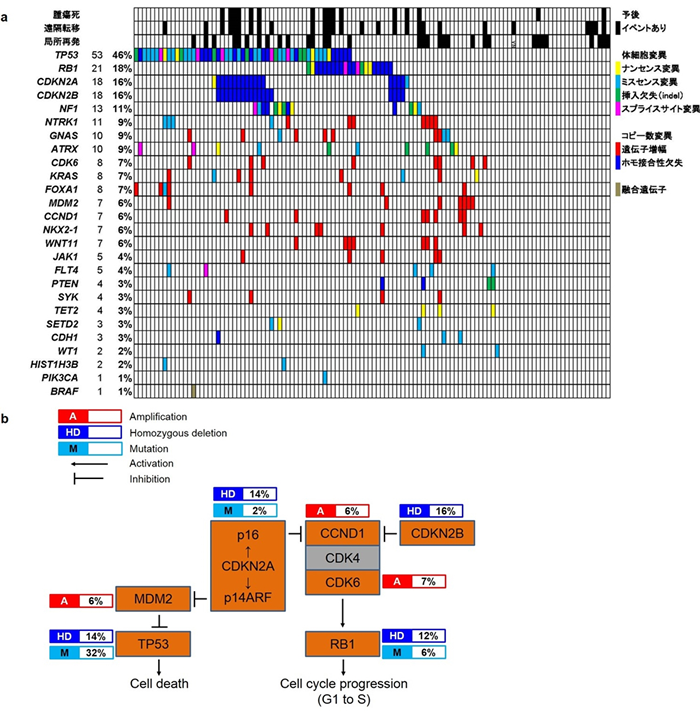
図2 粘液線維肉腫で同定したゲノム異常
(a) 粘液線維肉腫116例におけるゲノム異常の全体像
変異の頻度の高い順に上から示す。横軸(列)は各症例を表し、縦軸(行)は各遺伝子における変異の有無とそのタイプを表す。
(b) 粘液線維肉腫に高頻度にみられたRb経路とp53経路の遺伝子群の変異
異常を認めた遺伝子はオレンジ色でハイライトし、遺伝子異常のタイプとその頻度を示した。
| 遺伝子 | 頻度(%) | p値 | q値 | |
|---|---|---|---|---|
| 1 | TP53 | 41.5 | 1.60E-34 | 8.27E-11 |
| 2 | CDKN2B | 22.0 | 2.39E-18 | 2.29E-06 |
| 3 | CCND1 | 17.1 | 6.05E-12 | 1.83E-05 |
| 4 | CDKN2A | 19.5 | 1.59E-15 | 2.66E-05 |
| 5 | KRAS | 14.6 | 4.58E-12 | 1.91E-04 |
| 6 | WNT11 | 14.6 | 1.65E-09 | 2.84E-04 |
| 7 | NTRK1 | 19.5 | 6.04E-11 | 6.82E-04 |
| 8 | MDM2 | 12.2 | 1.87E-08 | 1.44E-03 |
| 9 | CDK6 | 12.2 | 3.71E-08 | 1.75E-03 |
| 10 | GNAS | 14.6 | 9.55E-09 | 1.93E-03 |
2.粘液線維肉腫における新規融合遺伝子の同定(図3)
全トランスクリプトーム解読を行った粘液線維肉腫29例のうち1例においてBRAF癌遺伝子を含む新規融合遺伝子SLC37A3–BRAF融合遺伝子を同定しました。腫瘍発生との関連についての機能解析により、本融合遺伝子が腫瘍発生に関与していることが示されました(図3)。BRAFはキナーゼ活性を有し、すでにBRAF阻害剤が臨床応用されていることから、BRAF融合遺伝子を有する粘液線維肉腫ではBRAF阻害剤の治療標的となる可能性が期待されます。
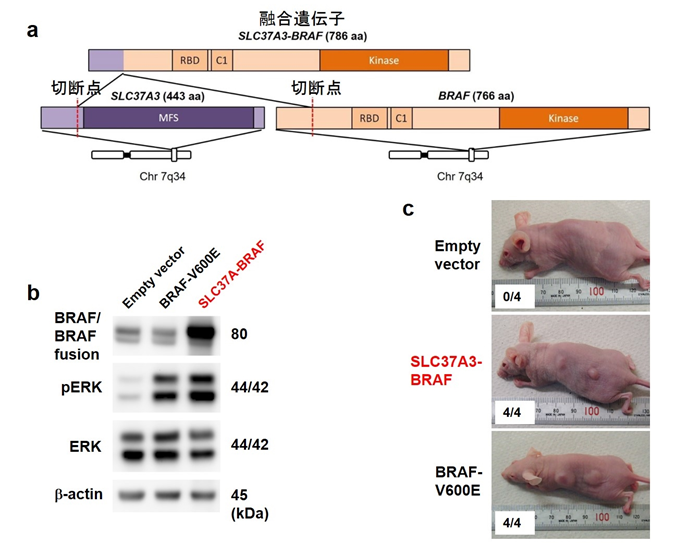
図3 BRAF融合遺伝子
(a) 検出されたSLC37A3–BRAF融合遺伝子
(b) BRAF下流のERK経路が活性化されている
(c) マウスへの皮下投与でもSLC37A3–BRAF融合遺伝子が腫瘍発生に寄与することが確認された
3.粘液線維肉腫における遺伝子異常と予後の関連(図4)
これまで粘液線維肉腫において分子遺伝学的な指標と臨床病理学的なデータの関連性を示した報告はありませんでした。本研究では初めて両者のデータを統合することでゲノム解析により同定された遺伝子異常と予後の関連を明らかにしました。
具体的には全生存率と有意に関連する遺伝子異常はTP53、CDKN2A、CDKN2B、RB1、KRASであり(図4a-e)、粘液線維肉腫に特徴的な局所再発と有意に関連する遺伝子異常はGNASであり(図4f)、遠隔転移とそれに引き続く腫瘍死に関連する分子異常と粘液線維肉腫の特徴とされる局所浸潤性、局所再発と関連する分子異常は、それぞれ異なった生物学的形質に帰結することが示唆されました。
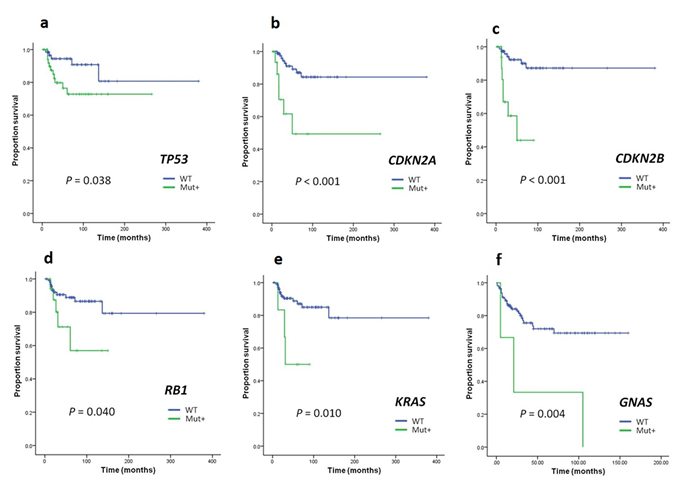
図4 遺伝子の変異の有無による生存曲線(a-eは全生存期間、fは無局所再発生存期間)
4.粘液線維肉腫において治療標的となり得る遺伝子異常
本研究で同定した粘液線維肉腫におけるゲノム異常の中には、多くの治療標的となり得る遺伝子(他のがん種において米国で治療薬として認められているものや、他のがん種の臨床試験において効果が認められているもの)が含まれていました。さらにそれらのゲノム異常を少なくとも1つ異常もつ症例は全体の37%を占めていました。これらのゲノム異常を標的とした治療薬が粘液線維肉腫においても有効かどうかは検討を重ねる必要がありますが、難治がんである粘液線維肉腫の治療開発を進めていく上で、今回の研究成果は重要な情報基盤となります。
5.粘液線維肉腫におけるDNAメチル化解析の全体像(図5)
DNAメチル化のパターンにもとづいて症例を分類(クラスタリング)したところ、粘液線維肉腫は3つのサブグル―プに分類でき(図5a)、それらのサブグループはゲノム異常や予後と関連していることが明らかになりました(図5b, c)。特にクラスターAでは予後が良好、クラスターCでは予後が不良であることがわかりました。
また、最も生命予後が不良であるクラスターCにおいて、最も予後良好なクラスターAと比べてどのような機能の遺伝子のプロモーターがメチル化されているかをThe Database for Annotation, Visualization and Integrated Discovery(DAVID)というデータ解析ツールを用いて検討したところ、クラスターCではホメオボックス遺伝子群や細胞接着に関与する遺伝子群が高メチル化されていることが明らかになりました。
さらに、発現データを用いてメチル化クラスターと免疫細胞の割合について検討しました。その結果免疫細胞の含有量は予後の良いクラスターAで多く、クラスターAにおける細胞種の割合はCD8陽性T細胞が多いという結果が得られました(図5d)。
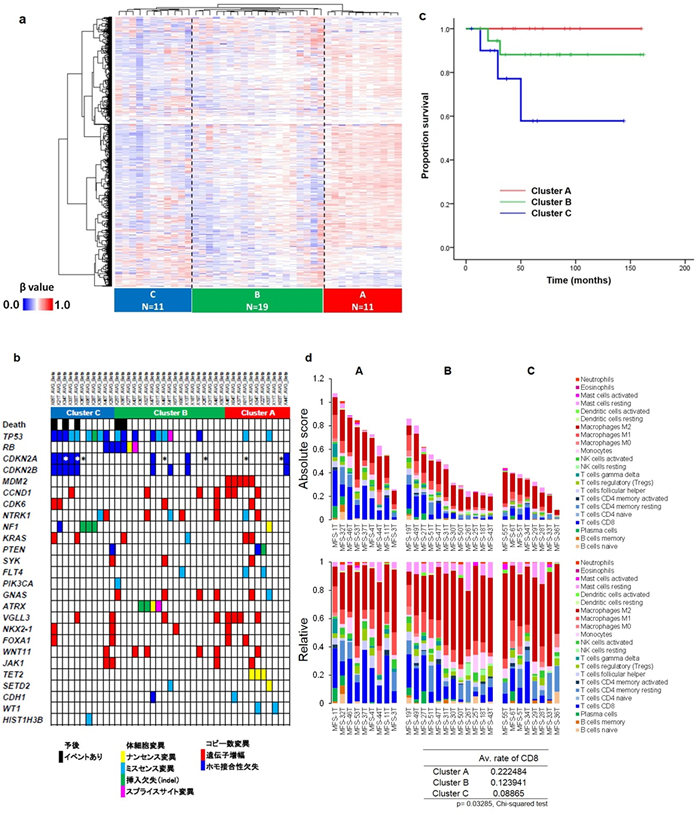
図5 メチル化プロファイルと統合解析
(a) DNAメチル化のパターンから粘液線維肉腫は3つのサブグル―プ(クラスター)に分類できた
(b) メチル化クラスターはゲノム異常と密接に関連していた
(c) メチル化クラスターは予後と密接に関連しており、クラスターAでは生命予後が良好であったが、クラスターCでは生命予後が不良であった
(d) 発現データとの比較で、免疫細胞の含有量は予後の良いクラスターAで多く、クラスターAにおける細胞種の割合はCD8陽性T細胞が多かった
用語解説
ドライバー遺伝子
がん遺伝子・がん抑制遺伝子といった、がんの発生・進展において直接的に重要な役割を果たす遺伝子。低分子阻害剤や抗体医薬など、さまざまな分子治療の標的として有望とされる。がんの発生過程においては、ゲノム変異が起こりやすい状態(いわゆるゲノム不安定性)となるため、がんの発生には無関係な遺伝子にもランダムに変異が起こることが知られている(背景変異、あるいはパッセンジャー遺伝子と呼ばれる)。したがって、統計的解析によって、本物の異常(ドライバー遺伝子)と背景異常(パッセンジャー遺伝子)を区別する必要がある。
全エクソン解読
全ゲノムのうち、エクソン配列のみを網羅的にシークエンス解析する手法である。ヒトゲノムのうち、全エクソンが占める割合は1%から2%に過ぎないが、エクソンはタンパク質に翻訳される領域であるために機能的に重要である。
ターゲットシークエンス
全エクソンのうち、粘液線維肉腫との関連が強い特定の遺伝子のエクソン配列のみを網羅的にシークエンス解析する手法である。
全トランスクリプトーム(RNA)解読
次世代シークエンス技術を用いて、細胞や組織で発現している転写産物(RNA)を網羅的に解読する方法。従来はマイクロアレイを用いた発現解析が主流であったが、本手法を用いることで、より定量的なデータが得られると同時に、融合遺伝子のような未知の転写産物異常についても発見が容易になった。
ゲノム・エピゲノム統合的解析
ゲノムとはある生物のもつすべての遺伝情報であり、タンパク質のアミノ酸配列をコードするコーディング(エクソン)領域とそれ以外のノンコーディング領域に大別される。ヒトゲノムのうち、全エクソンが占める割合は1%から2%に過ぎないが、エクソンはタンパク質に翻訳される領域であるために機能的に重要である。一方、エピゲノムとは、細胞の形質を娘細胞に伝達する仕組みのうち、ゲノム以外の要素のことを指す。エピゲノムは遺伝子の発現制御に重要な役割を果たし、発生・細胞の分化だけでなく、発がんにおいても重要なメカニズムと考えられている。DNA のメチル化や脱メチル化による遺伝子発現の制御が代表的な機構である。本研究では粘液線維肉腫のゲノム異常に加えて、ゲノム上の約45万か所についてDNAメチル化を網羅的に解析し、ゲノム異常、エピゲノム異常を統合することで粘液線維肉腫の発生や進展の分子機構の解明を試みた。
クラスタリング
複数のサンプルを大きくいくつのグループに分かれるのか推定する手法である。複数のサンプルのうち、一番傾向が似ている 2つのサンプルを横に並べていき、図5aのような樹形図を書くことができる。
The Database for Annotation, Visualization and Integrated Discovery(DAVID)
アップロードした遺伝子リストをデータベースと照合し、その機能を推定するバイオインフォマティクス解析ツールである。
ホメオボックス遺伝子群
ホメオボックス遺伝子は、特定のDNA 配列に結合する転写因子をコードしており、その下位にある標的遺伝子の発現を制御している。近年、 様々ながんにおいて ホメオボックス 遺伝子の発現異常が頻繁にみられることや、その発現異常ががん細胞の転移・浸潤能と関連していることが明らかになっている。
発表論文
- 雑誌名: Nature Communications
- タイトル: Integrated genetic and epigenetic analysis of myxofibrosarcoma
- 著者:Koichi Ogura, Fumie Hosoda, Yasuhito Arai, Hiromi Nakamura, Natsuko Hama, Yasushi Totoki, Akihiko Yoshida, Momoko Nagai, Mamoru Kato, Erika Arakawa, Wakako Mukai, Hirofumi Rokutan, Akira Kawai, Sakae Tanaka, Tatsuhiro Shibata
- DOI:https://doi.org/10.1038/s41467-018-03891-9
- URL:https://www.nature.com/articles/s41467-018-03891-9
研究費
国立がん研究センターがん研究開発費
28-A-16 「診療実態に基づいた希少がん診療体制の確立に関する研究」
29-A-6 「がん情報生物学・生物統計学研究基盤の構築」
科学研究費助成事業(基盤B:22390296)
報道関係のお問い合わせ先
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
郵便番号:104-0045
住所:東京都中央区築地5-1-1
電話番号:03-3542-2511(代表) ファクス番号:03-3542-2545
E-mail:ncc-admin●ncc.go.jp(●を@に置き換えてください)
