―日本・カナダ・イギリス・アメリカの国際共同研究成果―小児・AYA世代の肉腫発症・再発メカニズムを解明
本研究のポイント
- 小児・AYA(15才から39才)世代に多く見られる希少がんの一つであるユーイング肉腫の発症メカニズムとして、連環染色体断裂融合 (chromoplexy)を発見した。
- ユーイング肉腫における再発腫瘍は、原発巣が診断される1年以上も前から存在し、原発巣から枝分かれして進化を遂げていることが明らかになった。再発病変の早期診断に向け、血液等を用いた早期ゲノム診断やモニタリングの可能性が期待される。
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区) 研究所がんゲノミクス研究分野(分野長 柴田 龍弘)、希少がんセンター(中央病院 病理科 吉田朗彦)は、カナダのHospital for Sick Childrenを中心とした国際共同研究(カナダ・日本・英国・米国)に参加し、小児・AYA世代に多いユーイング肉腫のゲノム解析を行いました。
その結果、40パーセント以上のユーイング肉腫検体で、複数の染色体構造異常がループ状に次々と連結する複雑な異常が引き金となり発症しており、予後不良であることが分かりました。また、原発巣と同一症例の再発巣の解析においては、主要変異の多くが再発巣には見られず、さらに再発巣を形成する変異は原発巣の診断の1年から2年前には発生しており、血液で変異を測定するリキッドバイオプシーなどによる早期診断や再発リスクの早期同定による観察が有効である可能性が期待されます。
本研究は、国立がん研究センター がん研究開発費の支援を受け行われたもので、研究成果は米国専門誌「Science」で発表されました。
ユーイング肉腫は、主に小児から若年成人の骨や軟部組織に発生する肉腫で、日本での年間発症数は100人未満の希少ながんです。そのため、治療開発に必要な発症・再発メカニズムの研究や解明がこれまで進んでいませんでした。
国立がん研究センターでは、希少がんに対する診療・研究を迅速かつ適切に遂行可能なネットワークを確立し、わが国の希少がん医療の望ましい形を検討、提言、実行するため、2017年に希少がんセンターを立ちあげ、肉腫を含めた様々な希少がんにおける基礎研究・臨床研究を推進しています。
本研究成果の臨床的な意義について、国立がん研究センター 希少がんセンター長の川井章(中央病院 骨軟部腫瘍・リハビリテーション科長)は次のように述べています。
「本研究は、代表的な希少がんであるユーイング肉腫の発生メカニズムの解明に国際共同研究で取り組んだもので、その成果は難治性ユーイング肉腫の新たな診断・治療法の開発に役立つことが期待されます。」
研究背景
ユーイング肉腫は、主として小児から若年成人の骨や軟部組織に発生する肉腫であり、小児に発生する骨腫瘍では骨肉腫に次いで2番目に多いものです(類似疾患も含めて日本での年間発症数は100人未満)。発症年齢としては、過半数の症例が小児からAYA世代に集中しています。集学的治療により遠隔転移のないユーイング肉腫の治療成績は5年生存率70パーセント前後に向上しましたが、遠隔転移を有するユーイング肉腫の生存率は20パーセント以下と依然として不良です。
分子遺伝学的にはEWS-FLI1やEWS-ERGといった融合遺伝子が高頻度に検出されることから、こうした融合遺伝子が主な原因となって腫瘍が発生すると考えられていますが、その発症メカニズムについてはほとんど解明されていませんでした。また、再発のメカニズムや早期診断の可能性については十分な検討がなされていません。
研究概要
1.ユーイング肉腫発症メカニズムの解明
50症例のユーイング肉腫検体(腫瘍・正常ペア)の全ゲノム解析を行い、染色体構造異常並びに体細胞変異を同定しました。更に新たなデータ解析ツールを用いて、染色体構造異常の相互関連について解析を行った結果、40パーセント以上のユーイング肉腫症例においては、複数の染色体構造異常がループ状に次々と連結していくような複雑な異常形式 (連環染色体断裂融合:chromoplexy( chromoは「遺伝子」、plexyは「紡ぐ」という意味のギリシャ語)によって、EWS-FLI1やEWS-ERGといった融合遺伝子が形成されていることを明らかにしました(図1)。
連環染色体断裂融合は、発がんの比較的早期に起こり、ユーイング肉腫の発生の最初の引き金となる異常であり、また連環染色体断裂融合によって発生したユーイング肉腫は、それ以外の単純な分子機構で発生したものと比較して、TP53遺伝子の異常が多く、有意に予後不良であることが分かりました。
また、連環染色体断裂融合の発生機序について検討したところ、複数の染色体の断裂・融合が一期的に起こっていること、断裂・融合は早期に複製され転写が盛んであるゲノム領域に集中していること、等の結果から、複数の染色体が同時に近接している細胞核内における転写ハブ(図2)において、何らかの原因によりゲノム断裂・融合が誘発されたものと推測されました。
こうした連環染色体断裂融合によるゲノム異常は、ユーイング肉腫に限定されたものではなく、軟骨粘液線維腫 (Chondromyxoid fibroma)、滑膜肉腫(Synovial sarcoma)、リン酸塩尿性間葉系腫瘍(phosphaturic mesenchymal tumor)の症例においても観察されており、広く肉腫の発生に関わる新たな分子機構であることが明らかとなりました。
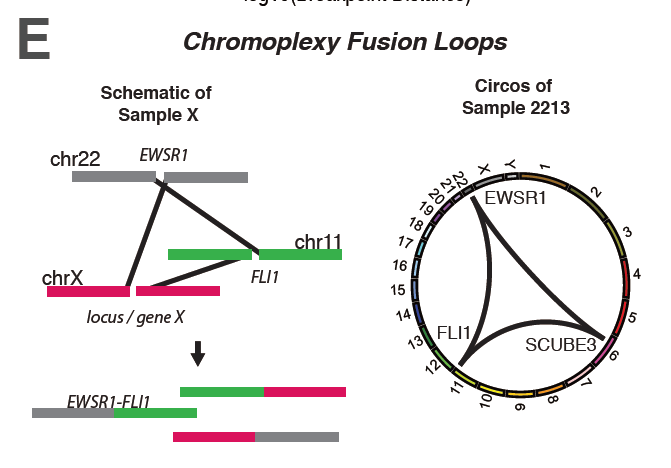
図1:Chromoplexyの1例
22番、11番、X染色体がそれぞれ断裂し、各染色体断片がそれぞれ違った染色体断片と融合し、その過程でEWSR1-FLI1融合遺伝子が生成される。
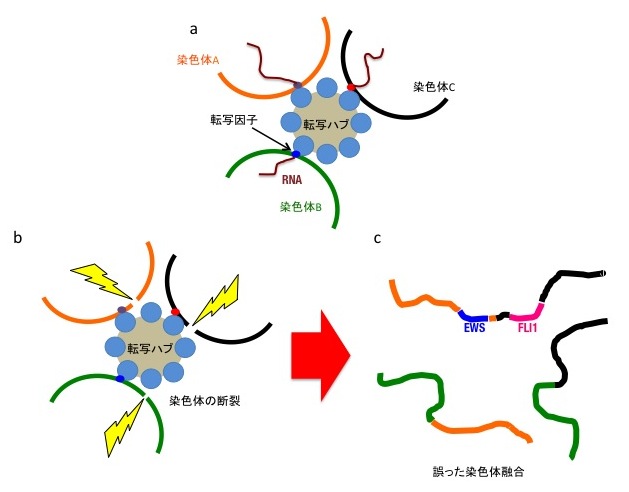
図2 Chromoplexy発生機序のモデル
a. 核内転写ハブでは複数の染色体が近接し、それぞれの染色体上にある複数の遺伝子発現を同時に制御している。
b.何らかの要因(黄色)により転写ハブに局在している複数の染色体に同時に断裂が生じる。
c. 染色体断裂を修復する過程で、異なった染色体同士が間違って融合してしまう。その際EWS遺伝子とFLI1遺伝子が融合してしまうと、EWS-FLI1融合遺伝子が生成され、ユーイング肉腫が発生する。
2.ユーイング肉腫再発メカニズムの解明
ユーイング肉腫の再発分子機構の解明のため、原発巣並びに同一症例における再発腫瘍の全ゲノム解析を行いました。多くのがんの原発巣と再発巣では共通のゲノム異常が多く確認されるのに対し、ユーイング肉腫においては、驚くことに原発巣と再発巣で共通している変異は50パーセント程度であり、原発巣における主要なクローンの多くが再発病変には見られないことが分かりました。また、再発巣に由来するゲノム異常の発生時期を調べたところ、原発巣の診断がつく1年から2年前にはすでに原発巣から枝分かれしたクローンが発生しており、それらが原発巣切除後に増殖し、再発病変を形成していると推測されました(図3)。従って、血液を用いたゲノム診断(リキッドバイオプシー)などによる早期診断や再発クローンの早期同定が予後改善に有用である可能性が考えられます。
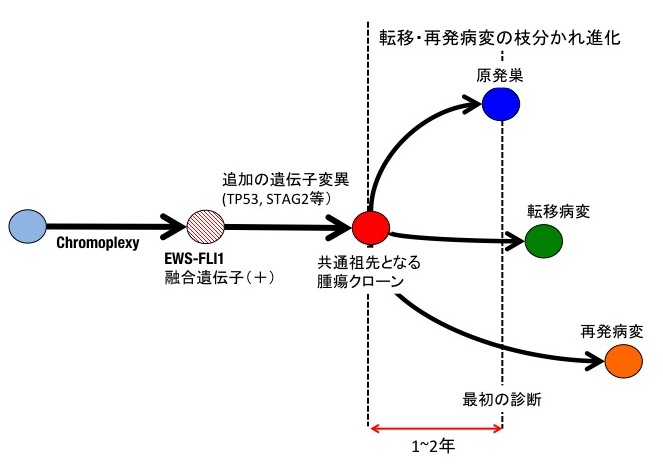
図3 ユーイング肉腫の発生モデル
まず連環染色体断裂融合によってEWS-FLI1のような融合遺伝子が生成されます。その後TP53やSTAG2といった早期に見られる遺伝子変異の蓄積を経て、共通祖先となる腫瘍クローン(赤)が生成されます。その後、原発巣や将来の転移、再発病変となるクローンが枝分かれしてそれぞれ独自の進化を遂げていきます。こうした枝分かれ進化は、原発巣が最初に診断された時点(点線)から遡ること1年から2年前にはすでに起こっていることが推定されました。
展望
今回同定した新たな腫瘍発生メカニズム(Chromoplexy)がどういった要因(環境要因や遺伝的要因など)で誘発されるのかについて更に研究を進めることで、こうした希少な肉腫の発生リスクの予測や予防に繋げていきたいと考えます。また、予後不良因子である腫瘍再発に関して、早期診断を目指し、血液等を対象としたリキッドバイオプシーによるゲノム診断の有用性について更に検討を進めます。
研究費
国立がん研究センターがん研究開発費
28-A-16 「診療実態に基づいた希少がん診療体制の確立に関する研究」
国立がん研究センターがん研究開発費
29-A-6 「がん情報生物学・生物統計学研究基盤の構築」
発表論文
- 雑誌名:Science
- タイトル:Replication-associated rearrangement bursts generate canonical gene fusions in bone and soft tissue tumors
- 著者:Nathaniel D Anderson, Richard de Borja, Matthew Young, Fabio Fulignia, Andrej Rosic, Nicola D Roberts, Simon Hajjar, Mehdi Layeghifard, Ana Novokmet, Paul E Kowalski, Matthew Anaka, Scott Davidson, Mehdi Zarrei, Badr Id-Said, L. Christine Schreiner, Remi Marchand, Joseph Sitter, Nalan Gogkoz, Ledia Brunga, Garrett T Graham, Anthony Fullam, Nischalan Pillay, Jeffrey A Toretsky, Akihiko Yoshida, Tatsuhiro Shibata, Markus Metzler, Gino R Somers, Stephen W Scherer, Adrienne M Flanagan, Peter J Campbell, Joshua D Schiffman, Mary Shago, Ludmil Alexandrov, Jay S Wunder, Irene L Andrulis, David Malkin, Sam Behjati, Adam Shlien
お問い合わせ先
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
郵便番号:104-0045
住所:東京都中央区築地5-1-1
電話番号:03-3542-2511(代表)
ファクス番号:03-3542-2545
E-mail:ncc-admin@ncc.go.jp(●を@に置き換えてください)
