最大規模の横断的がんゲノム解析による新規発がん機構の解明―がんゲノム医療への応用が期待―
発表のポイント
- これまでで最大規模の症例数を対象とした横断的がんゲノム解析研究を実施。
- 同一がん遺伝子内における複数変異が比較的高頻度に存在しており、変異同士が相乗的にがん化を促進するという新たな発がん機構を発見。
- 複数変異は、単独では比較的低頻度で機能的に弱い変異に集積しており、これまで意義不明であった変異が生じる理由が説明可能となった。
- 複数変異は、分子標的薬の反応性を予測するバイオマーカーとなる可能性が示唆され、がんゲノム医療に役立つことが期待される。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区) 分子腫瘍学分野 斎藤優樹任意研修生、古屋淳史主任研究員、片岡圭亮分野長らの研究グループは、京都大学大学院医学研究科 奥野恭史教授、東京大学医科学研究所 宮野悟教授らと共同で、これまで最大規模の症例数である6万例(150がん種以上)を超える大規模ながんゲノムデータ(注1)について、スーパーコンピューターを用いた遺伝子解析を行い、同一がん遺伝子(注2)内における複数変異(注3)(注4)が相乗的に機能するという新たな発がんメカニズムを解明しました。
本研究結果は2020年4月8日(英国時間)に英科学誌「Nature」に掲載されました。今回の研究の主な成果は以下の点です(図1)。
- がん遺伝子は従来単独で変異が生じることが多いと考えられてきましたが、一部のがん遺伝子では複数の変異が生じやすいことが明らかになりました。PIK3CA遺伝子・EGFR遺伝子など代表的ながん遺伝子では変異を持つ症例の約10%が同一遺伝子内に複数の変異を有しており、これらの大部分は染色体の同じ側(シス)に起きていました。
- 同一がん遺伝子に複数変異が生じる場合、単独の変異では低頻度でしか認められない部位やアミノ酸変化がより多く選択されていました。これらの変異は単独では機能的に弱い変異ですが、複数生じることで相乗効果により強い発がん促進作用を示しました。
- 特にPIK3CA遺伝子で複数変異を持つ場合は、単独変異よりもより強い下流シグナルの活性化や当該遺伝子への依存度が認められ、特異的な阻害剤に対して感受性を示しました。
これらの結果は、同一がん遺伝子内の複数変異が発がんに関与する新たな遺伝学的メカニズムであることを示しています。本研究により、これまで単独では意義不明であった変異が生じる理由が説明可能となるほか、複数変異は分子標的薬(注5)の治療反応性を予測するバイオマーカー(注6)にもなり得るため、がんゲノム診療に役立つことが期待されます。
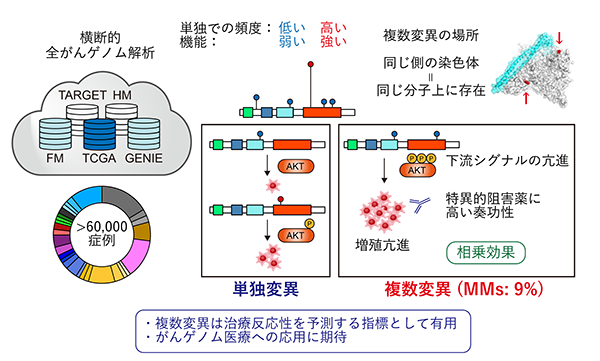
図 1:本研究成果の概略図
本研究は、日本学術振興会 科学研究費助成事業・国立がん研究センター 研究開発費研究事業・文部科学省 ポスト「京」重点課題・公益財団法人 計算科学振興財団 研究教育拠点(COE)形成推進事業の支援を受けて行われました。
背景
近年、次世代シーケンス技術(注7)の進歩に伴い、国際共同研究により大規模ながんゲノム解析が行われるようになりました。この結果、がんにおいて重要な働きをしている様々な遺伝子異常が同定されてきました。その中には、様々ながんで高頻度に認められる遺伝子異常だけではなく、単独では低頻度でしか認められない遺伝子異常も多数含まれています。これらの低頻度の遺伝子異常は機能が弱かったり、機能が不明であったりするため、なぜがんに低頻度の遺伝子異常が蓄積するのか、その理由は十分に解明されていませんでした。
今回、研究グループは同一がん遺伝子内の複数変異という現象に着目しました。がん遺伝子内の複数変異は薬剤耐性に関連した変異に伴うものが知られていました。例えばEGFR遺伝子変異のある肺がんに第一世代チロシンキナーゼ阻害薬で治療を行うと、同じEGFR遺伝子内に、その薬剤に耐性を示す2つ目の変異が生じることが知られていました。しかしながら、未治療のがんにおいてがん遺伝子に複数個の変異が生じるということは、今までほとんど報告されていませんでした。
研究方法と成果
研究グループは、まず米国のがんゲノムアトラス(The Cancer Genome Atlas (TCGA))などに登録されている11,043症例の未治療のがんゲノムシーケンスデータを解析し、がん遺伝子の複数変異がどのような遺伝子にどのくらいの頻度で生じているのか調べました。その結果、PIK3CA遺伝子やEGFR遺伝子に変異を持つ症例の10%は当該遺伝子内に複数の変異を有することがわかりました。また、9種類のがん遺伝子において、当該遺伝子に変異をもつがん症例の5%以上に複数変異を認めました(図2)。このように、同一がん遺伝子内における複数変異は、様々ながん遺伝子に共通して認められる一般的な現象であることが分かりました。
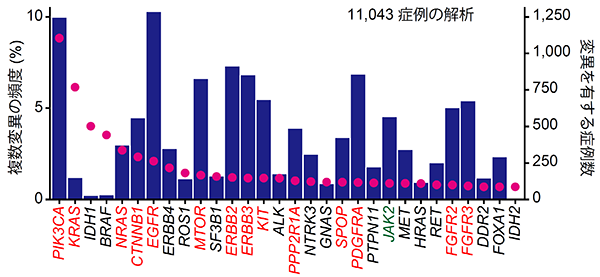
図2:各がん遺伝子における変異を有する症例数(赤丸)と複数変異の頻度(青棒)
複数変異は様々ながん遺伝子に認められる一方で、複数変異がほとんど認められない遺伝子も存在します。そこで、シミュレーションを応用した新たな統計手法を開発し、複数変異が起こりやすい14種類のがん遺伝子を同定しました(図2赤字)。
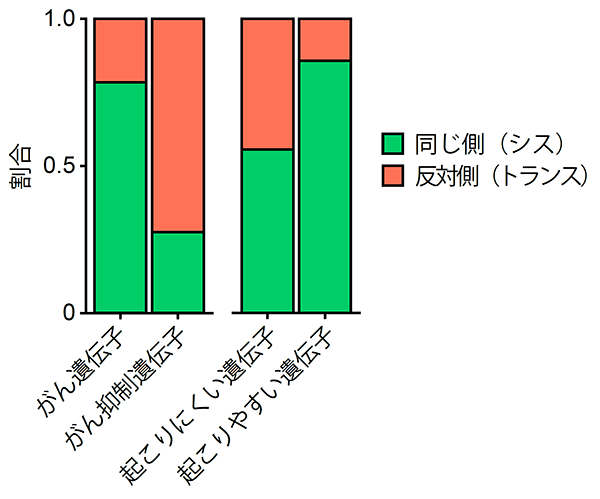
次に、これらの複数変異同士の関係に着目しました。ヒトの染色体は2倍体であり対になっています。複数変異は対の染色体の同じ側に起こるのか(シス)、反対側に起こるのか(トランス)、今まで十分にわかっていませんでした。研究グループは次世代シーケンスデータを用いた新規手法を開発し、複数変異の位置関係を評価しました。その結果、同一がん抑制遺伝子(注8)内の複数変異は反対側に生じているのに対し、同一がん遺伝子内の複数変異は同じ側に生じていました(図3左)。複数変異が起こりやすい14種類のがん遺伝子に限ると約90%の複数変異が同じ側に生じていました(図3右)。
染色体の同じ側に存在する複数変異は、同じ分子上に存在するため、1つ目の変異が2つ目以降の変異の選択に影響する可能性が考えられました。そこで同一がん遺伝子に複数の変異が認められる場合に、どのような変異が選択されているのかを評価しました。この解析は、アメリカ癌学会シーケンスプロジェクトGenomics Evidence Neoplasia Information Exchange (GENIE)に含まれる臨床シーケンスデータなどを合わせて、40,002例のシーケンスデータで解析を行いました。
まず最も複数変異の多いがん遺伝子であるPIK3CA遺伝子に着目しました。変異の部位ごとに比較すると、単独で高頻度の部位(E542・E545・H1047)には複数変異は生じにくいのに対して、単独では低頻度の部位では複数変異が生じやすいことが分かりました(図4左)。さらにアミノ酸変化に着目すると、複数変異では、単独ではあまり認められないアミノ酸が選択されていました(図4右)。
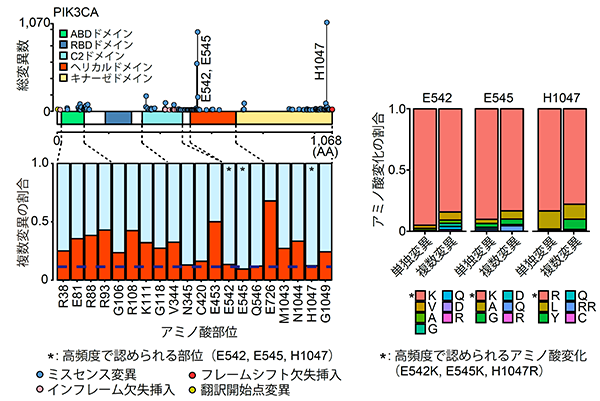
図4:PIK3CA遺伝子における単独変異と複数変異の変異パターンの違い
(左)部位の比較(右)アミノ酸変化の比較
この傾向は他のがん遺伝子においても同様でした。つまり、複数変異の時には単独変異とは変異パターンが異なっており、単独ではまれな変異部位やアミノ酸が選択されていました(図5)。
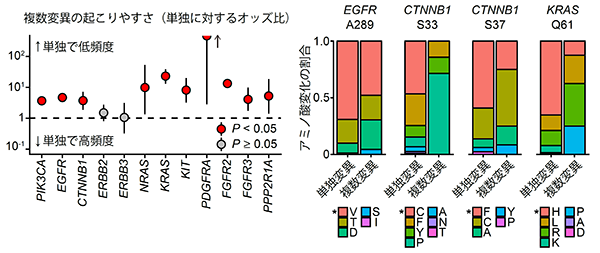
同一がん遺伝子内の複数変異はしばしば認められ、単独変異と変異パターンに違いがあることから、研究グループはがん遺伝子の複数変異にはがん化を促進する機能があるのではないかと考えました。
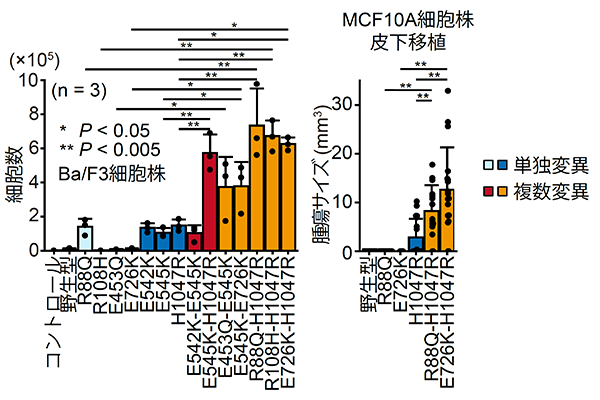
そこでPIK3CA遺伝子の複数変異を導入した細胞株を作成し、野生型や単独変異を導入した細胞株と比較しました(図6左)。PIK3CA遺伝子の複数変異を導入した細胞株は、野生型や単独変異を導入した細胞株に比べて細胞増殖が亢進していました。また、これらの細胞株をマウスに皮下移植したところ、複数変異を導入した細胞株由来の腫瘍が最も腫瘍サイズが大きくなっていました(図6右)。これらの結果から、複数変異は単独変異より強いがん化能を持つことが強く示唆されました。
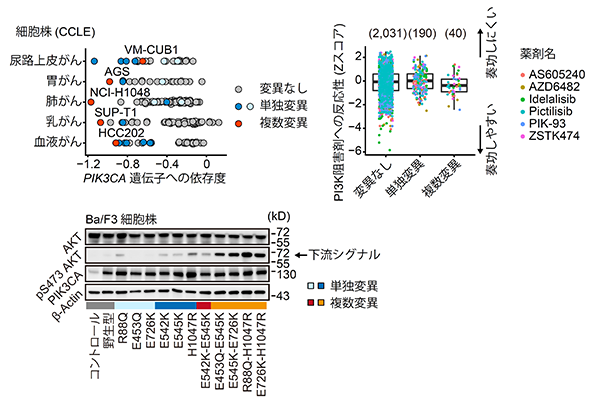
Cancer Cell Line Encyclopedia(CCLE)というがん細胞株プロジェクトデータに含まれる遺伝子欠損スクリーニングデータを解析すると、PIK3CA遺伝子に複数変異を持つ細胞株は当該遺伝子に非常に強い依存度を示す事が分かりました(図7左上)。また、これらの細胞株では当該遺伝子の下流シグナルが増強していました(図7左下)。さらに、CCLEに含まれる抗がん剤スクリーニングデータを解析すると、PIK3CA遺伝子の複数変異を持つ細胞株はPI3K阻害剤という分子標的薬に高い感受性を示していました(図7右)。この結果は、複数変異が分子標的薬の治療反応性を予測するバイオマーカーとなる可能性を示唆しています。
最後に、同一がん遺伝子の複数変異が発がんを促進するメカニズムを分子レベルで解明するため、分子動力学シミュレーション(注9)を行いました(図8)。その結果、PIK3CA遺伝子に複数変異がある場合、野生型や単独変異がある場合に比べて活性化状態に移行しやすいことが分かりました。この結果は、分子レベルにおいて複数変異が相乗的に働いていることを示しています。
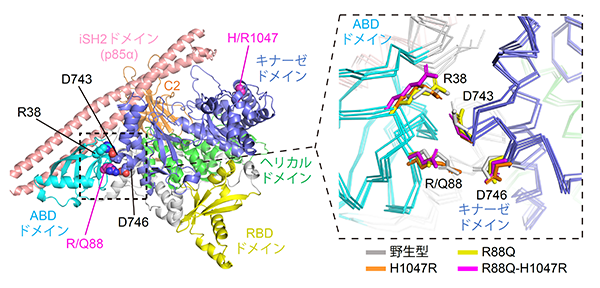
図8:分子動力学シミュレーションの結果
展望
研究グループは、今までで最大規模の症例数を対象とした横断的がんゲノム解析により、発がんに関わる新たな遺伝学的メカニズムを明らかにしました。本研究が示すように、大規模シーケンスデータを用いた遺伝子解析は、従来見逃されていた発がんメカニズムを明らかにする上で有用です。研究グループは今後も大規模シーケンスデータを用いた遺伝子解析を継続し、さらなる発がんメカニズムの解明を目指してまいります。
また、今回明らかにされた「同一がん遺伝子内における複数変異」は分子標的薬の治療反応性を予測するバイオマーカーとして有用であると期待されるほか、単独では意義不明であった変異が生じる理由を説明できる可能性があり、がんゲノム診療に役立つことが期待されます。本邦でもがんゲノム医療の開始に伴い、がんゲノムシーケンスデータや臨床情報が蓄積されています。これらを解析することで、更に同一がん遺伝子内における複数変異の意義を明らかにし、臨床に役立つ研究へ発展させていきます。
発表論文
雑誌名
Nature
タイトル
Landscape and function of multiple mutations within individual oncogenes
著者
斎藤優樹、古屋淳史、荒木望嗣、木暮泰寛、新垣清登、田畑真梨子、Marni B. McClure、吉藤康太、松本篤幸、井阪悠太、田中洋子、金井隆典、宮野悟、白石友一、奥野恭史、片岡圭亮
DOI
10.1038/s41586-020-2175-2
URL
https://www.nature.com/articles/s41586-020-2175-2 (外部サイトにリンクします)
掲載日
2020年4月8日(英国時間)
研究費
国立がん研究センター研究開発費研究事業
「造血器腫瘍における個別化医療の実現を目指した遺伝子解析パネルの開発」(30-A-1)
日本学術振興会 科学研究費助成事業
「ロングリードシーケンスによるフェージング解析に基づく複数遺伝子変異の役割の解明」(17K19592)
「分子動力学計算と情報科学的解析による、ALK遺伝子変異に伴う薬剤応答性予測」(18K06594)
「スーパーコンピューティングと革新的情報技術によるがんシステムの新次元探索」(15H05912)
文部科学省 ポスト「京」重点課題
「大量シーケンスによるがんの個性と時間的・空間的多様性・起源の解明」(hp190158)
「創薬ビッグデータ統合システムの開発」(hp190154)
公益財団法人 計算科学振興財団 研究教育拠点(COE)形成推進事業
「ビッグデータ創薬とシミュレーション創薬をつなぐ計算創薬基盤の構築」
用語解説
注1:がんゲノムデータ
がん組織に含まれるDNAの塩基配列(シーケンス)を解析し、多数の遺伝子の異常を調べたデータ。
注2:がん遺伝子
遺伝子異常による活性化によりがん化を促進する遺伝子。
注3:遺伝子変異
遺伝子DNAに生じた異常のこと。
注4:同一がん遺伝子内における複数変異
あるがんにおいて、同一がん遺伝子に複数個の変異が生じる現象のことを、本研究では「同一がん遺伝子内における複数変異」と定義しました。例えば、PIK3CA遺伝子というがん遺伝子に2個変異を有するがんがあれば、それはPIK3CA遺伝子に複数変異を有するがんとなります。
注5:分子標的薬
ある特定の分子を標的とした、がん細胞の増殖を抑制する薬剤のこと。
注6:バイオマーカー
病気(がん)の変化や治療に対する反応に相関し、その指標となるもの。
注7:次世代シーケンス技術
塩基配列(シーケンス)を高速に読み出せる技術のこと。次世代シーケンス技術の発展により、同時に多数の遺伝子の異常を調べることが可能になった。
注8:がん抑制遺伝子
遺伝子異常による不活性化・機能喪失によりがん化を促進する遺伝子。
注9:分子動力学シミュレーション
対象分子の動的振る舞いを原子ならびに分子レベルで予測する手法。スーパーコンピューターを使用して、タンパク質の動きを精密にシミュレーションすることによって、遺伝子変異がタンパク質に与える影響などを予測することが可能になる。
お問い合わせ先
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
東京都中央区築地5-1-1
電話番号:03-3542-2511(代表) FAX:03-3542-2545
Eメール:ncc-admin●ncc.go.jp(●を@に置き換えてください)
京都大学
総務部広報課 国際広報室
京都市左京区吉田本町
電話番号:075-753-5729
ファクス番号:075-753-2094
Eメール:comms●mail2.adm.kyoto-u.ac.jp(●を@に置き換えてください)
東京大学医科学研究所
国際学術連携室(広報)
東京都港区白金台4-6-1
電話番号:03-6409-2027(直通)
ファクス番号:03-5449-5496
Eメール:koho●ims.u-tokyo.ac.jp(●を@に置き換えてください)
