切除不能な胸腺がんで初めての治療薬承認
医師主導治験でアンメット・メディカル・ニーズに対応
2021年3月23日
国立研究開発法人国立がん研究センター
in English
発表のポイント
- 国立がん研究センター中央病院が主導し、全国8施設で実施された医師主導治験の結果により、世界でも初めてとなる、切除不能な胸腺がんに対する治療薬が日本で承認されました。
- 胸腺がんの発症は10万人当たり0.15人で、切除不能な胸腺がんの予後は不良であり、治療薬の研究開発が望まれる「難治性希少がん」です。
- 今回の医師主導治験では、予め設定した有効性評価基準を大きく上回る効果が確認されました。
- 希少がんは、患者数が少なく、研究開発が困難であることから、企業による治験が進みにくいとされています。アカデミアが有効性・安全性を評価する治験を主導することで、アンメット・メディカル・ニーズを満たした成功例です。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)中央病院(病院長:島田和明)は、2017年から希少ながんであり、承認された治療薬がない胸腺がんに対して、レンバチニブの有効性および安全性を評価するための医師主導治験を他施設と共同で行いました。レンバチニブは甲状腺がんと肝細胞がんで既に承認されている抗悪性腫瘍薬です。本試験の結果、医師主導治験に参加した42名の胸腺がんの患者さんのうち16名でがんの縮小が得られました。また、副作用は甲状腺がん、肝細胞がんでこれまで観察されたものと大きな違いはないことを確認しました。
この医師主導治験の結果に基づき、レンバチニブを開発・販売するエーザイ株式会社から、胸腺がんに対するレンバチニブの適応追加申請が行われ、2021年3月23日に、厚生労働省から適応追加が承認されました。胸腺がんに対して承認が得られた世界で初めての抗悪性腫瘍薬となります。
国立がん研究センター中央病院は、企業が積極的に取り組みにくい希少がんをはじめとするアンメット・メディカル・ニーズに対して有効な治療薬を開発するため、医主導治験に積極的に取り組んでまいりました。今回の承認は、医師主導治験により治療薬の有効性・安全性が示され、承認および保険適用取得に結び付いた成功事例です。
胸腺がんについて
胸腺は、左右の肺の間の縦隔に位置しています(図1)。胸腺に発生するがんは、胸腺腫と胸腺がんに分けられ、胸腺腫は腫瘍細胞の増殖スピードが比較的ゆっくりであるのに対し、胸腺がんは腫瘍細胞の増殖スピードが速く、他の臓器に転移する性質があり、予後も不良です。
胸腺がんの治療は、可能な場合は手術や放射線治療を行いますが、不能な場合や転移がみられる場合には、肺がんに準じた抗がん剤治療が行われてきました。しかし、希少ながんであるため、研究が進んでおらず、標準治療もありませんでした。
胸腺腫と胸腺がんは、30歳以上(とくに40歳から70歳)に発症し、男女差はありません。胸腺腫は人口10万人あたり0.44から0.68人、胸腺がんはさらに少なく0.15人が罹患すると報告されています。日本での罹患者数は、2017年の全国がん登録では胸腺腫と胸腺がんを合わせ1,557人でした。
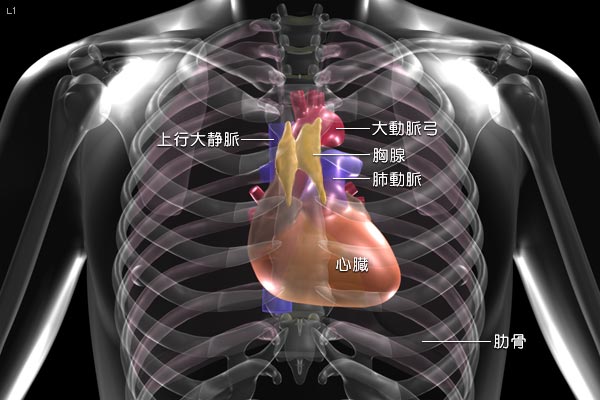
図1 胸腺の位置(希少がんセンターより転載)
本試験(NCCH1508、REMORA試験)の結果について
本試験は、根治治療のできない胸腺がん患者さんを対象にレンバチニブの安全性・有効性を評価する第II相の医師主導治験で、国立がん研究センター中央病院の計画のもと、同院など全国8施設で実施し、42名の患者さんに参加いただきました。
本試験の結果、38%(参加42名中、部分奏効以上が16名)の奏効率が得られました。この38%の奏効率は、医師主導治験開始時にあらかじめ設定した有効性評価基準(40名中8名以上の部分奏効以上が得られれば、有効と判断する基準)を大きく上回るものでした。また、この医師主導治験に参加した胸腺がんの患者さん42名のうち、40名で病勢制御が得られました(図2)。
レンバチニブ投薬に伴う主な副作用として、高血圧、蛋白尿、疲労、手足症候群などが認められましたが、これらは、すでに日本において保険適用されている甲状腺がん、肝細胞がんに対して投薬された際に観察されるものと大きな違いはなく、報告された副作用の64%が高血圧で、7%が手足症候群で、治療関連死もみられませんでした。
本試験の結果は、著名な国際誌「The Lancet Oncology」で発表しています。
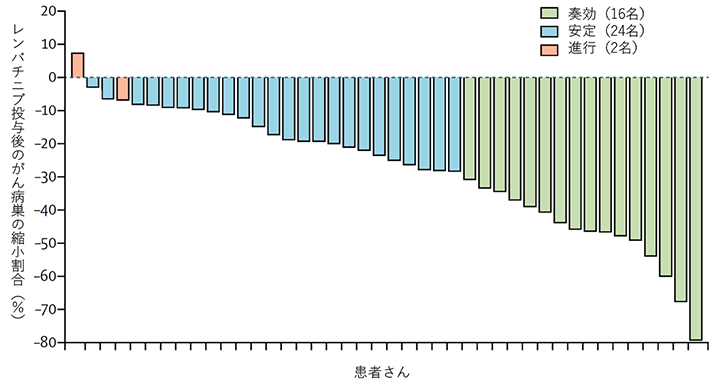
図2 レンバチニブ投薬後の腫瘍縮小割合(%)
本試験を実施した医療機関の名称
北海道大学病院
国立研究開発法人 国立がん研究センター東病院
がん・感染症センター都立駒込病院 呼吸器内科
国立研究開発法人 国立がん研究センター中央病院
静岡県立静岡がんセンター
大阪医科大学附属病院
兵庫県立がんセンター
独立行政法人 国立病院機構 四国がんセンター
レンバチニブについて
レンバチニブは、VEGFR1~3、FGFR1~4、PDGFR-a、KIT、RETといった、がんの細胞増殖や血管新生などに関わる多様なキナーゼを阻害するマルチキナーゼ阻害剤で、根治切除不能な甲状腺がんや切除不能な肝細胞がんに対し、日本でも承認されています。
論文情報
雑誌名: The Lancet Oncology
論文タイトル: Lenvatinib in patients with advanced or metastatic thymic carcinoma (REMORA): a multicentre, phase 2 trial
著者: Sato J, et al
DOI: 10.1016/S1470-2045(20)30162-5
医師主導治験とは
2003年に薬事法が改正され、製薬企業等と同様に医師自ら治験を企画・立案し、治験計画届を提出して治験を実施できるようになりました。この治験の準備から管理を医師自ら行うことを医師主導治験といいます。医師主導治験では医師自らが、治験実施計画書等の作成から始まり、治験計画届の提出、治験の実施、モニタリングや監査の管理、試験結果を取りまとめた総括報告書の作成など、実施医療機関と協力しながら治験のすべての業務の実施並びに統括しなければなりません。
外国で承認されていながら国内未承認、あるいは適応外使用が一般的となっている医薬品や医療機器について医師主導治験を実施することにより、その医薬品や医療機器の薬事承認を取得し、臨床の現場で適切に使えるようにすることが可能となります。
(日本医師会 治験促進センターより引用)
参考ページ
- 国立がん研究センター がん情報サービス 胸腺腫と胸腺がん
http://ganjoho.jp/public/cancer/thymoma/index.html - 国立がん研究センター 希少がんセンター 胸腺腫と胸腺がん
https://www.ncc.go.jp/jp/ncch/division/rcc/about/thymoma/index.html - エーザイ株式会社
http://www.eisai.co.jp/index.html(外部サイトへリンクします) - 日本医師会 治験促進センター
http://www.jmacct.med.or.jp/clinical-trial/index.html(外部サイトへリンクします)
お問い合わせ先
医師主導治験に関するお問い合わせ
国立研究開発法人 国立がん研究センター
中央病院 臨床研究支援部門 研究企画推進部 臨床研究支援室
〒104-0045 東京都中央区築地5-1-1
電話番号:03-3542-2511(内線5661)
E-mail:NCCH1508_office@ml.res.ncc.go.jp
報道関係のお問い合わせ
国立研究開発法人 国立がん研究センター 企画戦略局 広報企画室
〒104-0045 東京都中央区築地5-1-1
電話番号:03-3542-2511(代表) FAX:03-3542-2545
E-mail:ncc-admin@ncc.go.jp
