国際共同研究による食道がん全ゲノム解析
日本人食道がんに特徴的な発がんメカニズムを発見
2021年10月27日
国立研究開発法人国立がん研究センター
in English
発表のポイント
- 食道がんの予防開発を目的に、日本を含む8か国の国際共同研究で食道がんの全ゲノム解析が行われました。
- 解析の結果、日本人の食道がんでは、飲酒に伴う遺伝子変異機構が強く働き、食道がんが発症するという仕組みの詳細が明らかとなりました。今後、さらなる解析により食道がんに対する予防法開発への応用が期待されます。
- 本研究は、疫学研究における全ゲノム解析の有用性が世界で初めて示されたもので、本研究結果を、今後蓄積される日本人がん全ゲノムデータの解析に応用することで、日本におけるさまざまながんの発がんメカニズムの解明とがん予防研究に進展が期待されます。
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)研究所がんゲノミクス研究分野(分野長 柴田 龍弘)は、英国サンガー研究所 (Wellcome Sanger Institute)並びにWHO国際がん研究機関 (International Agency for Research on Cancer, IARC)との国際共同研究において、Cancer Grand Challenge*1 “Mutographs project*2”に参加し、発症頻度の異なる8か国(日本・中国・イラン・英国・ケニア・タンザニア・マラウイ・ブラジル)における食道がん(食道扁平上皮がん)552症例の全ゲノム解析の結果を報告しました。食道扁平上皮がんは、食道がんの中で最も頻度が高く、日本人食道がんの9割以上を占めます。
本研究は、世界の様々な地域における食道扁平上皮がんの全ゲノム解析を行うことで、人種や生活習慣の異なる地域ごとに発症頻度が異なる原因を解明し、地球規模で食道扁平上皮がんの新たな予防戦略を進めることを目的として行われたもので、世界で初めて国際的ながん疫学研究に全ゲノム解析が用いられました。
本研究の結果、発がん要因の推定に用いられる遺伝子変異のパターン(変異シグネチャー*3)解析を実施することで、飲酒といった生活習慣、並びにアルコール代謝酵素 (ALDH2)*4・BRCA*5遺伝子多型が食道がんにおける突然変異誘発に関係していることが明らかになりました。中でも飲酒関連の変異シグネチャー (SBS16)が、日本並びにブラジルの食道がんで特徴的に多く、また飲酒歴のある患者さんではSBS16によるTP53変異が多く起こっていることも明らかになりました。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の支援により行ったもので、研究成果は英国専門誌「Nature Genetics」に2021年10月18日付で発表されました。なおデータは広く研究者に活用していただくために、国際がんゲノムコンソーシアム(ICGC-ARGO)*6に登録され、公開されます。
研究背景
食道がんには食道扁平上皮がん、食道腺がん等が含まれますが、食道扁平上皮がんが最も頻度が高く、日本人では9割以上を占めます。食道がんは世界で6番目に多いがんですが、その発症頻度が地域ごとに大きく異なることがWHOから報告されています(図1)。食道扁平上皮がんの好発地域としては、日本・中国を含めた東アジア、中央アジア~中近東、東アフリカといった地域が知られています。これまでの疫学的研究から、食道がんの危険因子としては、喫煙と飲酒が相乗的にリスクを高めることが知られており、それ以外に多環芳香族炭化水素 (polycyclic aromatic hydrocarbons, PAH)を含んだ大気汚染や刺激物(お茶などの熱い飲み物摂取)等が関係していると報告されていますが、これまでの研究では、こうした因子だけでは地域ごとの食道扁平上皮がんの発生頻度の違いは十分説明できていません。
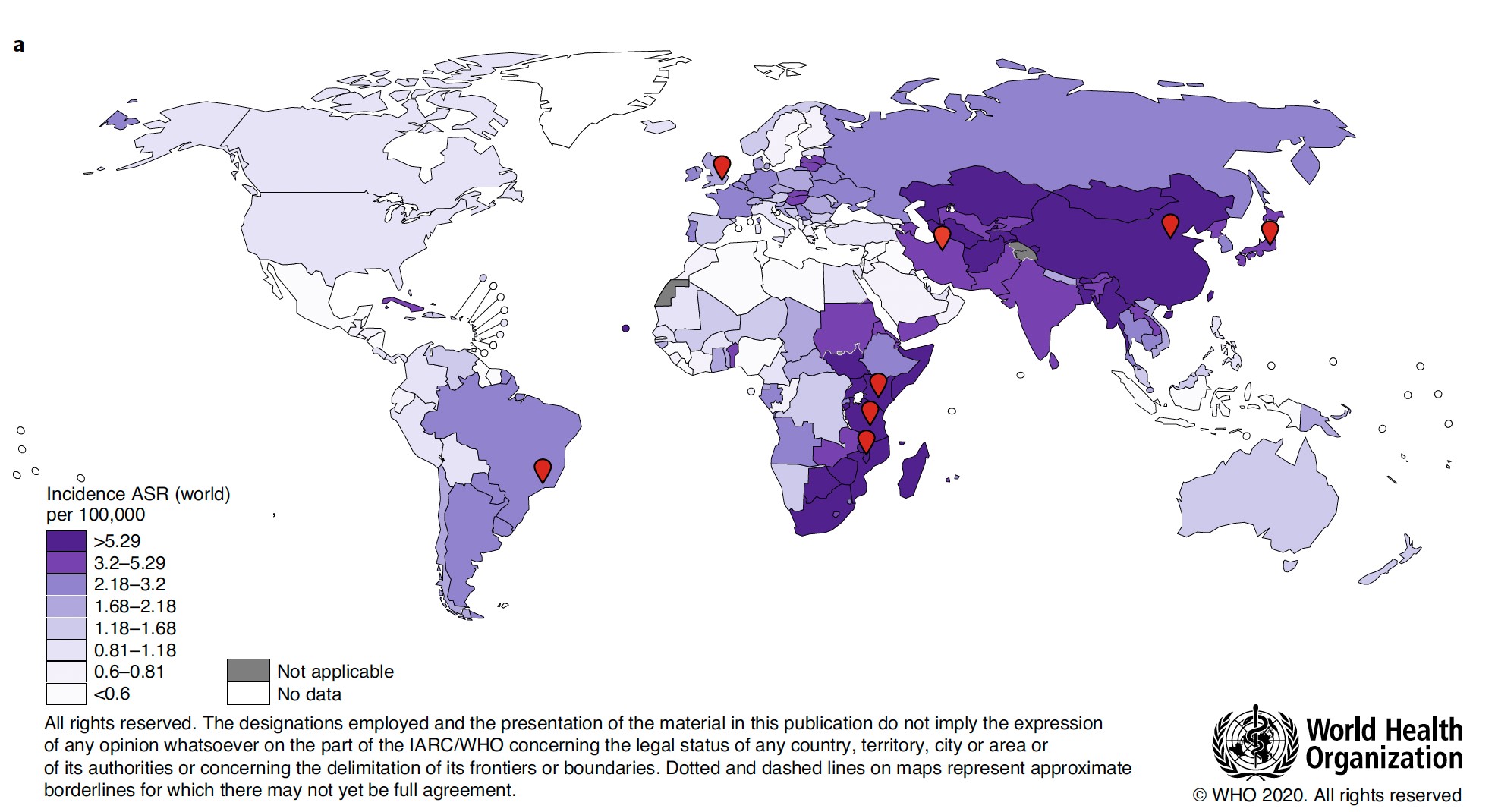
図1 各地域における食道扁平上皮がんの発症頻度(年齢調整後10万人当たりの発症数)
赤印は今回サンプルを提供した国を示す。
がんは様々な要因によって正常細胞のゲノムに異常が蓄積して発症することが分かっています。点変異のような突然変異はがんドライバー遺伝子*7の活性化や不活性化を来す主要なゲノム異常の一つですが、近年の大規模ながんゲノム解析から、突然変異の起こり方には一定のパターンがあることが明らかになってきました。こうしたパターンは変異シグネチャーと呼ばれ、喫煙や紫外線暴露といった様々な発がん要因によって異なることも知られています。中でも点変異のシグネチャーはSingle Base Substitution Signature (SBS)と呼ばれています。
本研究は、世界の様々な地域における食道扁平上皮がんの全ゲノム解析を行い、がんドライバー遺伝子や変異シグネチャーの違いを解析することで、人種や生活習慣の異なる地域ごとに発症頻度が異なる原因を解明し、地球規模で食道扁平上皮がんの新たな予防戦略を進めることを目的として行われました。
研究概要
1. サンプル収集と全ゲノム解析
食道扁平上皮がんの発症頻度が異なる8か国から、全部で552症例のサンプルを収集し、全ゲノム解析を行いました。(症例数の内訳は 日本 37例、中国 138例、イラン 178例、英国 7例、ケニア 68例、タンザニア 35例、マラウイ 59例、ブラジル 30例)。
2. 変異シグネチャー解析
全ゲノム解析データから突然変異を検出し、複数の解析ツールを用いて変異シグネチャーを抽出しました。その後、地域ごと、臨床背景ごとに変異シグネチャーの分布に有意差があるかについて検討を行いました(図2)。

図2 本研究における全ゲノム解析の流れ
3. 食道扁平上皮がんにおけるドライバー遺伝子変異解析
552症例の全ゲノム解析からがんドライバー遺伝子を同定し、主要なドライバー遺伝子についてその突然変異と変異シグネチャーとの関連について検討を行いました。
研究結果
1.食道扁平上皮がんゲノム・変異シグネチャーの国際比較
発症頻度が異なる地域ごとに比較した結果、変異数や変異パターンに大きな違いは見られませんでした(図3)。ただし変異シグネチャーの分布を比較したところ、飲酒関連変異シグネチャーであるSBS16が、日本並びにブラジルの症例で有意に多く認められました(図4)。
図3 地域ごとのサンプルにおける突然変異パターン
地域ごとのサンプルにおいて、突然変異には大きな違いは認められないが、日本・ブラジルの症例においてはSBS16に特徴的なT>C突然変異の突出(矢印)が確認できる。
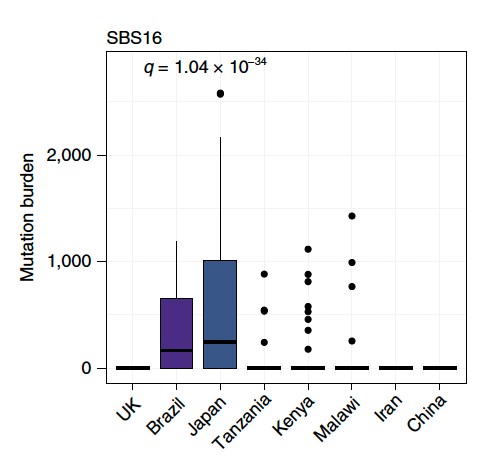
図4 地域ごとのサンプルにおけるSBS16による突然変異数
日本・ブラジルの症例において、有意にSBS16による突然変異が多い。
2.食道扁平上皮がんドライバー遺伝子解析
今回の全ゲノム解析によって、全部で38個のがんドライバー遺伝子が同定できました(表1)。その中には、 過去の研究でも報告されていたTP53, CDKN2A, PIK3CA, NFE2L2, NOTCH1といった遺伝子が含まれていました。
|
TP53 |
PTCH1 |
CREBBP |
|
CDKN2A |
EP300 |
C3orf70 |
|
PIK3CA |
KMT2C |
KEAP1 |
|
NFE2L2 |
CASP8 |
PBRM1 |
|
NOTCH1 |
BAP1 |
SMAD4 |
|
KMT2D |
NSD1 |
HIST1H4E |
|
FAT1 |
ASXL1 |
HIST1H1C |
|
ZNF750 |
FAT2 |
ZBTB7B |
|
RB1 |
RBPJ |
NOTCH2 |
|
PTEN |
CHEK2 |
HIST1H3B |
|
FBXW7 |
TET2 |
RXRA |
|
KDM6A |
PIK3R1 |
ZFP36L1 |
|
AJUBA |
ZFP36L2 |
|
表1 食道扁平上皮がんにおけるがんドライバー遺伝子
次にこうしたドライバー遺伝子における突然変異と変異シグネチャーとの関連について検討したところ、飲酒歴のある症例ではSBS16がTP53遺伝子変異に多く見られることが明らかとなりました(図5)。
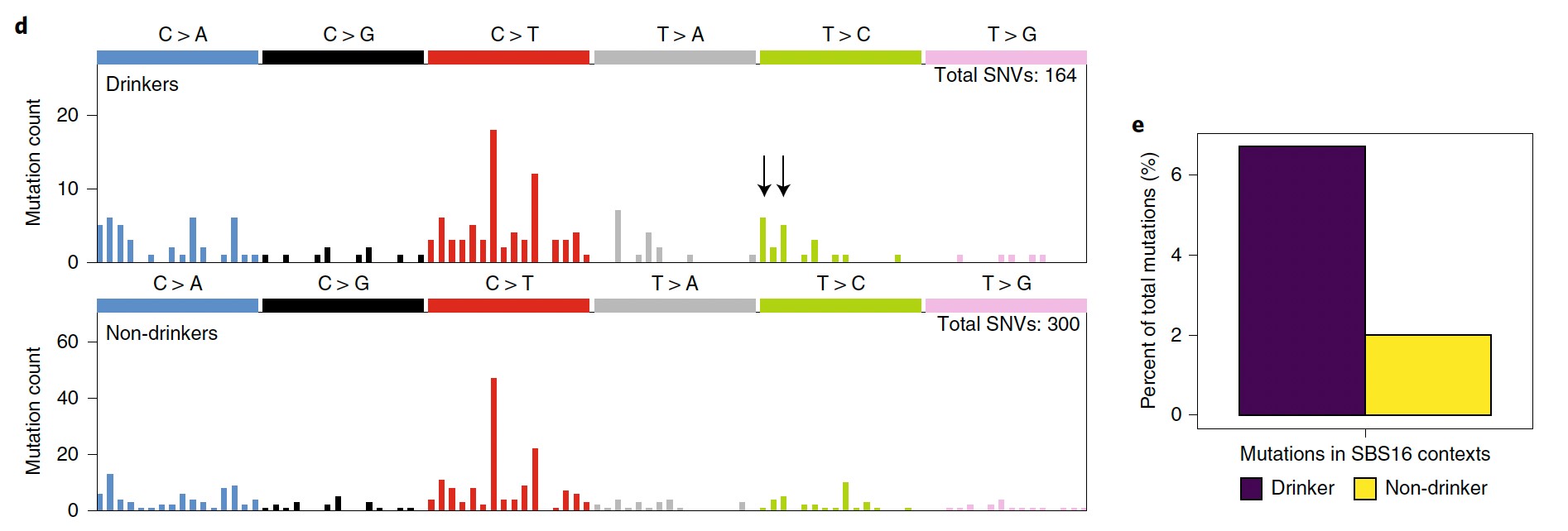
図5 飲酒歴の有無とTP53遺伝子変異との関連
(左)飲酒歴のある症例ではSBS16に見られるT>C変異が多く見られる(矢印)。(右)SBS16変異は飲酒歴のある症例で有意に多かった。
3.食道扁平上皮がんにおける変異シグネチャーと遺伝子多型との関連
変異シグネチャーと遺伝子多型との相関について検討した結果、エタノール分解代謝においてに重要な酵素であるALDH2のSNPの違い(アルコール分解能に差がある)とSBS16が有意に相関することが明らかとなりました(図6・左)。また、遺伝性乳がん・卵巣がんの原因遺伝子として知られるBRCA遺伝子変異の有無とSBS3にも相関が見られました(図6・右)。これらの結果は、食道扁平上皮がんの発生に複数の遺伝的な違いも寄与していることを示していいます。
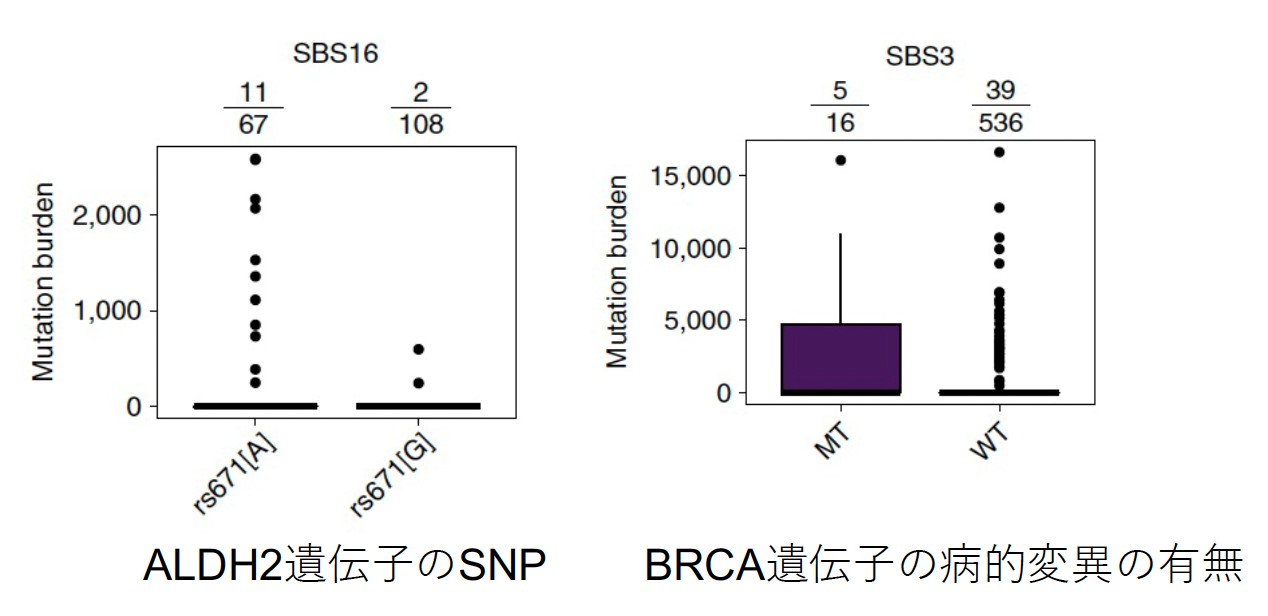
図6 (左)ALDH2遺伝子のSNP(遺伝子多型)とSBS16の関連。rs671がAの症例の方がGの症例より有意にSBS16の変異数が多い。(右)BRCA遺伝子の病的変異の有無とSBS3の関連。BRCA遺伝子の病的変異がある症例 (MT)の方が無い症例(WT)よりも有意にSBS3の変異数が多い。
展望
本研究は、世界で初めての全ゲノム解析を用いた国際的ながん疫学研究であり、その結果、地域ごとの食道扁平上皮発がん分子機構の特徴を明らかにすることができました。とりわけ日本人症例には飲酒に伴う遺伝子変異機構が強く働き、TP53といったがんドライバー遺伝子の異常を誘発し、食道扁平上皮がんが発症するという仕組みの詳細が明らかとなりました。また環境要因のみならず、様々な遺伝子多型の違いも食道扁平上皮がんにおける遺伝子変異獲得に寄与していることも解明されました。この結果を日本における食道がんの新たな予防法開発に応用するためには、飲酒に伴う変異誘発機構を解き明かす必要があり、今後も研究を進めていく予定です。
また、今年度から全ゲノム解析等実行計画*8を推進するためのAMEDプロジェクトが開始され、多くのがん種について日本人症例の大規模な全ゲノムデータが集積される予定です。本研究で確立した変異シグネチャー解析を適用することで、日本における様々ながんにおける発がん分子機構の解明とがん予防研究が進みます。
今回の研究からは、当初の予想と反して発症頻度が高い地域における食道扁平上皮がん検体にも特別な変異シグネチャーの増加は認められないという結果が得られました。このことから、地域ごとの発症頻度の違いを規定する因子は、直接がんゲノムに傷を付けるものではなく、それ以外の要因があることが推定されます。
食道がんの発症母地として、炎症等といった組織障害からの再生食道粘膜が知られており、こうした前がん病変にはすでに遺伝子変異を持った細胞が増殖していることが報告されています。例えば地域ごとの発症頻度の違いにはこうした前がん病変の頻度が影響している可能性が考えられます。Mutographs projectでは、こうした前がん病変を含めた様々な正常組織における遺伝子変異についても解析を開始しており、我々の研究グループも協力を進めていく予定です。
研究費
国立研究開発法人日本医療研究開発機構(AMED)
革新的がん医療実用化研究事業
「国際共同研究に資する大規模日本人がんゲノム・オミックス・臨床データ統合解析とゲノム医療推進に向けた知識基盤構築」
発表論文
雑誌名
Nature Genetics
タイトル
Mutational signatures in esophageal squamous cell carcinoma from eight countries of varying incidence.
著者
Sarah Moody, Sergey Senkin, S M Ashiqul Islam, Jingwei Wang, Dariush Nasrollahzadeh, Ricardo Cortez Cardoso Penha, Stephen Fitzgerald, Erik N Bergstrom, Joshua Atkins, Yudou He, Azhar Khandekar, Karl Smith-Byrne, Christine Carreira, Valerie Gaborieau, Calli Latimer, Emily Thomas, Irina Abnizova, Pauline E Bucciarelli, David Jones, Jon W Teague, Behnoush Abedi-Ardekani, Stefano Serra, Jean-Yves Scoazec, Hiva Saffar, Farid Azmoudeh-Ardelan, Masoud Sotoudeh, Arash Nikmanesh, Michael Eden,Paul Richman, Lia S Campos, Rebecca C Fitzgerald, Luis Felipe Ribeiro, Charles Dzamalala, Blandina Theophil Mmbaga, Tatsuhiro Shibata, Diana Menya, Alisa M Goldstein, Nan Hu, Reza Malekzadeh, Abdolreza Fazel, Valerie McCormack, James McKay, Sandra Perdomo, Ghislaine Scelo, Estelle Chanudet, Laura Humphreys, Ludmil B Alexandrov, Paul Brennan, Michael R Stratton
DOI
10.1038/s41588-021-00928-6
URL
https://www.nature.com/articles/s41588-021-00928-6 (外部サイトへリンクします)
用語解説】
*1 Cancer Grand Challenge
英国王立がん研究基金 (Cancer Research UK)並びに米国がん研究所 (National Cancer Institute)によって設立されたグローバルな資金配分プラットフォーム。がん研究における最も複雑な課題に取り組み、新たな知見を広げ、研究のさらなる進展や科学的な創造性を高めることを目的としている。
https://cancergrandchallenges.org(外部サイトにリンクします)
*2 Mutographs project
Cancer Grand Challengeで進められているプロジェクトの一つであり、多様な発がん要因に応じてどのようにゲノム変異のパターンが変わるのかについて、地球規模で解明し、新たな予防法につなげていく国際共同研究である。主任研究者は、英国サンガー研究所所長のSir Michael Stratton博士。日本からは国立がん研究センターが協力機関として参加している。
https://www.mutographs.org(外部サイトにリンクします)
*3 変異シグネチャー
がん細胞のゲノムに発生する様々な変異には、その要因によって異なったパターンを示すことが知られており、そうしたパターンを変異シグネチャーと呼ぶ。これまでヒトのがんにおいては50種類以上のパターンがあることが知られており、そのうち3分の1はゲノム修復の異常、3分の1は環境要因によるものであることが判明しているが、残り3分の1は未だ原因不明である。
*4 ALDH2遺伝子
アルデヒドデヒドロゲナーゼ2(ALDH2)は、飲酒後のエタノールが肝臓などの細胞で代謝されてできるアセトアルデヒドを酸化して酢酸へと代謝し、無毒化する酵素である。アセトアルデヒドは一般的には二日酔いの原因とされ、また発がん性があることも知られている。ALDH2酵素には酵素活性に大きな差を来す遺伝的な多型 (SNP)があることが知られており、飲酒習慣への影響などが知られている。
*5 BRCA (breast cancer susceptibility gene) 遺伝子
BRCAはがん抑制遺伝子であり、遺伝性乳がん・卵巣がんの原因遺伝子として同定された。前立腺がんや膵がんの発症リスクとも関連することが知られている。BRCAタンパクはDNA修復に関与しており、その異常によって染色体構造異常や突然変異 (SBS3シグネチャーの原因として知られる)を誘発する。
*6 国際がんゲノムコンソーシアム(ICGC-ARGO)
ゲノム情報の利活用により、がん患者における治療効果・予後の改善を目指した国際がんゲノムコンソーシアム (International Cancer Genome Consortium, ICGC)のプロジェクト。ICGC-ARGO (Accelerating Research in Genomic Oncology, ARGO) はICGC 25k Initiative およびPan-Cancer Analysis of Whole Genomes (PCAWG)に続く、ICGCの第3フェーズになります。2021年5月現在、日本を始め、米国・カナダ・英国(イングランド・スコットランド)・ドイツ・フランス・イタリア・スイス・韓国・中国・香港・サウジアラビアの13か国が参加を表明しています。また、ICGC-ARGOには日本から国立研究開発法人 日本医療研究開発機構(AMED)が支援する研究班(Genome Medicine for Asia-Prevalent Cancers)並びに国立がん研究センターが主導する全国がん遺伝子診断ネットワーク(MONSTAR-SCREEN)が参加し、臨床情報の紐付いたがんゲノム情報の登録・共有を開始しています。
*7がんドライバー遺伝子
異常を起こすことによってがんの発生や進展に寄与する遺伝子を総称してがんドライバー遺伝子と呼ぶ。がん細胞の増殖や転移を促進する「がん遺伝子」とそれらを抑制する「がん抑制遺伝子」がある。がんドライバー遺伝子を標的とした診断(パネル遺伝子診断)や治療(分子標的薬治療)が現在ゲノム医療として進められている。
*8全ゲノム解析等実行計画
がんや難病等の医療の発展や個別化医療の推進等を目的として、令和元年12月に厚生労働省によって策定された。がん領域については、令和3年度からAMED革新的がん医療実用化研究事業において全ゲノム解析等実行計画を推進するプロジェクトが開始されている。この実行計画に基づき、全ゲノム解析等により明らかとなった当該疾患の治療等のために有益な情報等を患者に還元するとともに、研究・創薬などに向けた利活用を進め、新たな個別化医療等を患者に届けることを目指している。
問い合わせ先
報道関係の問い合わせ先
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
TEL: 03-3542-2511(代表) FAX: 03-3542-2545
E-mail: ncc-admin●ncc.go.jp
AMED事業に関する問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課 革新的がん医療実用化研究事業事務局
〒100-0004 東京都千代田区大手町1-7-1
TEL: 03-6870-2286 E-mail: cancer●amed.go.jp

