LC-SCRUM-Asiaの遺伝子スクリーニングで
肺がんの新しいドライバー遺伝子
「CLIP1-LTK融合遺伝子」を世界で初めて発見
2021年11月25日
国立研究開発法人国立がん研究センター
国立研究開発法人日本医療研究開発機構
発表のポイント
- 肺がんを対象にした遺伝子スクリーニングプロジェクト「LC-SCRUM-Asia」*1において、新しいドライバー遺伝子となる「CLIP1-LTK融合遺伝子」を世界で初めて発見しました。
- CLIP1-LTK融合遺伝子は、非小細胞肺がんの0.4%に認められる遺伝子変化で、基礎研究の結果、細胞のがん化に直接関与するドライバー遺伝子*2であることが明らかになりました。
- CLIP1-LTK融合遺伝子を有する肺がんに、この遺伝子変化を標的とする分子標的薬が極めて有効であることも基礎研究で明らかになり、CLIP1-LTK融合遺伝子は新たな治療標的となる可能性が示唆されました。
- 本研究成果は日本時間2021年11月25日付に英国科学雑誌「Nature」電子版に掲載されました。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区、以下国立がん研究センター)東病院(病院長:大津 敦、千葉県柏市)は、肺がんの遺伝子スクリーニングプロジェクトである「LC-SCRUM-Asia」(研究代表者:東病院 呼吸器内科長 後藤 功一)において、非小細胞肺がんの新しいドライバー遺伝子となる「CLIP1-LTK融合遺伝子」を世界で初めて発見しました。
CLIP1-LTK融合遺伝子は、非小細胞肺がんの0.4%に認められ、既知のドライバー遺伝子とは相互排他的に存在していました。また、国立がん研究センター先端医療開発センター(センター長:落合 淳志、千葉県柏市) ゲノムトランスレーショナルリサーチ分野長 小林 進らの研究チームが、CLIP1-LTK融合遺伝子に関する基礎的な検討を行った結果、この遺伝子産物はLTKキナーゼ*3の恒常的な活性化を起こし、細胞のがん化や腫瘍形成を引き起こす新しいドライバー遺伝子であることが明らかになりました。さらに、ALK融合遺伝子に対して承認されている分子標的薬ロルラチニブが、CLIP1-LTK融合遺伝子を有する肺がんに極めて有効であることが基礎研究で明らかとなりました。
なお本研究成果は、日本時間2021年11月25日付に英国科学雑誌「Nature」電子版に掲載されました。また、本発見に基づき、LTK融合遺伝子を有する進行再発非小細胞肺がんに対して、ロルラチニブの安全性・有効性を検証する臨床第II相試験を現在計画中です。
背景
日本における死因の第1位はがんであり、このうち肺がんはがん死亡原因として最多です。初期の肺がんと診断された場合は手術が可能ですが、手術不能の進行肺がんと診断された場合は、薬物療法や放射線療法で治療を行うことになります。近年の遺伝子解析技術の進歩により、肺がん発症の原因となる様々な遺伝子変化(ドライバー遺伝子)が相次いで発見され、これらのドライバー遺伝子を有する肺がんには、それを標的とした分子標的薬の有効性が高いことがわかってきました。
現在、EGFR、ALK、ROS1、BRAF、NTRK、MET、RETなどのドライバー遺伝子を有する進行肺がんには、それぞれに対する分子標的薬を用いることが強く推奨されています。このように遺伝子変化を同定して、それに対応する有効性の高い薬剤を用いて治療を行うことを「個別化医療」と呼びます。しかし、非小細胞肺がんの約50~60%には、これらのドライバー遺伝子が存在しないため、従来の抗がん剤や免疫チェックポイント阻害剤を用いた治療が行われます。
今後、個別化医療をさらに発展させるためには、既知のドライバー遺伝子を有していない非小細胞肺がんにおいて、治療標的となるような遺伝子変化を発見し、それに対する有効な治療を開発することが求められています。
研究方法・成果/取り組み内容
LC-SCRUM-Asiaでは、国立がん研究センター東病院 呼吸器内科 医長 松本慎吾が中心となり、既知のドライバー遺伝子が陰性の非小細胞肺がんを対象にして、全RNAシーケンス解析*4を行い、新しいドライバー遺伝子を探索する研究を2020年10月より開始しました。
その結果、肺がんの新しいドライバー遺伝子として「CLIP1-LTK融合遺伝子」を、世界で初めて発見しました。さらに、過去にLC-SCRUM-Asiaに登録された542例の非小細胞肺がんの検体を用いてRT-PCR解析*5を行った結果、CLIP1-LTK融合遺伝子は2例(0.4%)で検出されました。CLIP1-LTK融合遺伝子が同定された腫瘍は、いずれも肺腺がんであり、既知のドライバー遺伝子とは相互排他的でした。
さらに、細胞や実験動物を用いて基礎的な検討をした結果、CLIP1-LTK融合遺伝子は、LTKキナーゼの恒常的な活性化によって、細胞増殖や腫瘍形成など、がん化を引き起こすことが示されました(図1)。LTK遺伝子は、ALK遺伝子と塩基配列や蛋白構造の相同性が高いことから、ALKキナーゼ阻害剤の多くはLTKキナーゼの阻害活性も有することが報告されています。このことから、7種のALK阻害剤の効果を細胞実験で検討した結果、特にロルラチニブがCLIP1-LTK融合蛋白のキナーゼ阻害作用、および細胞増殖抑制効果を示しました。また、マウス異種移植モデルにおいても、ロルラチニブの抗腫瘍効果が確認されました。
これらの基礎研究を基に、CLIP1-LTK融合遺伝子陽性の肺腺がんの患者さんに、ロルラチニブ(院内諸手続き後の適応外使用)による治療を行ったところ、著明な抗腫瘍効果を認めました(図2)。
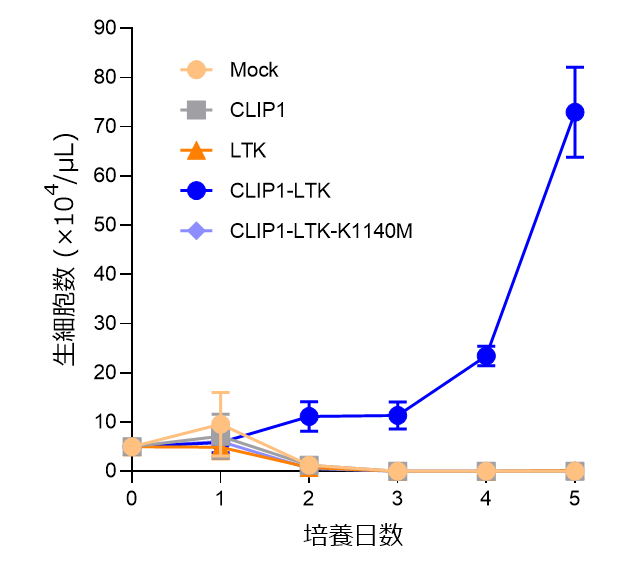
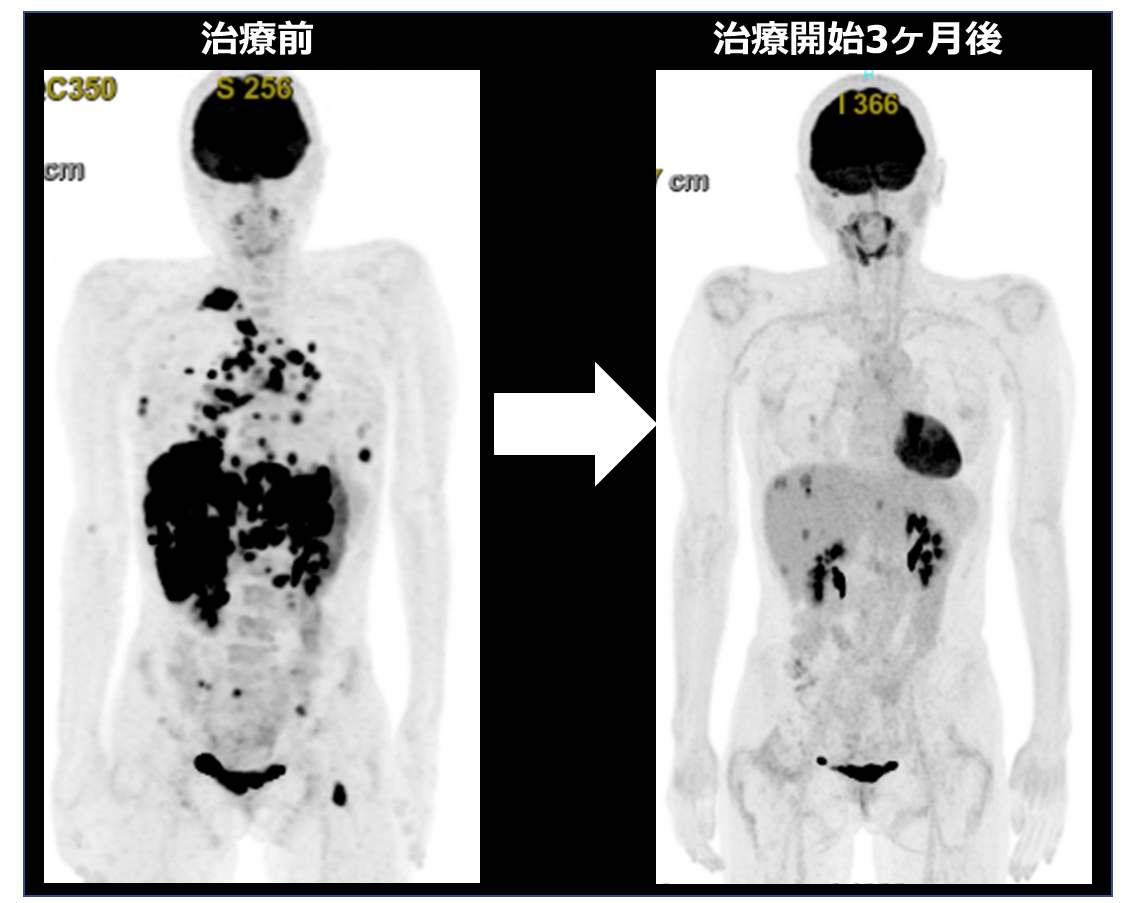
今後の展望
CLIP1-LTK融合遺伝子の頻度は非小細胞肺がんの1%未満であり、極めて希少な肺がんですが、国内だけでも年間約400人の患者さんがLTK融合遺伝子陽性肺がんで亡くなっていると推測されます。よって、これらの患者さんへ有効な治療薬を届けるために、現在、LC-SCRUM-Asiaの遺伝子スクリーニングを活用して、CLIP1-LTK融合遺伝子を有する非小細胞肺がんを見つけ出し、LTK阻害薬の有効性を検討する臨床試験を行うことを計画しています。併せて、CLIP1-LTK融合遺伝子陽性肺がんを正確に診断するための診断薬開発も行っていく予定です。
我々の治療薬開発、診断薬開発に基づいて、CLIP1-LTK融合遺伝子に対する有効な治療法が確立することで、ドライバー遺伝子に基づく肺がんの個別化医療がさらに発展していくと考えます。
今後もLC-SCRUM-Asiaは、日本及びアジア各国の参加施設や肺がん患者さんの協力のもと、大規模な遺伝子スクリーニングを継続して行い、その解析データの蓄積によって、新しい治療薬や診断薬の開発を推進し、肺がんの個別化医療の確立・発展に挑戦していきます。
発表論文
雑誌名
Nature
タイトル
The CLIP1–LTK fusion is an oncogenic driver in non-small-cell lung cancer
著者
Hiroki Izumi1, Shingo Matsumoto1, Jie Liu2, Kosuke Tanaka2, Shunta Mori1, Kumiko Hayashi3, Shogo Kumagai4, Yuji Shibata1, Takuma Hayashida2,5, Kana Watanabe6, Tatsuro Fukuhara6, Takaya Ikeda1, Kiyotaka Yoh1, Terufumi Kato7, Kazumi Nishino8, Atsushi Nakamura9, Ichiro Nakachi10, Shoichi Kuyama11, Naoki Furuya12, Jun Sakakibara-Konishi13, Isamu Okamoto14, Kageaki Taima15, Noriyuki Ebi16, Haruko Daga17, Akira Yamasaki18, Masahiro Kodani18, Hibiki Udagawa1,2, Keisuke Kirita1, Yoshitaka Zenke1, Kaname Nosaki1, Eri Sugiyama1, Tetsuya Sakai1, Tokiko Nakai19, Genichiro Ishii19, Seiji Niho1, Atsushi Ohtsu20, Susumu S. Kobayashi 2,5,21, and Koichi Goto1
所属
- Department of Thoracic Oncology, National Cancer Center Hospital East, Kashiwa 277-8577, Japan.
- Division of Translational Genomics, Exploratory Oncology Research and Clinical Trial Center, National Cancer Center, Kashiwa 277-8577, Japan.
- LSI Medience Corporation Central Laboratory, Itabashi-ku174-8555, Japan
- Division of Cancer Immunology, Research Institute/Exploratory Oncology Research & Clinical Trial Center, National Cancer Center, Kashiwa 277-8577, Japan.
- Department of Integrated Biosciences, Graduate School of Frontier Sciences, The University of Tokyo, Kashiwa 277-8561, Japan.
- Department of Respiratory Medicine, Miyagi Cancer Center, Natori, 981-1293, Japan.
- Department of Thoracic Oncology, Kanagawa Cancer Center, Yokohama 241-8515, Japan
- Department of Thoracic Oncology, Osaka International Cancer Institute, Osaka 541-8567, Japan
- Department of Pulmonary Medicine, Sendai Kousei Hospital, Sendai 980-0873, Japan
- Pulmonary Division, Department Internal Medicine, Saiseikai Utsunomiya Hospital, Utsunomiya 321-0974, Japan
- Department of Respiratory Medicine, National Hospital Organization Iwakuni Clinical Center, Iwakuni 740-8510, Japan
- Division of Respiratory Medicine, Department of Internal Medicine, St. Marianna University School of Medicine, Kawasaki 216-8511, Japan
- First Department of Medicine, Hokkaido University Hospital, Sapporo 060-8648, Japan
- Research Institute for Diseases of the Chest, Graduate School of Medical Sciences, Kyushu University, Fukuoka 812-8582, Japan
- Department of Respiratory Medicine, Hirosaki University Graduate School of Medicine, Hirosaki 036-8562, Japan
- Department of Respiratory Medicine, Iizuka Hospital, Iizuka 820-8505, Japan
- Department of Medical Oncology, Osaka City General Hospital, Osaka 534-0021, Japan
- Division of Respiratory Medicine and Rheumatology, Department of Multidisciplinary Internal Medicine, Faculty of Medicine, Tottori University, Yonago 683-8504, Japan
- Department of Pathology and Clinical Laboratories, National Cancer Center, Kashiwa 277-8577, Japan
- Department of Gastroenterology and Gastrointestinal Oncology, National Cancer Center Hospital East, Kashiwa 277-8577, Japan
- Department of Medicine, Beth Israel Deaconess Medical Center, Harvard Medical School, Boston, MA 02215, USA
DOI
10.1038/s41586-021-04135-5
掲載日
2021年11月25日
研究費
日本医療研究開発機構(AMED)
革新的がん医療実用化研究事業
「EGFR遺伝子変異陽性の進行非小細胞肺癌におけるEGFR阻害薬耐性機序(C797S耐性変異)を克服する新規治療法の確立を目指した研究」(JP21ck016568)
「希少遺伝子変異を有する小細胞肺癌に対する新規治療法の確立に関する研究」(JP21ck0106289)
「遺伝子スクリーニング基盤(LC-SCRUM-Japan)を利用した、MET遺伝子異常陽性の進行非小細胞肺癌に対する治療開発を目指した研究」(JP21ck0106294)
臨床ゲノム情報統合データベース整備事業
「ゲノム創薬・医療を指向した全国規模の進行固形がん、及び、遺伝性腫瘍臨床ゲノムデータストレージの構築」(JP18kk0205004)
臨床研究・治験推進研究事業
「産学連携全国がんゲノムスクリーニング(SCRUM-Japan)を利用したがん新薬開発に資する疾患登録システムの構築」(JP18Ik0201056)
創薬基盤推進研究事業
「産学連携全国がんゲノムスクリーニングプログラム:SCRUM-Japanを活用したプレシジョンメディスン推進基盤構築研究」(JP20ak0101050)
日本学術振興会科学研究費助成事業 (JSPS KAKENHI)
国立がん研究センター研究開発費(31-A-5)
公益財団法人高松宮妃癌研究基金
用語解説
*1 LC-SCRUM-Asia

2013年より国立がん研究センターが全国の医療機関、製薬企業と協力して開始した国際的な遺伝子スクリーニング事業(代表:東病院 呼吸器内科長 後藤功一)。2019年よりその実施基盤を東アジアに拡大し、2021年10月までに1万4千人以上の肺がんの患者さんが研究に参加。肺がんの新しい治療薬、診断薬の臨床応用を目指して、大規模な遺伝子解析を行っている。今後も、肺がんの最適医療の発展を目指して、アカデミアと産業界が一体となり、新規の治療薬や診断薬の開発を推進する。
*2 ドライバー遺伝子
がんの発生や進展に直接的な関わりを持つ遺伝子。一般的に、個々のがんでドライバー遺伝子は一つであり、相互排他的に存在する。
*3 キナーゼ
基質あるいはターゲット分子にリン酸基を転移する酵素の総称で、リン酸化酵素ともいう。細胞の生存・増殖は、主にキナーゼの活性により調節されている。非小細胞肺がんにおけるドライバー遺伝子の多くは、キナーゼをコードする遺伝子であり、遺伝子変化によって、恒常的なキナーゼ活性化を引き起こし、がん化に関与する。
*4 全RNAシーケンス解析
次世代シーケンサーを用いて全転写産物の塩基配列を決定する解析。転写産物量を網羅的に推定できるだけでなく、融合遺伝子を含む、新規転写産物の探索も可能となる。
*5 RT-PCR (Reverse transcription-polymerase chain reaction)
RNAを鋳型としてDNAを合成(逆転写反応、reverse transcription:RT)し、ポリメラーゼ鎖反応(polymerase chain reaction:PCR)法で、目的の遺伝子産物を選択的に増幅し、検出する手法。
問い合わせ先
患者さん・医療機関・企業等からのお問い合わせ
国立研究開発法人 国立がん研究センター東病院
LC-SCRUM-Asia 研究事務局
電話番号:04-7133-1111(代表)
Eメール:scrum_office●east.ncc.go.jp
参加方法:http://www.scrum-japan.ncc.go.jp/patient_participate/lc_scrum/index.html
取材・報道関係からのお問い合わせ
国立研究開発法人 国立がん研究センター
企画戦略局 広報企画室(柏キャンパス)
電話番号:04-7133-1111(代表)
FAX:04-7130-0195
Eメール:ncc-admin●ncc.go.jp
AMED事業に関すること
国立研究開発法人 日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課
Eメール:cancer●amed.go.jp
