標準治療のない超希少がん内膜肉腫でのMDM2阻害剤の有効性を確認 MDM2阻害剤耐性に関連する遺伝子異常も同時に報告―米国癌学会旗艦誌「Cancer Discovery」に論文発表―
2023年7月13日
国立研究開発法人国立がん研究センター
発表のポイント
- 標準治療がなく、頻度が極めて低い「超希少がん」である内膜肉腫の患者さんに対する医師主導治験において、内服薬MDM2阻害剤(ミラデメタン)が治療の選択肢となる可能性を初めて示しました。
- また、本研究では、患者さんの腫瘍組織および血液検体を解析し、MDM2阻害剤の有効性に関連する遺伝子異常、およびMDM2阻害剤の耐性に関連する遺伝子異常を見出し、初めて報告しました。
- 本研究成果によって、超希少がんに対する新たな治療選択肢とともに、経時的な検体解析による開発手法の有用性も示しました。治療開発が難しいとされる超希少がんに対して、Precision Oncology (精密がん治療) による治療開発の可能性が期待されます。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)中央病院(病院長:島田和明)は、がん化やがん細胞の増殖に関連するMDM2(注)の増幅を有する内膜肉腫の患者さんに対してMDM2(注)阻害剤(ミラデメタン)の有効性を評価する第1b/2相医師主導治験を実施しました。その結果、10名中2名(20%)で、腫瘍の30%以上の縮小(奏効)が認められました。標準治療のない内膜肉腫に対してMDM2阻害剤が有効である可能性を初めて示しました。
また同時に、国立がん研究センター研究所(所長:間野博行)において、投与前後の腫瘍組織および血液検体の経時的な遺伝子解析を行い、MDM2阻害剤の有効性と耐性(効果を低下させる機序)に関連する遺伝子異常を初めて同定しました。今後、MDM2阻害剤の治療効果を予測するバイオマーカーとしての活用が期待されます。
本研究成果により、本研究手法が大規模な臨床試験の実施が難しい超希少がんにおける新たな治療開発手法として有用であることが示され、超希少がんでのPrecision Oncology (精密がん治療) の実現にむけた大きな一歩となりました。
本研究の成果は、米国癌学会旗艦誌「Cancer Discovery」に米国時間2023年6月27日付で掲載されました。
(注)以後、遺伝子名はイタリック(例:MDM2)、たんぱく質を示す場合はローマン(例:MDM2)で表記します。
背景
内膜肉腫は、大血管や心臓から発生する極めて稀な悪性腫瘍であり、心臓原発悪性腫瘍の中で最も多い組織タイプの一つです。内膜肉腫は、希少がんの中でもさらに患者数が少ない超希少がんであり、希少がんが集積される当院でも2011年から2017年の7年間で内膜肉腫患者は11例でした。内膜肉腫の患者さんの予後は悪く、全生存期間の中央値は8-13カ月と報告されています。内膜肉腫は、大血管や心臓に発生する腫瘍であることから、診断時に完全切除や適切な切除断端の確保が困難です。局所治療(手術や放射線治療)を容易にし、症状をコントロールするには、迅速な腫瘍縮小が重要であると考えられます。しかしながら、現在使用されている化学療法(アントラサイクリン系薬剤を含む)では、迅速な腫瘍縮小の期待は難しく、革新的な新しい治療法が必要と考えられていました。また、内膜肉腫は、MDM2の過剰発現と染色体12q12-15領域(CDK4とMDM2を含む)の増幅によって特徴づけられる腫瘍です。
中央病院では、2017年5月から希少がんの研究開発およびゲノム医療を推進する産学共同プロジェクト「MASTER KEY プロジェクト」(注1)を行っています。本医師主導治験はその枠組みの中で、MDM2阻害剤が本疾患の治療戦略になる可能性があると推測し、世界で初めて実施したものです。
MDM2およびMDM2阻害剤(ミラデメタン)について
がん抑制遺伝子のひとつであるTP53の異常はがん種にもよりますが約50%のがん患者さんで認められます。MDM2は、p53(TP53がコードするたんぱく質)の機能を抑制するたんぱく質です。TP53に異常がない場合にも、遺伝子増幅によるMDM2過剰発現により、p53機能が破綻する腫瘍もあります。MDM2阻害剤は、MDM2とp53の結合を阻害することによってp53を活性化し、p53を有するがん細胞に細胞死をもたらすことが期待されています。
本試験で使用したMDM2阻害剤である内服薬ミラデメタンは、第一三共株式会社が創製したMDM2とp53の結合を特異的に阻害する低分子化合物で、現在、米国Rain Oncology社主導により米国および日本で、複数の進行固形腫瘍および造血器腫瘍に対する臨床試験が実施されています。
研究概要
試験名
MDM2増幅を有する内膜肉腫を対象としたDS-3032b単剤療法の第1b/2相医師主導治験(MADAME PRINCESA試験/ NCCH1806 /MK04)
参加施設
国立がん研究センター中央病院
登録期間
2018年12月28日から2020年7月17日
主な登録条件
年齢が18歳以上
全身状態が良好(ECOG PSが0、1、2)
MDM2発現(免疫組織化学)またはMDM2増幅(FISHもしくは次世代シーケンサー)が確認された など
登録数
11人(登録後にTP53の変異が検出されたため、1名の患者を奏効評価から除外)
年齢
20代~70代(平均年齢33.0歳)
主目的
中央判定で奏効が確認された患者数
副次的目的
中央判定で確認された奏効率、病勢制御率、無増悪生存期間、全生存期間、安全性
使用薬剤
MDM2阻害剤(ミラデメタン)(第一三共株式会社提供)
投与量
ミラデメタン260ミリグラム14日間で3日間投与、1サイクルは28日間
2019年2月4日 プレスリリース
企業主導開発が困難な超希少がんの臨床試験計画や新薬開発手法の確立を目指す
世界初、MDM2阻害剤を用いた内膜肉腫対象医師主導治験 中央病院MASTER KEY projectで開始
https://www.ncc.go.jp/jp/information/pr_release/2019/0204/index.html
結果
1.内膜肉腫へのMDM2阻害剤投与による抗腫瘍効果を10名中2名で確認
ミラデメタンが投与された10名の患者のうち、2名が部分奏効(PR)を達成し、全奏効率は20.0%(95%信頼区間、2.5-55.6)で、病勢制御率は60.0%(95%信頼区間、26.2-87.6)でした(図1)。無増悪生存期間の中央値は4.7カ月(95%信頼区間、1.3-8.3)で、全生存期間の中央値は12.2カ月(95% 信頼区間、1.9-到達せず)でした。2名の患者さんにおいて、非常に有効な抗腫瘍効果が認められました(図2)。
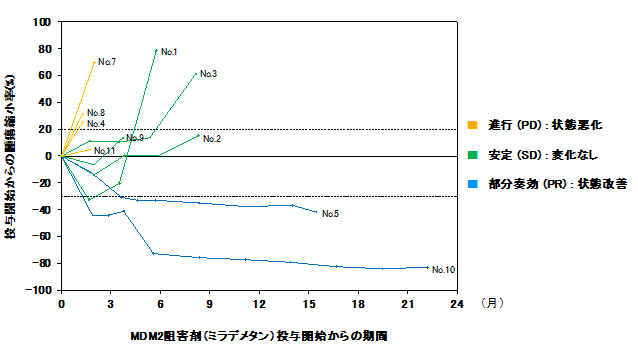
図1:患者(No.1~5、No.7~11)ごとのMDM2阻害剤(ミラデメタン)投与開始からの期間と腫瘍縮小率
No.5とNo.10の患者さんに非常に有効な抗腫瘍効果が認められた。
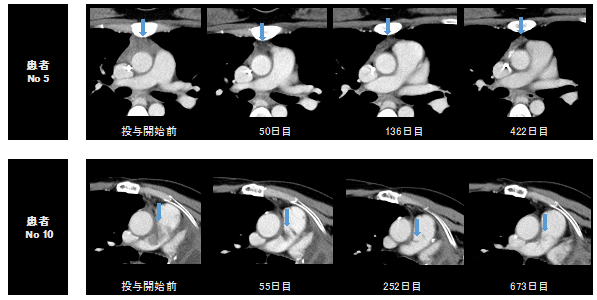
図2:非常に有効な抗腫瘍効果を示した2名の患者さんの治療開始前とMDM2阻害剤(ミラデメタン)投与中のCT画像
2.MDM2阻害剤の有効性、耐性に関連する遺伝子異常の検出
本医師主導治験に参加した患者さんの腫瘍組織サンプルを用いて、遺伝子変異と遺伝子発現について解析を実施しました。内膜肉腫で異常の検出されることの多い8個の遺伝子(CDK4、CDKN2A、CDKN2B、EGFR、ERBB3、MDM2、PDGFRA、TP53)およびMDM2阻害剤の抗腫瘍効果との関連が報告されている10個の遺伝子(AKT1、ATM、BBC3、CDKN1A、CDKN1C、CHEK2、MDM4、PMAIP1、PPM1D、TWIST1)に注目して解析したところ、抗腫瘍効果が認められた患者さんではTWIST1が増幅していたことを見出しました(P = 0.028)。またCDKN2A欠失と負の相関を示す傾向もあることが示されました(P = 0.071)(図3)。
10名の患者さんのうち8名で、投与開始時、2サイクル目開始時、病勢進行時に血中ctDNA(circulating tumor DNA)(注2)を順次採取しました。ctDNAのTP53変異は、投与開始時には1名で検出されただけでしたが、病勢進行時には5名の患者さんで検出されました。No.5の患者さんにおいてはTP53変異のctDNAにおけるバリアントアレル頻度(DNA配列が異なる部分の発生頻度)は、疾患の進行とともに増加し、TP53変異サブクローン(同じ遺伝子の中でも高頻度で見られたDNA変異)の割合を高めることがわかりました(図4)。
本結果において、MDM2阻害剤の有効性にはTWIST1 増幅 および CDKN2A 欠失が関連しており、耐性にはTP53変異が関連していることが示唆されました。
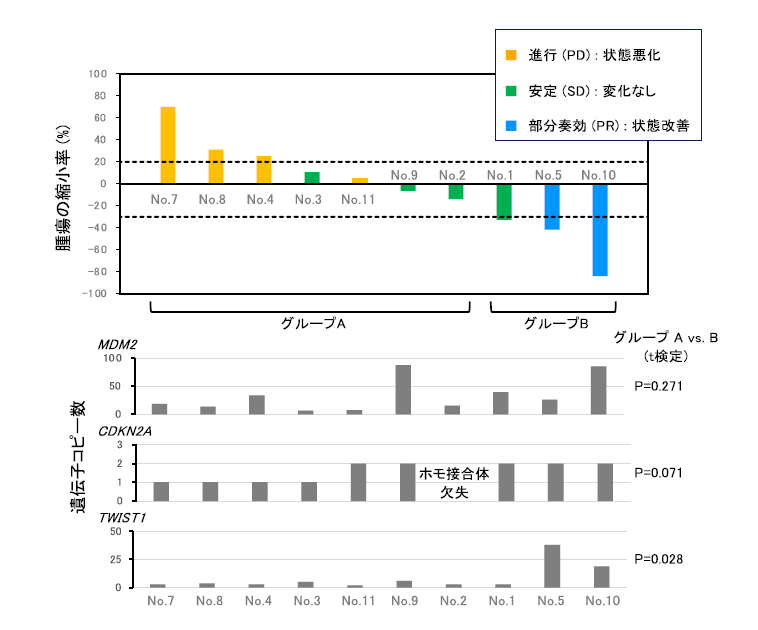
図3:効果予測バイオマーカーの探索
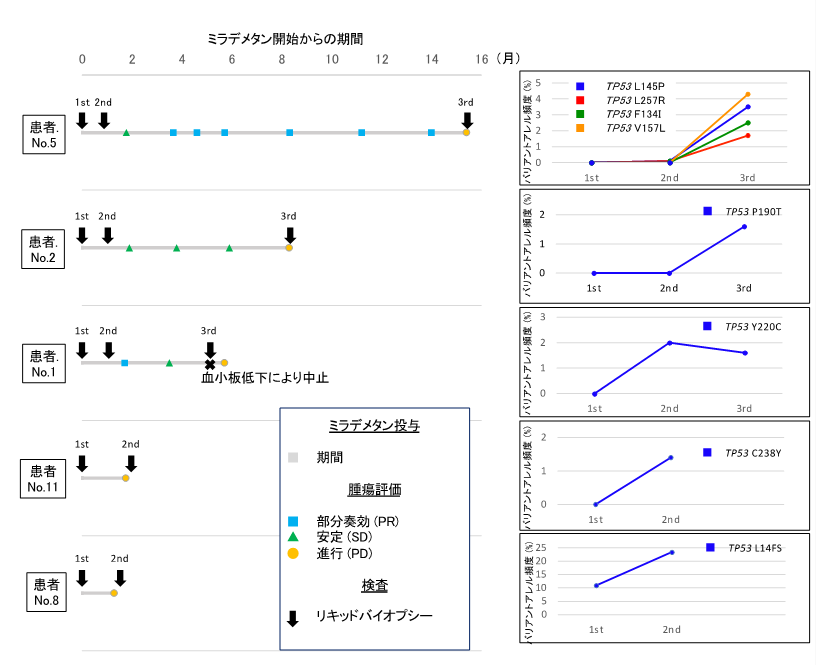
図4:MDM2阻害剤(ミラデメタン)開始前(1st)、2サイクル開始時(2nd)、病勢進行時(3rd)の血中ctDNAのTP53変異の変化
展望
本研究によって、MDM2阻害剤であるミラデメタンがMDM2増幅を有する内膜肉腫の患者さんに有効である可能性が示唆され、今後さらなる評価が行われていくことが期待されます。また、MDM2阻害剤(ミラデメタン)の有効性を最適化する戦略として、本研究により示唆されたTWIST1増幅やCDKN2A欠失などが新しい効果予測バイオマーカーとなる可能性を検討し、MDM2阻害剤が有効な患者さんを選択したり、MDM2阻害剤と他の治療薬との併用療法を開発することが考えられます。
またMDM2阻害剤で治療中に順次血中ctDNA解析をし、TP53変異のモニタリングを行うことで、病勢を評価できる可能性があります。国立がん研究センターでは、腫瘍組織や血液検体を経時的に採取・解析することで、図5のように抗がん剤の効果をみるだけでなく、効果予測のマーカーや効果を減弱する原因(耐性)を見出すTR(トランスレーショナル・リサーチ)(注3)を推進する体制が築地キャンパス内の中央病院と研究所の連携によって確立されつつあり、今後さらに研究を加速させていきます。
本研究が大規模な臨床試験の実施が難しい超希少がんにおけるPrecision Oncology (精密がん治療) の実現に向けた大きな一歩となりました。今後、超希少がんの臨床試験計画や新薬開発手法の新たなモデル構築となり、わが国の希少がん領域における臨床開発の活性化への貢献が期待されます。
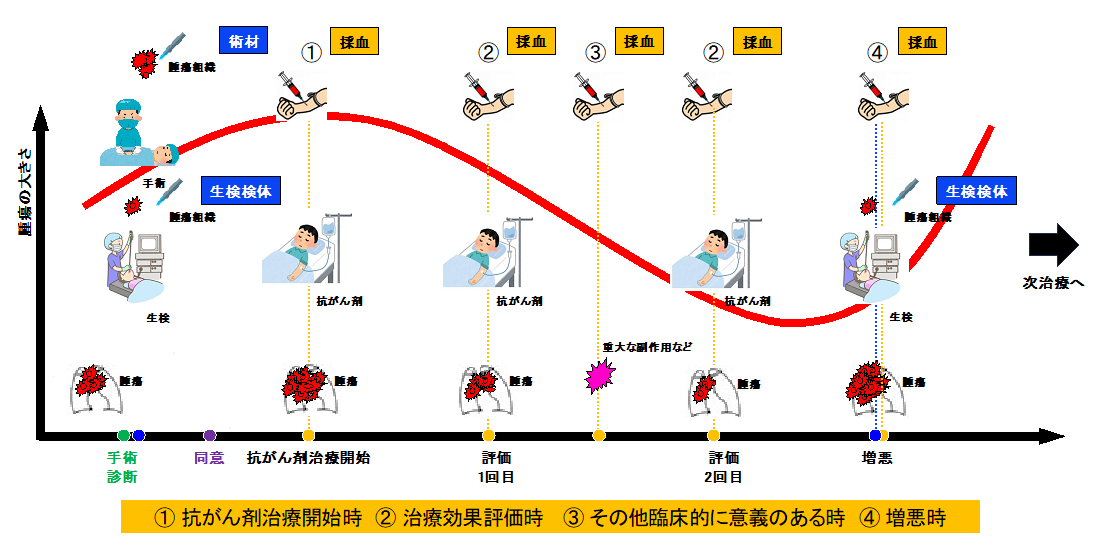
図5:腫瘍組織や血液検体(ctDNA)を経時的に採取し解析することの可能性(概略図)
参考 Tsukiji TR Boardについて
Tsukiji TR Boardは、築地キャンパスのトランスレーショナル・リサーチ(TR)を活性化すること、及び製薬企業・アカデミアへの築地TR研究体制の“見える化”“易アクセス化”を目的に、中央病院と研究所が一体となって進めている新たなTR研究の枠組みです。詳細は以下のサイトをご覧ください。
Tsukiji TR Board
論文情報
雑誌名
Cancer Discovery
タイトル
Clinical activity and exploratory resistance mechanism of milademetan, an MDM2 inhibitor, in intimal sarcoma with amplified MDM2 from an open-label phase 1b/2 study
著者
Takafumi Koyama, Toshio Shimizu, Yuki Kojima, Kazuki Sudo, Hitomi Sumiyoshi Okuma, Tatsunori Shimoi, Hitoshi Ichikawa, Shinji Kohsaka, Ryo Sadachi , Akihiro Hirakawa , Akihiko Yoshida, Reiko Makihara Ando, Toshihide Ueno , Mitsuru Yanagaki, Naoko Matsui, Kenichi Nakamura, Noboru Yamamoto, Kan Yonemori
掲載日
米国時間2023年6月27日付
DOI
10.1158/2159-8290.CD-23-0419
URL
https://doi.org/10.1158/2159-8290.CD-23-0419(外部サイトにリンクします)
研究費
- 国立研究開発法人日本医療研究開発機構(AMED)
臨床研究・治験推進研究事業
がん領域Clinical Innovation Network事業による超希少がんの臨床開発と基盤整備を行う総合研究
- 国立がん研究センター研究開発費 (2022-A-02)
薬剤提供
第一三共株式会社
用語解説
(注1)MASTER KEY プロジェクト
国立がん研究センター中央病院では、希少がんでの治療開発を推進するため、2014年には「希少がんセンター」を開設し、2017年からは企業とも共同で希少がんの研究開発・ゲノム医療を推進する「MASTER KEY(マスター キー) プロジェクト」を立ち上げています。MASTER KEY プロジェクトはレジストリ研究と副試験の2つのパートに分かれ、これまでに 3,300例以上の患者さんが登録しています。副試験パートでは現在27 件(16件の医師主導治験、11件の企業治験を実施)の臨床試験を実施しています(2023年7月)。今回の医師主導治験もMASTER KEYプロジェクトの枠組みで実施したものです。
MASTER KEY(マスター キー) プロジェクト ウェブサイト
https://www.ncc.go.jp/jp/ncch/masterkeyproject/index.html
(注2)ctDNA
血漿中に存在する遊離DNAのことをcell-free DNA (cfDNA)と呼びます。多くは血球系細胞の死滅に由来するDNAといわれており、健常人にも存在します。がん患者さんにおいてはがん細胞のゲノムDNAが血中に漏出することになり、このDNAはcfDNAと区別するために、ctDNA (circulating tumor DNA)と呼ばれます。
(注3)TR(トランスレーショナル・リサーチ)
トランスレーショナル・リサーチは、日常診療で応用可能な新しい医療技術・医薬品を開発することを目的に行う、非臨床から臨床開発までの幅広い研究を指します。国立がん研究センターでは築地キャンパス内で、中央病院と研究所が連携し、トランスレーショナル・リサーチを推進しています。今回の研究では基盤的臨床開発研究コアセンター(FIOC)の解析技術やバイオリソースが大きな役割を担いました。
お問い合わせ先
研究に関するお問い合わせ
国立がん研究センター中央病院
先端医療科 小山 隆文
電話番号:03-3542-2511 (代表) Eメール:takoyama●ncc.go.jp
広報窓口
国立がん研究センター
企画戦略局 広報企画室
電話番号:03-3542-2511(代表) Eメール:ncc-admin●ncc.go.jp
