正常細胞でのがん遺伝子活性化によるゲノム異常獲得機構を解明 DNA複製ストレス耐性を標的とした新しいがん予防・治療法開発に期待
2023年9月7日
国立研究開発法人国立がん研究センター
発表のポイント
- 正常細胞がゲノム異常を獲得するメカニズムを明らかにしました。
- がん遺伝子の活性化が、DNA複製の進行を妨害し、DNA複製ストレスを誘発することを発見しました。
- DNA複製ストレスに応答するタンパク質がそのストレスを回避させる過程で、ゲノム異常を誘発するメカニズムを解明しました。
- DNA複製ストレス耐性機構を標的とした、早期のがん予防や新しい治療法の開発が期待されます。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)研究所(所長:間野博行)ゲノムストレス応答学ユニット 塩谷文章ユニット長、五十嵐太一連携大学院生 (北里大学大学院理学研究科)などからなる研究チームは、正常細胞が発がんの初期にゲノム異常を獲得するメカニズムを解明しました。正常細胞が発がんする過程は未だ多くの部分が解明されていません。研究チームは、肺正常上皮細胞に、肺腺がんで高頻度に見られるKRAS変異体を発現させ、正常細胞がゲノム異常を獲得し、発がんする過程を解析しました。
その結果、発がんを促進するKRAS遺伝子変異体(注1)の発現によって、DNA複製の進行を妨害するクロマチン(注2)が強く凝縮したかたい領域(ヘテロクロマチン)(注3)が形成され、DNA複製が速やかに、適切に行えない状態であるDNA複製ストレス(注4)が誘発されることを明らかにしました。このDNA複製ストレスにより、ほとんどの細胞において細胞死が引き起こされるのに対して、一部の細胞ではDNA複製ストレスに応答するATRというリン酸化タンパク質の発現が亢進し、複製を危機回避的に再開するDNA複製ストレス耐性を獲得することを明らかにしました。しかしながら、DNA複製ストレス耐性機構はDNA損傷を残す性質があり、生き残った細胞はゲノム異常を獲得しながら増殖することを明らかにしました。これらの細胞はがんの起源となる可能性があります。またKRAS遺伝子に変異を持つ肺がん患者におけるATRの高発現は、予後不良と関連することを明らかにしました。本研究成果は、肺がんの中でも増加傾向にある肺腺がんの病態解明や、DNA複製ストレス耐性機構を治療標的とすることによる早期のがん予防や、新たな治療法の確立につながることが期待されます。
本研究成果は、2023年8月17日付で英国科学雑誌 「Nature Communications」 に掲載されました。
背景
正常細胞から発がんする過程は未だ多くの部分が解明されていませんが、がんは正常細胞にゲノム異常を蓄積した結果、発生すると考えられています。そのため、ゲノム異常が生じる過程を解明することは、がんの根本治療と予防を目指すうえで、非常に重要な研究課題です。
遺伝性のがんの多くは、DNA修復機構(注5)の機能不全が原因となり、DNAの修復を適切に行えないことによるゲノム異常が蓄積していった結果、生じると考えられています。一方、環境要因や外的なストレスの結果生じる散発性のがんにおいては、DNA修復機構の機能不全頻度は低いにも関わらず、遺伝性のがんと同様にゲノム異常が高頻度で認められます。しかし、散発性のがんの発生過程において、正常細胞にゲノム異常が蓄積する過程には不明な点が多くありました。
以上の背景から、散発性のがんの発生初期過程に起こるがん遺伝子の活性化に注目し、正常細胞がどのように応答し、ゲノム異常が誘発されるのかを研究しました。
研究方法・結果
1. ATR高発現は複製ストレス耐性を制御する
発がんを促進するKRAS遺伝子の恒常活性化変異体を肺の正常細胞で発現させる実験系を用いて、がんが生じる初期過程で、ゲノム上にどのような変化が起きるのかを調査しました。

図1. DNA複製ストレス耐性細胞の出現機序
変異型KRASの発現は、RNA転写を局所的に変調させ、それに応答したクロマチン制御因子が、DNA複製の進行を妨害するクロマチンが強く凝縮した「かたい」領域(ヘテロクロマチン)の形成を促進し、DNA複製ストレスを誘発することが明らかとなりました。多くの細胞は、この複製ストレス(Replication stress: RS)に応答して細胞死を引き起こしましたが、興味深いことに、一部の細胞はこの状況に耐性を獲得することがわかりました(図1)。
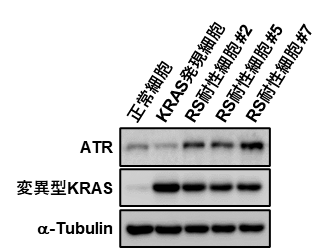
図2. DNA複製ストレス(RS)耐性細胞ではATRが高発現する
DNA複製ストレス耐性細胞を詳細に解析したところ、Ataxia telangiectasia and Rad3-related protein(ATR)というDNA複製ストレスに応答するリン酸化タンパク質が高発現していることがわかりました(図2)。
また、人為的にATRを高発現させた細胞も、DNA複製ストレスに耐性を示すことがわかりました。
以上の結果から、変異型KRASを発現した発がん初期過程の細胞にとって、ATRの高発現がその生存に必要十分であることを示しました。
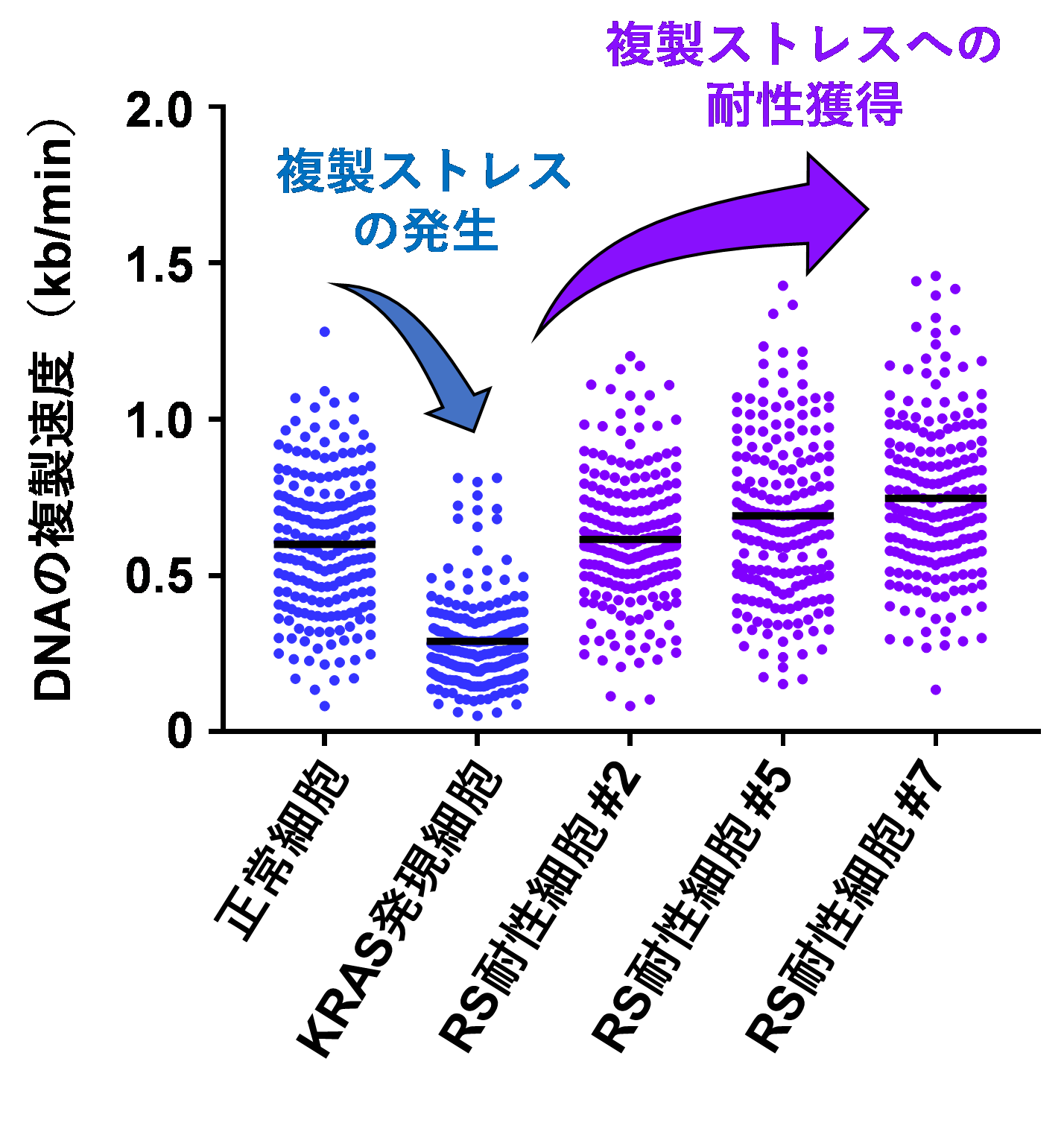
図3. DNA複製ストレス耐性細胞における危機回避的DNA複製
次に、複製ストレス耐性細胞の複製動態に注目しました。先述のように、変異型KRASの発現は、複製ストレスを誘導します(図3、青)。複製ストレス耐性細胞は、変異型KRASを発現しているにも関わらず、複製を危機回避的に続行することが可能であることが見出されました(図3、紫)。このように複製の妨害に対して耐性を獲得し、細胞増殖を続けることが、発がん初期の重要なメカニズムであると考えられます。
2.ATRによる複製ストレス耐性機構の解明
ATRが制御するリン酸化タンパク質の解析から、複製ストレスに応答して、PrimPol(注6)という特殊な複製酵素がATR依存的に活性化されていることが分かりました。PrimPolはクロマチンが凝縮した「かたい」領域を回避して、複製を再開させることがわかりました。その一方で、複製を途切れ途切れに行うPrimPolの特殊な性質から、ゲノムの異常の原因となるDNA損傷を、「かたい」領域付近に残してしまうことも明らかとなりました。以上の機構から、ATR-PrimPol依存的に複製を行う複製ストレス耐性細胞には、高頻度でゲノム異常が蓄積することが明らかとなりました(図4)。
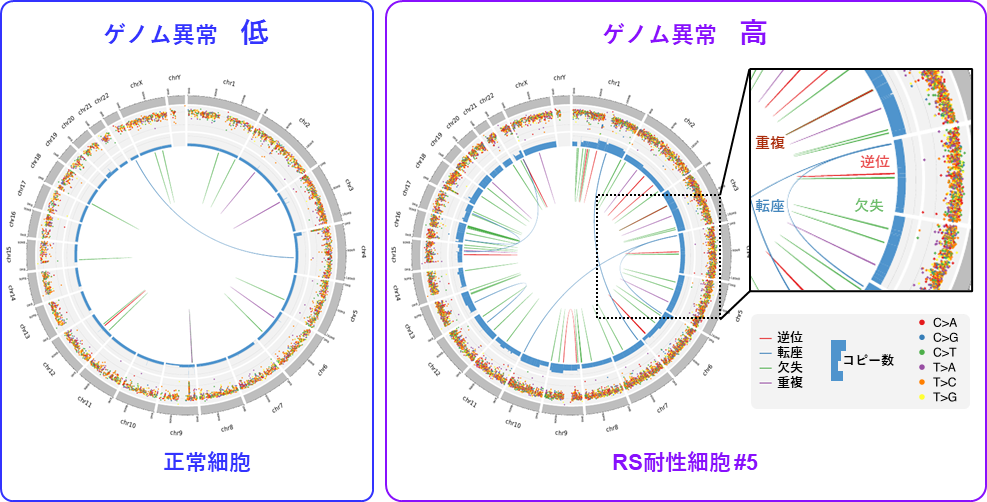
図4. DNA複製ストレス耐性細胞ではゲノム異常が高頻度に蓄積する
3.複製ストレス耐性機構は肺がんの予後不良に寄与する
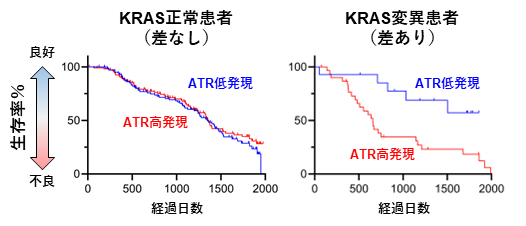
図5. ATR高発現はKRAS変異がんの予後不良に関連する
最後に、ATRが制御する危機回避的な複製ストレスの耐性機構の臨床的意義について調査しました。米国TCGAデータベース(注7)、および国立がん研究センターPRISMプロジェクト(注8)の肺がん患者のコホート解析から、ATRの高発現は、KRAS変異がん患者の予後不良と有意に相関するという結果が得られました(図5)。
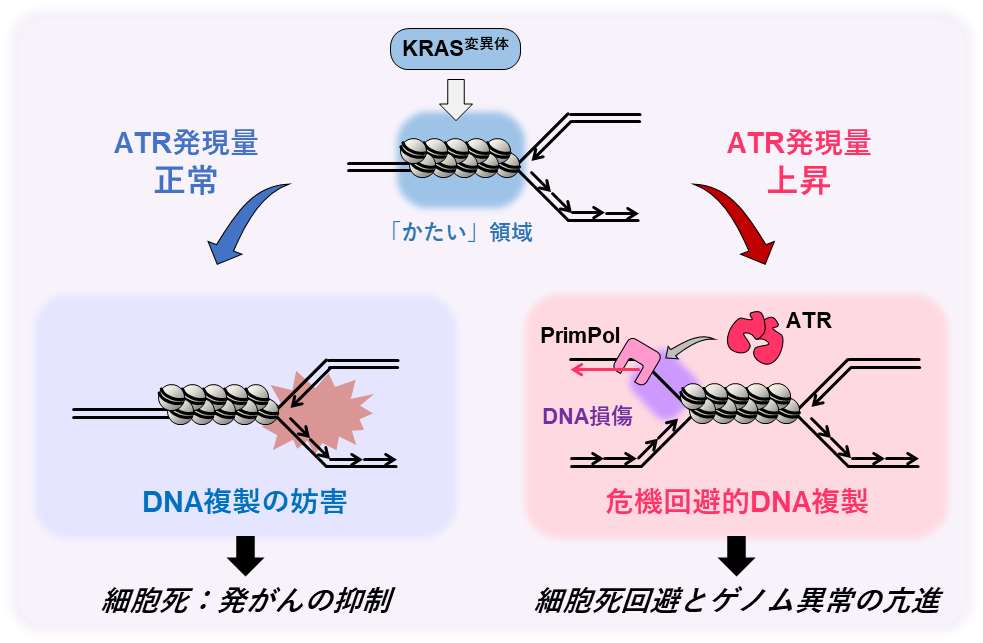
図6. 本研究概要図
本研究により、変異型KRASの発現に応答した、細胞の生存を保証しようとする危機回避的な複製の結果として、がんの発生・悪性化の原因となるゲノム異常が生じる仕組みの一端が明らかとなりました(図6)。
展望
日本人において、肺腺がん症例の約10%でKRAS遺伝子に変異が見つかります。近年、KRAS変異体に対する分子標的薬が開発されたものの、その対象は一部の変異のみに限られており、KRAS変異がんに対する有効な治療法は未だ確立されていません。本研究から得られた知見は、KRAS変異がんに対して危機回避的な複製の阻害を目的とした治療戦略が有効である可能性を示唆しており、また将来的には発がん初期の進展を抑止する早期診断・治療・予防法の創出が期待されます。
論文情報
雑誌名
Nature Communications
タイトル
An ATR-PrimPol pathway confers tolerance to oncogenic KRAS-induced and heterochromatin-associated replication stress
著者
Taichi Igarashi, Marianne Mazevet, Takaaki Yasuhara, Kimiyoshi Yano, Akifumi Mochizuki, Makoto Nishino, Tatsuya Yoshida, Yukihiro Yoshida, Nobuhiko Takamatsu, Akihide Yoshimi, Kouya Shiraishi, Hidehito Horinouchi, Takashi Kohno, Ryuji Hamamoto, Jun Adachi, Lee Zou and Bunsyo Shiotani
DOI
10.1038/s41467-023-40578-2
掲載日
2023年8月17日
URL
https://www.nature.com/articles/s41467-023-40578-2(外部サイトにリンクします)
研究費
- 日本学術振興会 科学研究費補助金(18KK0235 and 18H03378)
- 国立がん研究センター研究開発費(29-Seeds-4)
- 高松宮妃癌研究基金(17-24912)
- 科学技術振興機構 CREST (JPMJCR1689), AIP加速PRISM研究 (JPMJCR18Y4)
発表者
- 国立がん研究センター研究所
ゲノムストレス応答学ユニット 五十嵐太一(筆頭著者)、Marianne Mazevet、矢野公義、塩谷文章(責任著者)
がんRNA研究分野 吉見昭秀
ゲノム生物学研究分野 望月晶史、西野誠、白石航也、河野隆志
医療AI研究開発分野 浜本隆二 - 国立がん研究センター中央病院
呼吸器内科 吉田達哉、堀之内秀仁
呼吸器外科 吉田幸弘 - 京都大学大学院
生命科学研究科 安原崇哲 - 北里大学大学院 理学研究科
五十嵐太一
理学部 生物科学科 分子生物学講座 高松信彦(研究当時) - 医薬基盤・健康・栄養研究所
プロテオームリサーチプロジェクト 足立淳 - Duke University
Department of Pharmacology and Cancer Biology Lee Zou
用語解説
注1 KRAS遺伝子変異体
KRAS遺伝子は、ヒト12番染色体にコードされた遺伝子であり、転写産物のKRASタンパク質は、細胞周期やRNA転写の制御などを担う上流因子である。KRASタンパク質にGTPが結合することで活性化状態となるが、12番目のアミノ酸であるグリシンがバリンに置換された変異体(G12V)などは制御を逸脱した恒常的な活性を示し、発がんを推し進める原動力となる。
注2 クロマチン
DNAとタンパク質から成る高次複合体。ヒトをはじめとする真核生物においては、ヒストンというタンパク質にDNAが約2周分巻き付き、ヌクレオソームを構成する。このヌクレオソーム同士が、さらに高度に相互作用し、凝縮したものをクロマチンと呼ぶ。
注3 ヘテロクロマチン
クロマチンは動的に制御されることが知られている。DNAとヒストンが、それぞれ様々に修飾されることで、その相互作用の強度が調節され、クロマチンの凝縮の程度が変化する。特に、ヒストンの特定部位(H3K9またはH3K27)になされるメチル化修飾は、DNAとヒストンの相互作用を強め、クロマチンをより強固に凝縮させる。この強固に凝縮した構造、またはその領域を、ヘテロクロマチンと呼ぶ。
注4 DNA複製ストレス
がん遺伝子の発現や、薬剤処理により、DNA複製の現場はさまざまな妨害を受ける。こうしたDNA複製が速やかに、適切に行えない状態を総称して、DNA複製ストレスと呼ぶ。このDNA複製ストレスが継続することで、一本鎖DNAの露出や、二本鎖DNAの切断が生じる。
注5 DNA修復機構
細胞がDNA損傷を修復するためのシステム。紫外線や化学物質などによる損傷や誤った複製によるエラーを検知し、修復する役割を果たす。修復過程では、DNA修復タンパク質が働き、損傷した部分を切り取ったり、正しい塩基を挿入したりして正確なDNA情報を回復させる。これによって、細胞は遺伝情報の保全を図り、がんの発生を予防する。
注6 PrimPol
細胞が複製ストレスに曝された状況下においてのみ活性化される、特殊な複製酵素。合成の開始地点を決定するプライマーの合成機能(Primase)と、合成を伸長・継続する機能(Polymerase)の2つを有する。Primase-Polymeraseの略称。
注7 米国TCGAデータベース
米国で蓄積された大規模ながんのデータベース。臨床由来のがん組織について、ゲノム解析やRNA発現量解析を行い、それらに喫煙歴や治療予後が紐づいたデータを一般に公開している。
注8 国立がん研究センターPRISMプロジェクト
国立がん研究センターは、内閣府主導官民研究開発投資拡大プログラム(PRISM) 「創薬ターゲット探索プラットフォームの構築」に2018年より参画し、AI研究開発を志向した世界最大規模の肺がん統合データベースの構築や、創薬標的探索用のAI解析プラットフォームの開発に取り組んだ。
お問い合わせ先
研究に関するお問い合わせ
国立研究開発法人国立がん研究センター
研究所・ゲノムストレス応答学ユニット
ユニット長 塩谷文章
電話番号:03-3547-5201(内線3681)
Eメール:bshiotan●ncc.go.jp
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
電話番号:03-3542-2511(代表)
Eメール:ncc-admin●ncc.go.jp
