SCRUM-Japan GOZILAプロジェクト、4000例超の大規模研究から、がん個別化医療による生存期間の延長を確認
―Nature Medicine誌で発表―
2024年9月17日
国立研究開発法人国立がん研究センター
発表のポイント
- SCRUM-Japan GOZILAプロジェクト注1に参加された4,037名の進行がん患者さんのリキッドバイオプシー(血液を用いてがんの遺伝子情報を調べる検査)の結果と治療効果を調べました。
- 24%の患者さんが、リキッドバイオプシーの結果に基づいて、その方に合った標的治療を受けることができました。
- リキッドバイオプシーの結果に基づいて治療を受けた患者さんは、そうでない患者さんと比べて、約2倍長く生存できることが明らかになりました。
- この研究で、リキッドバイオプシーを用いたがんの個別化治療が、患者さんの生存期間を延ばすのに役立つことが示されました。
- この研究結果は、リキッドバイオプシーを使ったがん治療の進歩につながり、より多くの患者さんの治療成績を向上させることが期待されます。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)東病院(病院長:土井 俊彦、千葉県柏市)の吉野 孝之副院長(国立がん研究センター東病院)らの研究グループは、SCRUM-Japan GOZILAプロジェクトに参加された4,037名の進行がん患者さんを対象に、リキッドバイオプシーに基づく個別化治療の効果を調査しました。
この研究では、参加者の24%が、リキッドバイオプシーの結果に基づいて、その方に合った標的治療(個別化治療)を受けることができました。さらに重要な発見として、リキッドバイオプシーに基づいて標的治療を受けた患者さんは、そうでない患者さんと比べて、生存期間が約2倍長くなることが明らかになりました。
この研究結果により、リキッドバイオプシーを用いたがんの個別化治療が、患者さんの生存期間を延ばすのに役立つことが科学的に示されました。本研究成果は、「Nature Medicine」(ロンドン時間2024年9月16日10時付)に掲載されました。
背景
がん治療において、患者さん一人ひとりの遺伝子情報に基づいたがん個別化医療が近年注目されています。このがん個別化医療を実現する手法の一つとして、血液検査で腫瘍のDNAを調べるリキッドバイオプシーが期待されています。
リキッドバイオプシーは、従来の組織生検と比べて、患者さんの負担が少なく、繰り返し検査が可能である、体の色々な場所にあるがんの特徴を同時に調べられるという利点があります。しかし、これまでこのリキッドバイオプシーを使った治療が、実際に患者さんの役に立つのかどうかは、まだはっきりとわかっていませんでした。特に、この方法で治療を選んだ場合に、患者さんがどのくらい長く生きられるようになるのかについては、十分な証拠がありませんでした。
国立がん研究センター東病院が推進する産学連携がんゲノムスクリーニングプロジェクトSCRUM-Japan MONSTAR-SCREENの一部として開始したSCRUM-Japan GOZILAプロジェクトは、リキッドバイオプシーを使って、できるだけ多くの患者さんに適切な治療を届けることを目指し、2018年から多くの患者さんの協力を得て進められてきました。
そこで今回、SCRUM-Japan GOZILAプロジェクトで行われた治療の効果を調べました。この調査を通じて、身体への負担が少ない液性検体(血漿や尿など)を利用するリキッドバイオプシー(遺伝子解析)を使って選んだ治療(個別化治療)が、実際に患者さんの役に立っているかどうかを確認しました。
研究の方法・成果
本研究では、SCRUM-Japan GOZILAプロジェクトに参加した4,037名の進行がん患者さんを対象に、リキッドバイオプシーに基づく個別化治療の効果を調査しました。
まず、患者さんから採取した血液サンプルを用いてリキッドバイオプシーを実施し、がんの遺伝子情報(バイオマーカー)を調べました。リキッドバイオプシーには、血液検体を用いた包括的がんゲノムプロファイリングGuardant360® CDx がんゲノムプロファイル(がん遺伝子パネル検査)を用い、がんに関連する74個の遺伝子を分析しました。次に、リキッドバイオプシーの結果に基づいて、患者さんに適した標的治療を選択しました。これにより、従来の方法では見つけられなかった治療の選択肢を提供できる可能性が広がりました。そして、治療を受けた患者さんの経過を追跡し、治療効果や生存期間を詳細に分析しました。
研究の結果、参加者の24%が、リキッドバイオプシーの結果に基づいて、その方に適合した標的治療を受けることができました(図1)。これは、リキッドバイオプシーが多くの患者さんに新たな治療の機会を提供できることを示しています。
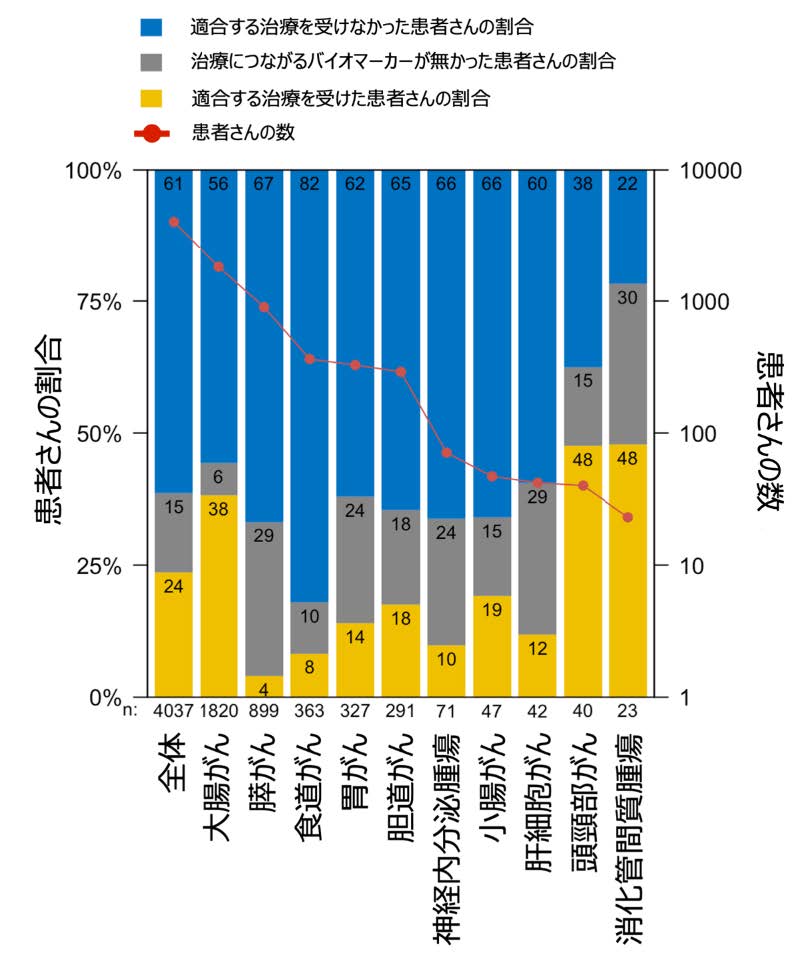
さらに重要な発見として、リキッドバイオプシーに基づいて標的治療を受けた患者さんは、そうでない患者さんと比べて、生存期間が約2倍長くなることが明らかになりました。具体的には、標的治療を受けた患者さんの生存期間の中央値は18.6か月であったのに対し、そうでない患者さんは9.9か月でした(ハザード比0.54、図2)。この結果は、リキッドバイオプシーを用いた個別化治療が、患者さんの生存期間を大幅に延ばす可能性があることを示しています。また、治療につながるバイオマーカーが見つからなかった患者さん(生存期間中央値:16.8か月)もバイオマーカーがあったにも関わらず適合する治療を受けなかった患者さんより生存期間が長いことが分かりました(ハザード比0.60、図2)。この結果は、遺伝子の変化が時に治療の抵抗性に関わることを考えると、バイオマーカーが無かった患者さんはそのような治療抵抗性に関わる遺伝子の変化も無かったことが長い生存期間につながっている可能性を示唆しています。また、一部の患者さんでは血液内に腫瘍DNAが出ておらずリキッドバイオプシーでバイオマーカーが見つけられない場合がありますが、そのような場合も生存期間が長いことが知られています。
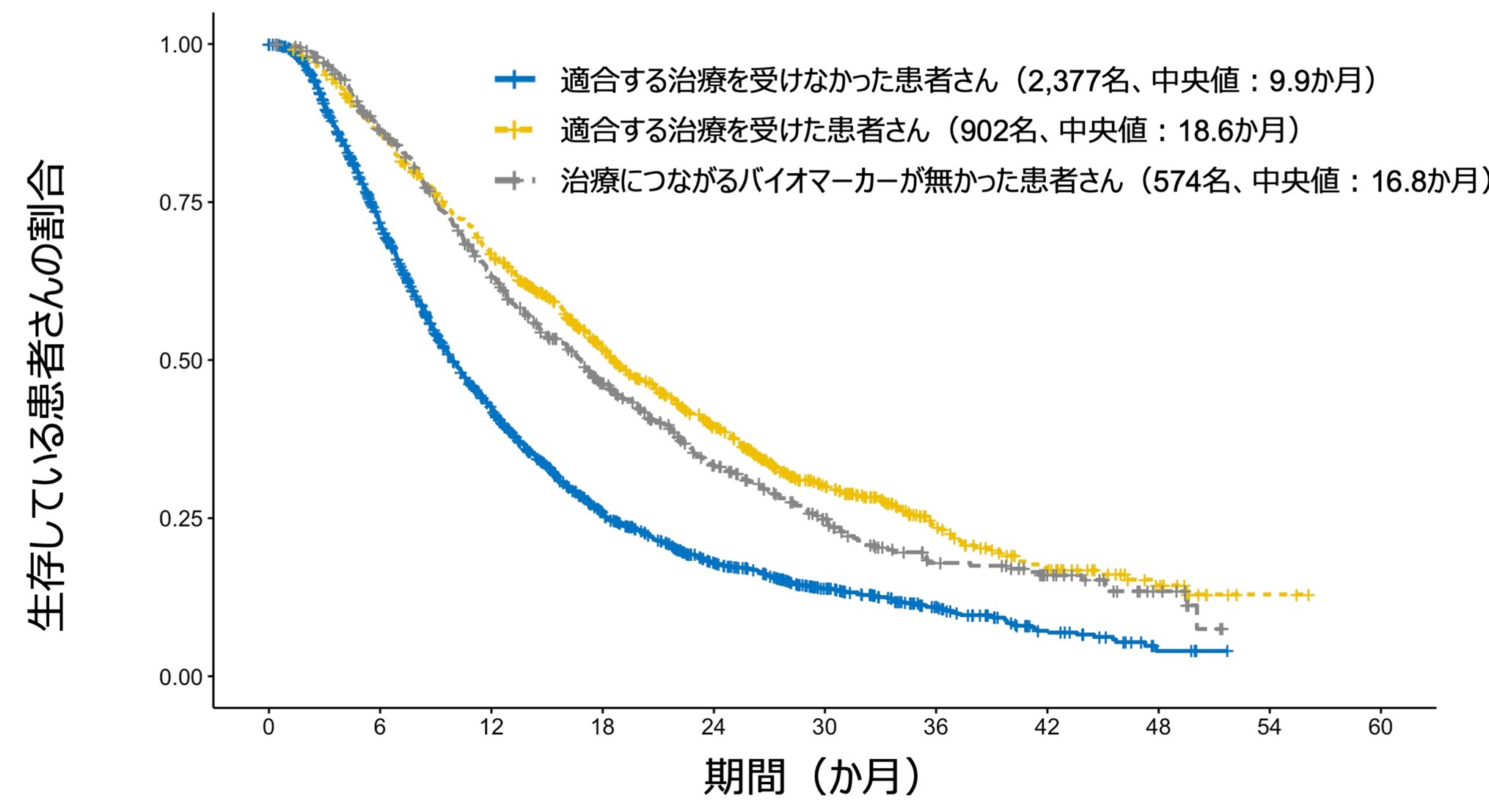
図2: リキッドバイオプシーに基づく標的治療と全生存期間
また、本研究ではリキッドバイオプシーで見つかったバイオマーカーの特徴も詳しく分析しました。その結果、遺伝子変異のクローナリティ(がん細胞全体に占める変異を持つ細胞の割合)や補正血漿コピー数(血液中のがん由来のDNA量で補正した遺伝子の血漿コピー数)が高い症例で治療効果がより高いことが分かりました(図3)。この発見は、将来的により精密な治療選択につながる可能性があります。
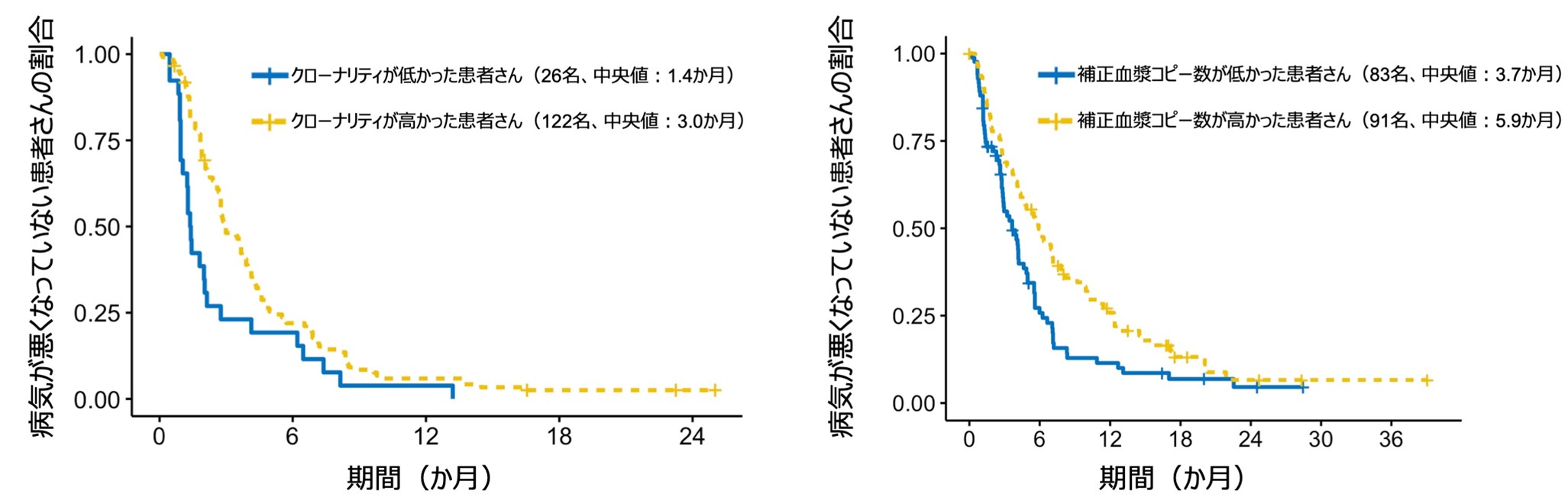
図3:治療標的となったバイオマーカーのクローナリティや補正血漿コピー数と無増悪生存期間
これらの結果は、リキッドバイオプシーを用いたがんの個別化治療が、患者さんの生存期間を延ばすのに役立つことを科学的に示しています。本研究は、リキッドバイオプシーに基づくがん個別化治療の生存期間延長効果を様々ながんで大規模に示した初めての研究であり、今後のがん治療の進歩に大きく貢献することが期待されます。
展望
本研究の成果は、がん治療のパラダイムシフトをもたらす可能性を秘めています。リキッドバイオプシーを用いたがん個別化治療の有効性が科学的に示されたことで、今後のがん医療の方向性が示唆されました。
まず、リキッドバイオプシーの臨床応用がさらに広がることが期待されます。本技術の有用性が確立されれば、より多くの患者さんに最適化された個別化治療を提供できる可能性が高まります。
また、本研究で示唆されたバイオマーカーの特徴(クローナリティや補正血漿コピー数)と治療効果の関連性について、さらなる研究が進めば、より精密な治療効果の予測が可能になるかもしれません。
一方で、いくつかの課題もあります。例えば、リキッドバイオプシーの検査コストの低減や、検査結果の解釈に関する医療従事者の教育、保険適用の拡大などが重要な課題となるでしょう。
SCRUM-Japan MONSTAR-SCREENプロジェクトでは、新たな大規模研究「MONSTAR-SCREEN-3」を計画しています。この研究では、対象を進行固形がんの患者さんだけでなく、治癒切除が可能な早期の固形がんの患者さんや血液腫瘍(血液がん)の患者さんにも広げ、リキッドバイオプシーを含めた最先端のマルチオミックス解析注2を行う予定です。今後も世界最先端の解析を活用し、世界中のがん患者さんとそのご家族に有効な治療法を届けられるよう、がん個別化医療の発展に全力で取り組んでまいります。
論文情報
雑誌名
Nature Medicine
タイトル
Targeted therapy guided by circulating tumor DNA analysis in advanced gastrointestinal tumors: SCRUM-Japan GOZILA
著者
Yoshiaki Nakamura, Hiroshi Ozaki, Makoto Ueno, Yoshito Komatsu, Satoshi Yuki, Taito Esaki, Hiroya Taniguchi, Yu Sunakawa, Kensei Yamaguchi, Ken Kato, Tadamichi Denda, Tomohiro Nishina, Naoki Takahashi, Taroh Satoh, Hisateru Yasui, Hironaga Satake, Eiji Oki, Takeshi Kato, Takashi Ohta, Nobuhisa Matsuhashi, Masahiro Goto, Naohiro Okano, Koushiro Ohtsubo, Kentaro Yamazaki, Riu Yamashita, Naoko Iida, Mihoko Yuasa, Hideaki Bando, Takayuki Yoshino*
(*責任著者)
DOI
10.1038/s41591-024-03244-8
掲載日
2024年9月16日10時(ロンドン時間)
URL
https://www.nature.com/articles/s41591-024-03244-8(外部サイトにリンクします)
研究費
研究費名(支援先)
国立がん研究センター
研究事業名
国立がん研究センター研究開発費
研究課題名
全エキソーム・ゲノム、マルチオミックス解析の臨床応用基盤構築及び人材育成に関する研究
研究代表者名
吉野孝之
課題番号
2021-A-6
直近のSCRUM-Japanの研究については、以下のプレスリリースもご参照ください。
- 8月6日付プレスリリース「リキッドバイオプシーによりHER2遺伝子増幅が認められた固形がんに対するトラスツズマブ デルクステカンの臓器横断的な有効性を確認―産学連携SCRUM-Japan MONSTARプロジェクトの成果を米国臨床腫瘍学会旗艦誌「Journal of Clinical Oncology」に論文発表―」
https://www.ncc.go.jp/jp/information/pr_release/2024/0806/index.html - 7月19日付プレスリリース「世界最大規模の統合解析により、がん個別化医療による生存期間の延長を確認―産学連携SCRUM-Japan MONSTARプロジェクトの成果を米国癌学会旗艦誌「Cancer Discovery」に論文発表―」
http://www.ncc.go.jp/jp/information/pr_release/2024/0719_1/index.html - 7月19日付プレスリリース「抗EGFR抗体薬の新たな治療標的の可能性を発見-薬物療法後にRAS遺伝子変異が野生型に変化した大腸がん患者さんに新たな治療選択肢の可能性-」
https://www.ncc.go.jp/jp/information/pr_release/2024/0719_2/index.html
用語解説
注1 SCRUM-Japan GOZILAプロジェクト
SCRUM-Japanは、2013年に開始した肺がん患者さんを対象として、がんの遺伝子変化を調べるLC-SCRUM-Japan(現:LC-SCRUM-Asia)と、2014年に開始した消化器がん患者さんを対象としてがんの遺伝子解析を行うGI-SCREEN-Japan(現:MONSTAR-SCREEN)が統合した産学連携がんゲノムスクリーニングプロジェクトです。2018年からSCRUM-Japan MONSTAR-SCREENプロジェクトの一部として開始したGOZILAプロジェクトは、消化器がんをはじめとしたがん患者さんに対して、リキッドバイオプシーを用いた包括的がんゲノムプロファイリングを実施しています。
注2 マルチオミックス解析
遺伝子解析(ゲノミクス: Genomics)・RNA解析(トランスクリプトミクス: Transcriptomics)・蛋白質解析・(プロテオミクス: Proteomics)・代謝物資解析(メタボロミクス:Metabolomics)等をすべて一括して分析する手法で、“ミクス (-omics)”は総合的解析を意味します。
お問い合わせ先
研究に関する問い合わせ
国立研究開発法人国立がん研究センター東病院
SCRUM-Japan事務局
電話番号: 04-7133-1111(代表)
Eメール:scrum_office@east.ncc.go.jp
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室(柏キャンパス)
電話番号:04-7133-1111(代表)
Eメール:ncc-admin●ncc.go.jp
