希少かつ難治性がんである消化器神経内分泌がんの新たな標準治療の確立を目指す全国10施設で免疫チェックポイント阻害薬上乗せ効果を検証する第III相医師主導治験開始
2024年9月19日
国立研究開発法人国立がん研究センター
日本臨床腫瘍研究グループ
発表のポイント
- 国立がん研究センター中央病院が支援する日本臨床腫瘍研究グループ(JCOG)肝胆膵グループは、全国10施設で消化器神経内分泌がんの患者さんに対する標準治療であるエトポシド+カルボプラチン療法に免疫チェックポイント阻害薬であるデュルバルマブの上乗せ効果を検証する第III相医師主導治験を開始しました。
- 消化器神経内分泌がんは、年間人口10万人あたり3から5人が発症する希少がんです。予後が非常に厳しく、さらなる治療開発が必要な難治性がんと考えられています。
- 本研究では、消化器神経内分泌がんが小細胞肺がんと比較的類似しているという性質に着目し、すでに小細胞肺がんで有効性が確認されている、免疫チェックポイント阻害薬の上乗せ効果を評価します。
- 本研究は、患者さんの数が少なく、治療開発の進みにくい消化器神経内分泌がんに対して、新たな治療法を評価し、標準治療の確立を目指すものです。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)中央病院(病院長:瀬戸 泰之)が、中央支援機構(データセンター/運営事務局)を担い支援する日本臨床腫瘍研究グループ(JCOG(ジェイコグ):Japan Clinical Oncology Group)では、科学的証拠に基づいて患者さんに第一選択として推奨すべき治療である標準治療注1や診断方法等の最善の医療を確立するため、専門別研究グループで全国規模の多施設共同臨床試験を実施しています。
この度、JCOG肝胆膵グループでは、進行・再発の消化器神経内分泌がん(NEC(ネック): Neuroendocrine carcinoma)のより効果的な標準治療を確立するため、現在の一次治療注2の標準治療である化学療法のエトポシド+カルボプラチン(EC)療法に免疫チェックポイント阻害薬注3のデュルバルマブ注4を上乗せで投与し、その効果を検討する多施設共同第III相医師主導治験注5(JCOG2107E、試験略称:CELEBRATE)を開始しました。本試験の結果を踏まえ、国内での薬事承認を目指します。
消化器神経内分泌がんは消化管や肝臓、胆嚢、膵臓など消化器にある神経内分泌細胞のがんで、増殖速度が速く早期に転移・再発を起こしやすい希少かつ難治性のがんです。悪性度が高いものの、その希少さゆえに製薬企業だけでの治療開発が進みにくいため、本試験は企業の協力のもと医師主導治験で実施します。
本試験の対象は、進行・再発の消化器神経内分泌がんの患者さんで、北海道大学病院、国立がん研究センター東病院、国立がん研究センター中央病院、がん研究会有明病院、神奈川県立がんセンター、金沢大学附属病院、愛知県がんセンター、大阪国際がんセンター、兵庫県立がんセンター、九州大学病院の全国10施設で実施します。
医薬品および研究資金は、この研究の趣旨に賛同いただいたアストラゼネカ株式会社よりデュルバルマブの無償提供および研究資金の提供を受けて実施します。
消化器神経内分泌がんについて
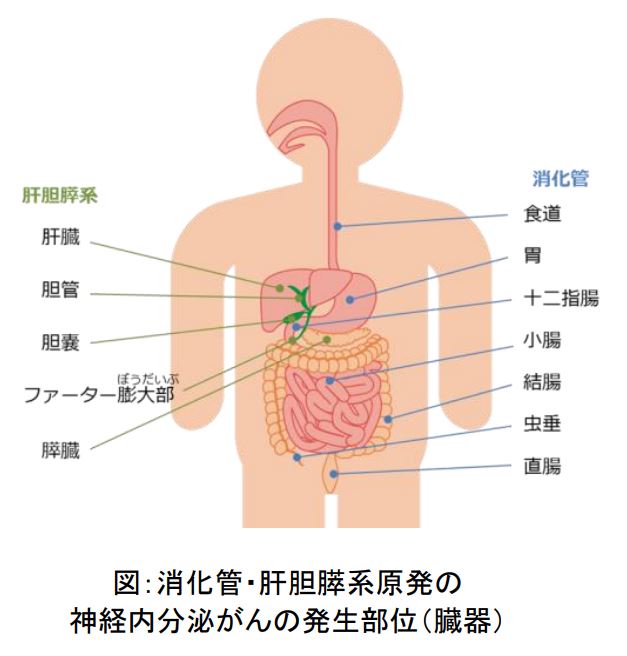
神経内分泌がんは、人の体に広く分布しホルモンやペプチドなどを産生する神経内分泌細胞から発生するがんでさまざまな臓器に発生します。そのうち、消化管や肝臓、胆嚢、膵臓から発生するものが、消化器神経内分泌がんです(図)。
神経内分泌がんは、増殖速度が速く早期に転移を起こしやすいため手術で腫瘍を取り除くことが難しく、多くの場合には、病状制御を目的とした化学療法のエトポシド/シスプラチン(EP)療法またはイリノテカン/シスプラチン(IP)療法が行われます。しかし、神経内分泌がんの予後は非常に厳しく、さらに有効な治療が求められています。
本試験は、食道、胃、十二指腸、小腸、結腸、虫垂、直腸、肝臓、ファーター膨大部、胆嚢、膵臓のいずれかに発生した消化管・肝胆膵系原発の消化器神経内分泌がんの患者さんを対象とします。
背景
JCOGではこれまでに、消化器神経内分泌がんに対する治療開発を行ってきました。JCOGの3グループ(肝胆膵、胃がん、食道がんグループ)が合同で実施したJCOG1213「消化管・肝胆膵原発の切除不能・再発神経内分泌癌を対象としたエトポシド/シスプラチン(EP)療法とイリノテカン/シスプラチン(IP)療法のランダム化比較試験」(注)では、EP療法とIP療法はいずれも有効で、両者の効果に明確な差がないことが示され、消化器神経内分泌がんに対する標準治療はEP療法、またはIP療法として確立しました。EP療法のシスプラチンの代わりに、カルボプラチンを用いるエトポシド+カルボプラチン(EC)療法も同様に消化器神経内分泌がんの一次治療の標準治療と考えられています。しかし、消化器神経内分泌がんにおいてEP療法やIP療法、EC療法の治療効果は十分ではなく、さらなる治療開発が必要です。
これまで消化器神経内分泌がんの治療開発は、がんとしての性質が比較的似ている小細胞肺がんの治療を参考にしてきており、小細胞肺がんでのEP療法やEC療法に免疫チェックポイント阻害薬のデュルバルマブの上乗せ効果が示されました。また、デュルバルマブと同様の作用機序であるアテゾリズマブについてもEC療法への上乗せ効果が示されています。そのため、現在EPまたはEC+デュルバルマブ療法や、EC+アテゾリズマブ療法は小細胞肺がんの標準治療と位置付けられています。
そこで、今回消化器神経内分泌がんに対する一次治療の標準治療であるEC療法へのデュルバルマブの上乗せ効果を検証し消化器神経内分泌がんに対する新たな標準治療を確立することを目的とした医師主導第III相治験を開始しました。
注:2022年8月24日プレスリリースをご参照ください。
https://www.ncc.go.jp/jp/information/pr_release/2022/0824/index.html
研究方法
試験名
切除不能・再発消化器(消化管・肝胆膵)神経内分泌癌(NEC)を対象としたエトポシド+カルボプラチン±デュルバルマブ療法のランダム化比較第III相医師主導治験:JCOG2107E(CELEBRATE)
対象となる患者さん
- 組織の病理検査で神経内分泌がんと診断されている方
- 食道、胃、十二指腸、小腸、結腸、虫垂、直腸、肝臓、ファーター膨大部・胆嚢・膵臓のいずれかに発生している方
- 切除不能または再発と診断されている方
- 神経内分泌がんに対し全身化学療法、放射線療法を受けていない方
- プラチナ系抗悪性腫瘍薬、免疫チェックポイント阻害薬のいずれの治療も受けていない方
- 神経内分泌がんに関連する症状がコントロールされている方
- 年齢が18歳以上75歳以下の方
- 食事摂取が可能な方
- 治験参加について患者本人より文書による同意が得られる方
上記の患者選択規準は概要であり記載した以外にも対象患者さんとなるための規準があります。上記に該当していてもこの治験に参加できないことがありますので、ご了承ください。
募集期間
2023年11月より3年間(予定)
予定人数
74人
研究シェーマ
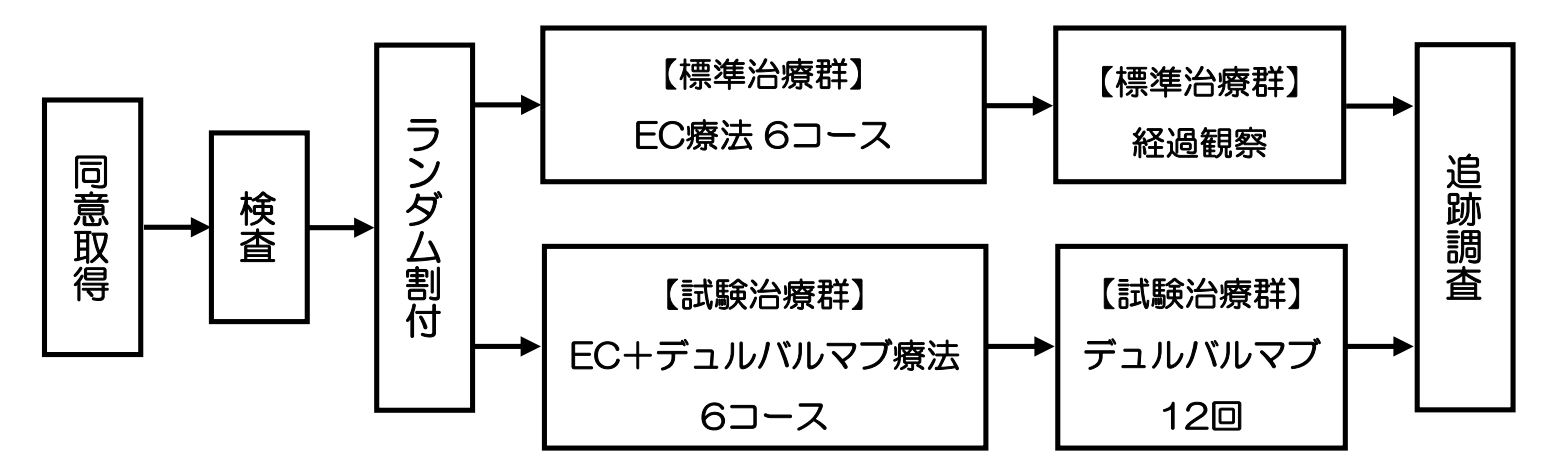
対象となる患者さんを有効性や安全性などを公平に比べるために臨床試験で広く用いられる「ランダム割付」を行い、以下のどちらかの群の治療をうけていただくことになります。
【標準治療群】EC療法6コースの後、経過観察
【試験治療群】EC療法+デュルバルマブ療法6コースの後、デュルバルマブ単剤の維持療法を実施
参加施設一覧
- 北海道大学病院
- 国立がん研究センター東病院
- 国立がん研究センター中央病院
- がん研有明病院
- 神奈川県立がんセンター
- 金沢大学附属病院
- 愛知県がんセンター
- 大阪国際がんセンター
- 兵庫県立がんセンター
- 九州大学病院
研究代表者
森實 千種(国立がん研究センター中央病院 肝胆膵内科 医長)
臨床研究実施計画・研究概要公開システム
jRCT番号:jRCT2031230456
本治験の詳細は、以下よりご確認ください。
臨床研究実施計画・研究概要公開システム
URL:https://jrct.niph.go.jp/latest-detail/jRCT2031230456(外部サイトにリンクします)
用語解説
(注1)標準治療
標準治療とは、科学的根拠に基づいた観点で、現在利用できる最良の治療であることが示され、ある状態の一般的な患者さんに行われることが推奨される治療をいいます。
(注2)一次治療
手術不可能ながんに対して抗がん剤治療する場合、初めの抗がん剤治療を一次治療と呼びます。
(注3)免疫チェックポイント阻害薬
体の中に異物(ウイルスや細菌)の侵入を防ぐことや排除して体を守るシステムを免疫と呼び、人の体には、細菌やウイルスなどの外部からの異物やがん細胞を認識して、これを排除しようとする免疫機能が備わっています。免疫機能では、免疫細胞と呼ばれる血液中の白血球などが中心的な役割を果たします。このうち「T細胞(Tリンパ球)」には、がん細胞を攻撃する性質があり、免疫療法で重要な役割を担います。このT細胞が働かないようにブレーキがかかることで、がんの増悪が起こります。こうした仕組みを免疫チェックポイント機構といいます。免疫チェックポイント阻害薬は、T細胞に対するブレーキを解除することでがん細胞のコントロールをする薬剤です。
(注4)デュルバルマブ
デュルバルマブは免疫チェックポイント機構にかかわるPD-L1というタンパク質を標的とした抗体薬(抗PD-L1抗体薬)で、免疫チェックポイント阻害薬に分類されます。がん細胞表面に存在する「PD-L1」というタンパク質がリンパ球表面の「PD-1」というタンパク質と結合すると、リンパ球ががん抗原を認識しているにもかかわらず、がん細胞を攻撃できなくなります(がん細胞がリンパ球の機能にブレーキをかけている)。デュルバルマブはPD-1とPD-L1の結合を阻害し、T細胞の働きを回復させることで、がんに対して有効であると考えられています。
(注5)医師主導治験
新しい薬が承認され、保険で使えるようになるためには新薬の臨床開発(治験)が必要です。欧米で標準的な医薬品等でありながら、国内では不採算等のため導入されていない医薬品等について、製薬企業主導でなく、製薬企業の協力を得て、医師自らが治験を行うことを医師主導治験といいます。
問い合わせ先
患者さんからのお問い合わせ
国立研究開発法人国立がん研究センター
中央病院 がん相談支援センター
電話番号:03-3547-5293(平日9時から12時、13時から16時)
医師主導治験に関する問い合わせ
治験調整事務局
IQVIAサービシーズ ジャパン合同株式会社
Eメール:JCOG2107E_StudyOffice●iqvia.com
日本臨床腫瘍研究グループ(JCOG)に関するお問い合わせ
国立研究開発法人国立がん研究センター中央病院
臨床研究支援部門 研究企画推進部 多施設研究支援室
Eメール:webmaster●ml.jcog.jp
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
電話番号:03-3542-2511(代表)
Eメール:ncc-admin●ncc.go.jp
関連ファイル
関連リンク
- 日本臨床腫瘍研究グループ(JCOG:Japan Clinical Oncology Group) (外部サイトにリンクします)
