希少がんである切除不能皮膚血管肉腫でのペムブロリズマブ+レンバチニブ併用療法の第II相医師主導治験開始薬物療法の選択肢を増やし治癒率向上を目指す
2025年3月5日
国立研究開発法人国立がん研究センター
発表のポイント
- 希少がんである皮膚血管肉腫は、患者さんの数が少なく、これまで有効な治療法が十分に開発されてきませんでした。しかしながら、高齢の方に発症する傾向が高いがん種であることと、半数は頭皮に発生する悪性腫瘍であり、欧米と比べて髪の黒い日本人では発見が遅れる傾向があるため、新規治療開発が求められています。
- 切除不能な皮膚血管肉腫の患者さんを対象に、他のがん種で効果が見られた免疫チェックポイント阻害薬のペムブロリズマブと、チロシンキナーゼ阻害薬のレンバチニブを組み合わせた薬物療法の第II相医師主導治験を国立がん研究センター中央病院で実施します。
- 皮膚血管肉腫の患者さんへ新たな治療選択肢を提供し、治癒の可能性の向上と、将来の保険適用の際の有用なデータを収集することを目指し実施します。
概要
国立研究開発法人国立がん研究センター(所在地:東京都中央区、理事長:中釜 斉)中央病院(病院長:瀬戸 泰之)は、手術による治癒が期待できない切除不能な皮膚血管肉腫の患者さんを対象とした第II相医師主導治験(NCCH2213試験)を実施します。
皮膚血管肉腫は、血管の内皮細胞のがんが皮膚に生じた悪性度の高い希少がん注1です。その希少さゆえに治療開発が十分に行われておらず、効果的で長期成績が望める手術方法や薬物療法はありません。髪が黒い日本人では病変の発見が遅れがちとなり欧米と比べて進行した状態で発見されることが多く、高齢の方に発症する傾向が高いがんである†1ため、高齢化が進む日本では新規治療開発が求められています。
そこで本医師主導治験では、皮膚血管肉腫の新たな薬物療法を開発することで、治療選択肢を拡大し、治癒の可能性を向上させることを目指します。
本医師主導治験では、切除不能な皮膚血管肉腫の患者さんでの、免疫チェックポイント阻害薬(ペムブロリズマブ)とチロシンキナーゼ阻害薬(レンバチニブ)との組み合わせ治療の有効性および安全性を検討します。本医師主導治験は、MSD株式会社の研究者主導研究支援プログラムによる研究助成金および薬剤提供の一部援助を受けて実施します。
背景
血管の内側の内皮細胞ががん化したものを「血管肉腫」と言います。皮膚血管肉腫は、血管肉腫が皮膚に生じた悪性度の高いがんであり、日本では人口100万人あたり2.5人程度の希少がん注1です†2。その希少さゆえに、これまで有効な治療法が十分に開発されてきませんでした。
皮膚血管肉腫は正確な範囲が分かりにくく効果的な手術方法が定まっていないため手術で完全に切除することが難しく、手術後に再発や転移することも少なくありません。皮膚血管肉腫の半数は頭皮に発生し、高齢の方の頭皮や顔面に外傷をきっかけにできることが多いほか、乳がん、子宮がんなどの手術後の腕や足の浮腫が続く部位や、がん治療のために行った放射線照射部位の皮膚にできることがあります。現状ではがん細胞を死滅または抑制する殺細胞性抗がん薬を用いた薬物療法や放射線治療、その組み合わせによる治療が広く行われていますが長期成績はまだ不十分です。また髪が黒い日本人では頭皮に病変がある場合に発見が遅れがちとなり欧米と比べ進行した状態で発見されることが多いことや、高齢の方に発症する傾向が高いがんであるため、高齢化が進む日本では新規治療開発が求められています。
本医師主導治験ではがん細胞を攻撃する免疫機能のブレーキを解除する抗がん剤である免疫チェックポイント阻害薬のペムブロリズマブ(図1)と、がん組織に栄養を与える血管を新たに作り出すサインの伝達役を阻害する抗がん剤であるチロシンキナーゼ阻害薬のレンバチニブ(図2)との組み合わせによる治療を行います。この併用療法は、子宮体がん†3や腎細胞がん†4の細胞増殖を抑える効果があったとする報告があり、皮膚血管肉腫に対するより有効な治療法となる可能性があります。
しかしながら、ペムブロリズマブとレンバチニブは皮膚血管肉腫に対して承認されていないため、通常の保険診療として使用できません。本医師主導治験に参加されることで、皮膚血管肉腫の患者さんへ、新たな治療選択肢であるペムブロリズマブ+レンバチニブ併用療法を受ける機会を提供し、治癒の可能性を向上させることを目的として実施します。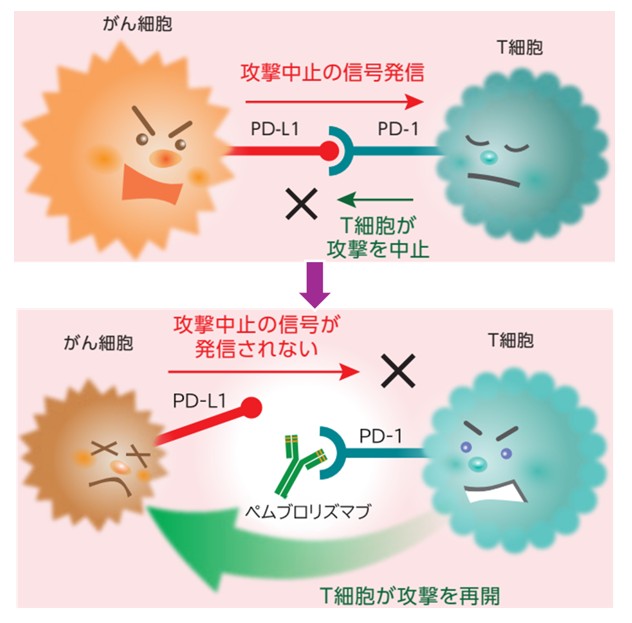
図1 ペムブロリズマブはがん細胞を攻撃するT細胞(免疫細胞)のブレーキを解除する
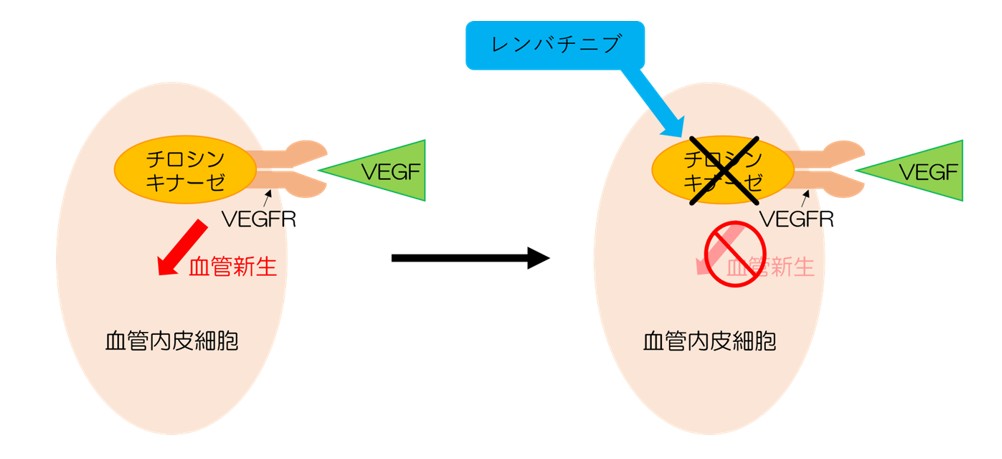
図2 レンバチニブは血管を新たに作り出すサインの伝達役を阻害する
本医師主導治験について
医師主導治験課題名
切除不能皮膚血管肉腫に対するペムブロリズマブ+レンバチニブ併用療法の第II相医師主導治験(NCCH2213試験)
目的
本医師主導治験の主な目的は、ペムブロリズマブとレンバチニブによる併用療法が皮膚血管肉腫に対してどのくらい効果があるか(がんが小さくなるかどうかなど)、安全かどうか(どんな副作用注2があるかなど)を確認することです。
方法
本医師主導治験に登録された患者さん全員に、ペムブロリズマブとレンバチニブによる併用療法を受けていただきます。21日を1コースとしてペムブロリズマブ、レンバチニブを投与します。ペムブロリズマブに対する抗体が患者さんの体内で作られ、ペムブロリズマブが効かなくなったり副作用が出たりする可能性があるため、本医師主導治験の治療は最大35コースまでと定めています。ペムブロリズマブは、各コース1日目に1回(21日間隔で)、静脈内に点滴にて投与します。レンバチニブは、毎日1回、なるべく同じ時間に内服します。
対象となる患者さん(主な規準)
- 組織の病理検査で皮膚血管肉腫と診断されており、切除不能ながん組織のある方
- 免疫チェックポイント阻害薬および血管新生阻害薬による治療を受けたことのない方
- 年齢が18歳以上85歳以下の方
- 血圧が安定しており、直近の血圧値が150/90 mmHg以下の方
- 重篤な心疾患、胃腸疾患、肺疾患、糖尿病、感染症のない方
- 治っていないケガや傷のない方
- 妊娠可能な女性や妊娠可能な女性のパートナーの場合、避妊にご協力いただける方
- 試験参加について、患者さんご本人から文書による同意が得られる方
上記の規準は概要であり、記載した以外にも対象患者さんとなるための規準があります。上記に該当していても、本医師主導治験に参加できない場合がありますので、ご了承ください。
対象人数
本医師主導治験は、合計38人の患者さんにご参加いただくことを目標としています。
評価指標
奏効割合注3、生存期間注4、奏効期間注5、副作用発現割合など
医師主導治験実施医療機関
・国立がん研究センター中央病院
今後、実施医療機関を増やしていく予定です。
医師主導治験調整医師(代表)
緒方 大(国立がん研究センター中央病院 皮膚腫瘍科 医長)
臨床研究実施計画・研究概要公開システム
RCT番号:jRCT2031240448
本医師主導治験の詳細は、以下よりご確認ください。
臨床研究実施計画・研究概要公開システム
URL:https://jrct.mhlw.go.jp/latest-detail/jRCT2031240448(外部サイトにリンクします)
展望
本医師主導治験では、切除不能な皮膚血管肉腫に対してより有効性が高い薬物療法を開発することを目指し、ペムブロリズマブとレンバチニブによる併用療法を、皮膚血管肉腫の治療に熟達した医師のもとで実施します。本医師主導治験は、この併用療法ががん組織の大きさやがんの進行に対して与える影響、この併用療法による体への影響(副作用など)を調べることを目的としています。これらのデータは、現在および将来の患者さんのために役立つと考えています。さらには、将来的に保険適用を検討する際の参考となることを期待しています。
今後、本医師主導治験に参加する医療機関を増やすことにより、より多くの患者さんが本医師主導治験に参加しやすくなるよう、準備を進めています。
研究費
- 研究助成金および薬剤提供者名(支援先):MSD株式会社
研究助成金および薬剤提供事業名:MSD Investigator Initiated Studies Program
研究課題名:The phase II study of pembrolizumab plus lenvatinib for patients with unresectable cutaneous angiosarcoma
研究代表者名:Dai Ogata
- 研究費名(支援先):一般社団法人日本癌治療学会
研究事業名:2023年度がん臨床研究助成プログラム
研究課題名:切除不能皮膚血管肉腫に対するペムブロリズマブ+レンバチニブ併用療法の第II相医師主導医師主導治験
研究代表者名:緒方 大
用語解説
注1 希少がん
人口10万人あたり6例未満の「まれ」な「がん」、数が少ないがゆえに診療・受療上の課題が他に比べて大きいがん種のこと
参考:国立がん研究センター希少がんセンター https://www.ncc.go.jp/jp/rcc/index.html
注2 副作用
薬剤による、期待した効果以外の望ましくない作用
注3 奏効割合
特定の治療を受けた患者さんのうち、治療の効果がみられた患者さんの割合
注4 生存期間
患者さんが臨床試験に登録された日から(原因ががんによるものかどうかに関係なく)亡くなるまでの期間
注5 奏効期間
治療の効果がみられた期間
参考文献
†1 Ogata D, Namikawa K, Nakano E, Fujimori M, Uchitomi Y, Higashi T, et al. Epidemiology of skin cancer based on Japan's National Cancer Registry 2016-2017. Cancer Sci. 2023, 114(7): 2896-2992.
†2 藤澤康弘, 浅越健治, 増澤真実子, 大塚篤司, 内博史, 松下茂人ほか. 皮膚悪性腫瘍診療ガイドライン第3版皮膚血管肉腫診療ガイドライン2021. 日皮会誌 2021; 131(2): 245-277
†3 Makker V, Colombo N, Casado Herráez A, Santin AD, Colomba E, Miller DS, et al. Lenvatinib plus pembrolizumab for advanced endometrial cancer. N Engl J Med 2022; 386(5): 437-448.
†4 Motzer R, Alekseev B, Rha SY, Porta C, Eto M, Powles T, et al. Lenvatinib plus pembrolizumab or everolimus for advanced renal cell carcinoma. N Engl J Med 2021; 384(14): 1289-1300.
お問い合わせ先
患者さんからのお問い合わせ
国立研究開発法人国立がん研究センター
希少がんセンター事務局
電話番号:03-3547-5201(内線 3578)(平日9時~17時)
Eメール:rcc-office●ml.res.ncc.go.jp
研究に関するお問い合わせ
国立研究開発法人国立がん研究センター
中央病院 臨床研究支援部門 研究企画推進部 臨床研究支援室
NCCH2213(PLAS)医師主導医師主導治験調整事務局
Eメール:ncch2213_office●ml.res.ncc.go.jp
広報窓口
国立研究開発法人国立がん研究センター企画戦略局 広報企画室
電話番号:03-3542-2511(代表)
Eメール:ncc-admin●ncc.go.jp
