HER2陽性胃がんに対するTrastuzumab deruxtecanのバイオマーカー研究における奏効例の特徴などを公表
2024年5月20日
国立研究開発法人国立がん研究センター
発表のポイント
- 本研究では、Human epidermal growth factor receptor 2 (HER2) 陽性胃がんに対してTrastuzumab deruxtecan (T-DXd)を投与された患者さんにおける腫瘍検体や血液検体(リキッドバイオプシー)を解析し、HER2の発現や各種遺伝子異常と治療効果との関連を検討するバイオマーカー研究を実施し、奏効例の特徴や抵抗性に関与する機序が示唆されました。
- 腫瘍検体におけるHER2発現が高い患者さんやリキッドバイオプシーによるCirculating tumor DNA (ctDNA)のHER2増幅を認める患者さんで、奏効割合が高い傾向を認めました。
- HER2機能獲得変異は、11% (12例)に検出され、HER2が高発現(免疫組織染色(Immunohistochemistry:IHC 3+)、かつHER2変異陽性例では、8例中7例に奏効を認めました。
- 一方で、ctDNAにおける他の主要なドライバー遺伝子の増幅、特にMET、EGFR、FGFR2が検出された患者さんにおける奏効割合は、比較的低い値でした。
- 治療終了時にはHER2遺伝子増幅検出例の減少や新規のTOP1遺伝子異常が検出された場合、これらが獲得耐性に関わっている可能性が示唆されました。
- 本研究は、T-DXdの有効性や抵抗性に関わるバイオマーカーの意義を示したことが評価され、科学雑誌「Nature Medicine」に掲載されました。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)東病院(病院長:土井 俊彦、千葉県柏市)設楽 紘平 消化管内科長らの研究グループは、HER2陽性胃がん注1におけるT-DXd注2の治療による利益が得られる可能性が高い患者さんを特定するために、日本・韓国で実施されたDESTINY-Gastric01試験注3に参加された患者さんから採取した腫瘍検体やリキッドバイオプシー注4から、血中循環腫瘍DNA(ctDNA)注5を解析し、遺伝子発現や遺伝子異常と治療効果との関連を検討するバイオマーカー注6研究を実施しました。
その結果、治療前のHER2発現が高い場合や、ctDNAのHER2増幅を認める場合に、奏効割合が高い傾向を確認しました。また一部のドライバー遺伝子の存在や、HER2遺伝子増幅の消失、後天的なtopoisomerase I (TOP1)遺伝子異常が抵抗性に関わっている可能性が示されました。
本研究は、T-DXdの有効性や抵抗性に関わるバイオマーカーの意義を示したことが評価され、科学雑誌「Nature Medicine」(英国時間2024年5月14日)に掲載されました。
背景
DESTINY-Gastric01試験は、日本と韓国で実施された非盲検無作為化第II相試験であり、主要コホートでは、HER2 陽性(IHC3+もしくはIHC2+かつin situ hybridization, ISH陽性)切除不能進行・再発胃がん、または胃食道接合部腺がん(以下「胃がん」)患者を対象に、トラスツズマブ デルクステカンと化学療法が比較されました。日本と韓国から187例が登録され、主要評価項目である奏効割合と副次的評価項目である全生存期間の有意な改善を認めました(https://www.nejm.org/doi/10.1056/NEJMoa2004413/)。また、探索コホートではT-DXdのHER2低発現例に対する一定の有効性が確認されました(https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9901967/)。しかし、これらの治験ではどのような患者さんにT-DXdの効果が発揮されやすいか明らかではありませんでした。そこで、本研究グループは腫瘍検体やリキッドバイオプシーを解析し、遺伝子異常と治療効果との関連を検討するバイオマーカー研究を実施しました。
研究成果(方法・結果)または取り組みの詳細
本治験においてT-DXdの投与を受けた患者さん167例のうち、151例でリキッドバイオプシー用のサンプルが採取されました。一方で、治療直前の腫瘍検体は計48例より採取されていました。
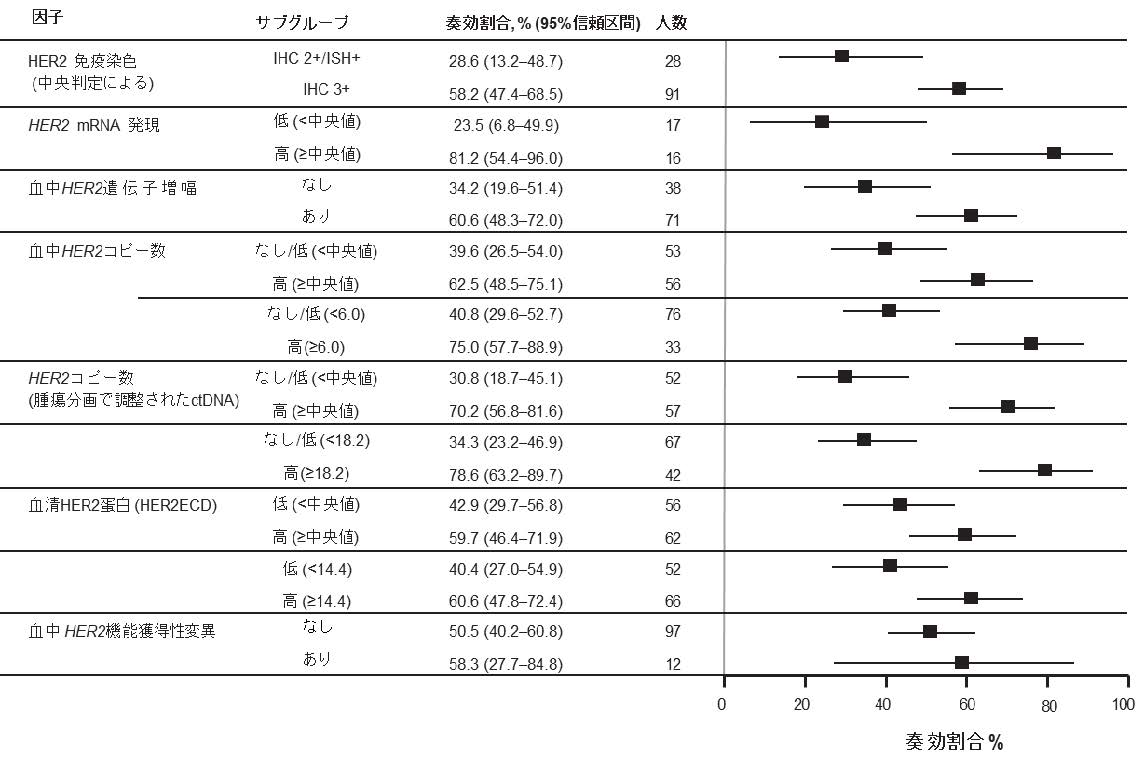
主要コホートにおける治療前のHER2状態(IHC 3+またはIHC 2+/ISH+)、HER2遺伝子(mRNA) 発現、ctDNAにおけるHER2増幅コピー数、および血清HER2蛋白(細胞外ドメイン)値のいずれも高い患者ほど奏効割合が高いという一貫した傾向が示されました(図1)。
HER2 mRNAが高い患者さん(n=16)は、発現が低い(中央値9.72未満と定義)患者さん(n=17)と比較して奏効割合が高い傾向にありました(81.2% vs 23.5%)。同様に、ctDNAにHER2増幅を認める患者さん(n=71)は、増幅を認めない患者さん(n=38)と比較して奏効割合が高い傾向でした(60.6% vs 34.2%)。HER2機能獲得変異は、評価可能例(109例)の11%(12例)に検出され、HER2 IHC 3+かつ遺伝子変異を有する患者の奏効割合は87.5%(8例中7例)でした。
図1. 主要コホートにおけるサブグループ別の奏効割合
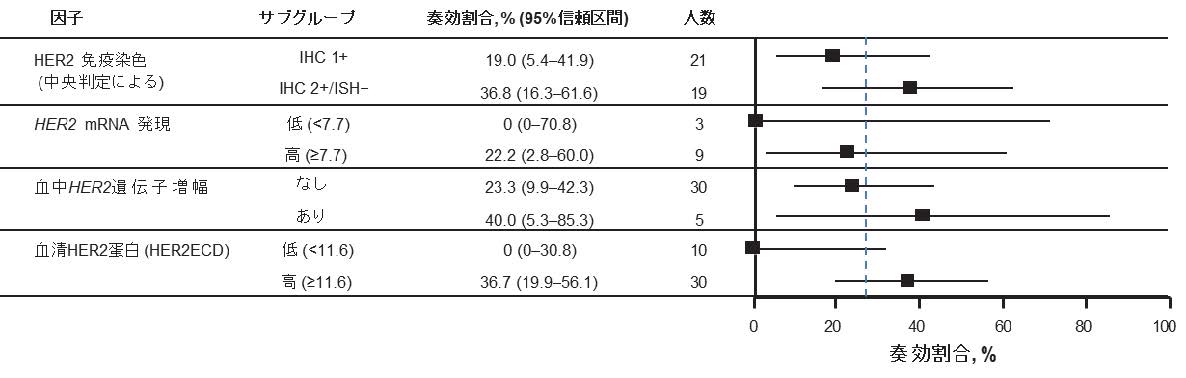
HER2低発現を含む探索的コホートにおいては、治療前の血中HER2細胞外ドメイン値が探索的カットオフ値11.6ng/mL以上の患者さん(n=30)の奏効割合は36.7%であり、カットオフ未満の患者(n=10)の0%と比較して高い傾向でした。生存期間についても同様の傾向が示唆されました (図2)。
図2. 探索コホートにおけるサブグループ別の奏効割合
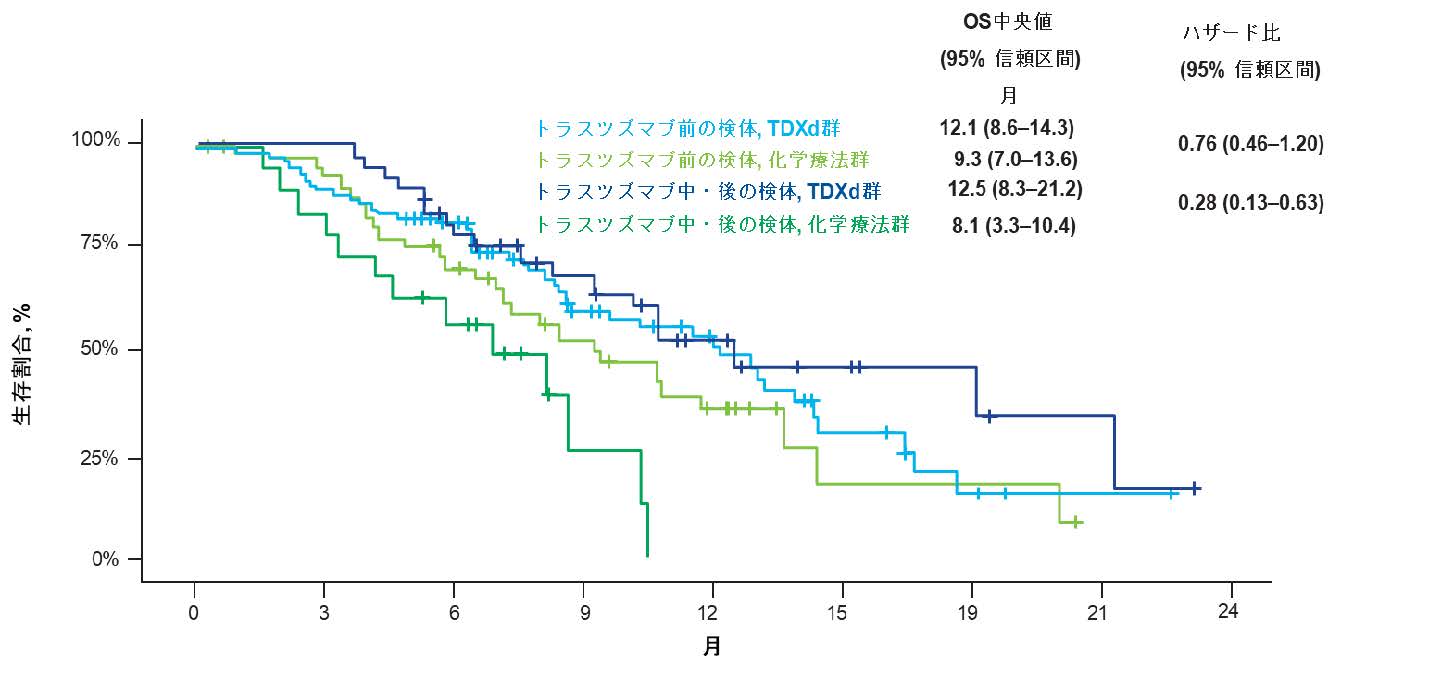
また、T-DXdの有効性は、HER2発現を検討した腫瘍組織の採取されたタイミングにかかわらず一貫して化学療法よりも優れている傾向が確認されました (図3および図4)。
図3. HER2検査のための組織検査のタイミング別の奏効割合
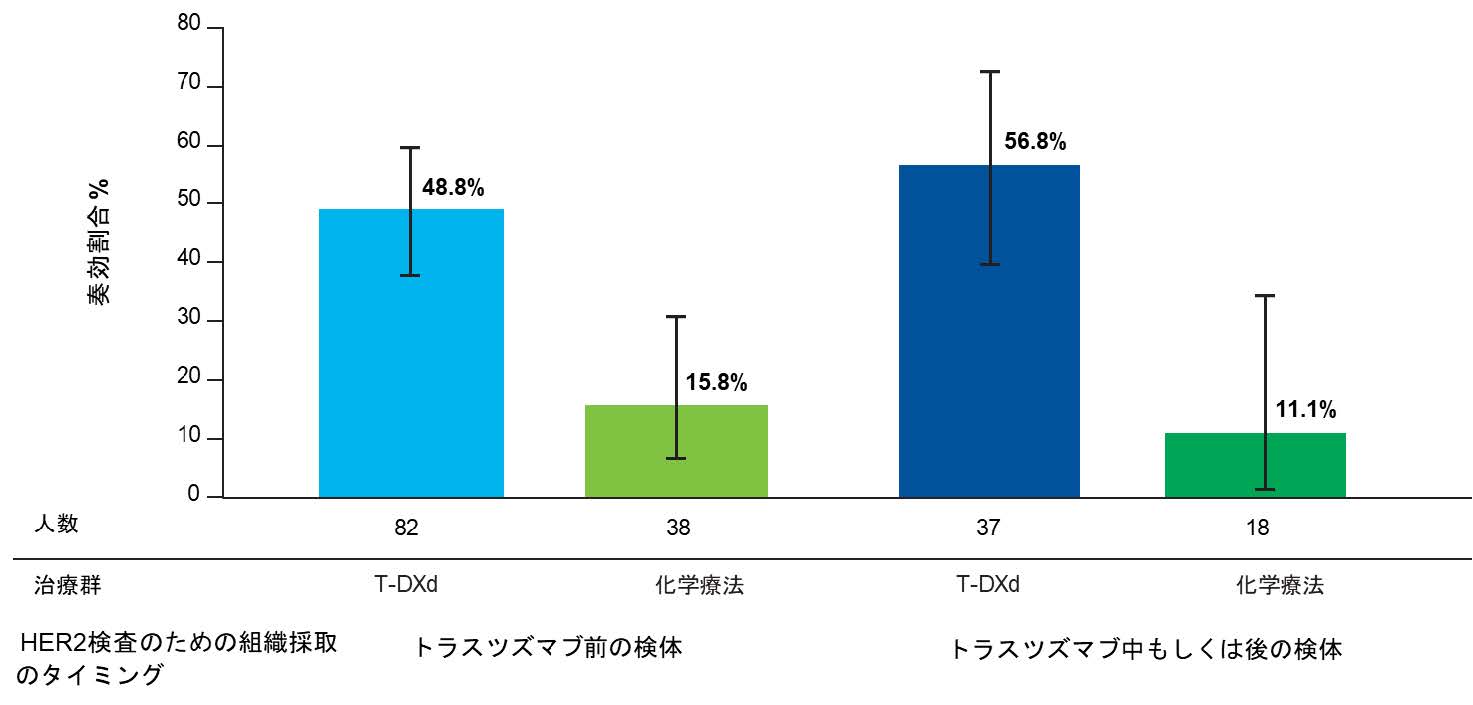
図4. HER2検査のための組織検査のタイミング別の生存期間
ctDNAを用いた遺伝子パネル検査技術注7の解析によると、奏効割合は、MET増幅を有する患者(n=8)で25%、EGFR増幅を有する患者(n=28)で32.1%、FGFR2増幅を有する患者(n=6)で0%であり、全集団よりやや低い傾向でした。一方でKRASやNRAS遺伝子変異を有する場合(n=16)の奏効割合は50%でした。
治療前後のリキッドバイオプシーの比較において、T-DXd治療を受ける前に45%(37/82)の患者さんにおいてctDNA上HER2の遺伝子増幅を有していましたが、治療終了時には33%(27/82)に減少していました。また、終了時のサンプルの中には、新規のTOP1遺伝子異常を認めた患者さんが3例確認され、HER2遺伝子増幅の消失やT-DXdの殺細胞薬としての標的であるTOP1遺伝子の後天的な遺伝子変異が、T-DXdの抵抗性獲得に関わっている可能性が示唆されました。
展望
本研究の結果、HER2陽性胃がんに対してT-DXdを投与する際に腫瘍検体や血液検体によるリキッドバイオプシーの検討により、効果が高く期待される患者さんが同定される可能性が示唆されました。同時に薬剤耐性の機序の一端が明らかとなり、今後さらなる治療開発に役立つことが期待されます。
論文情報
雑誌名
Nature Medicine
タイトル
Trastuzumab deruxtecan in HER2-positive advanced gastric cancer: exploratory biomarker analysis of the randomized, phase 2 DESTINY-Gastric01 trial
著者
Kohei Shitara*, Yung-Jue Bang, Satoru Iwasa, Naotoshi Sugimoto, Min-Hee Ryu, Daisuke Sakai, Hyun Cheol Chung, Hisato Kawakami, Hiroshi Yabusaki, Yasuhiro Sakamoto, Tomohiro Nishina, Koichiro Inaki, Yusuke Kuwahara, Naoya Wada, Fumitaka Suto, Takeo Arita, Masahiro Sugihara, Zenta Tsuchihashi, Kaku Saito, Akihito Kojima, Kensei Yamaguchi *Corresponding author
DOI
10.1038/s41591-024-02992-x
掲載日
2024年5月14日
URL
https://www.nature.com/articles/s41591-024-02992-x (外部サイトにリンクします)
研究費
- 研究費名(支援先)
第一三共株式会社 - 研究課題名
HER2発現の進行胃腺癌又は胃食道接合部腺癌の患者を対象としたDS-8201aの多施設共同非盲検第II相試験 - 研究代表者名
第一三共株式会社
用語解説
注1 HER2陽性胃がん
HER2発現を認める胃がんのこと。免疫染色で蛋白発現を分類し強陽性(3+)の場合か、中等度陽性(2+)かつ遺伝子増幅 (ISH法による)を認める場合のこと。
注2:Trastuzumab deruxtecan (T-DXd)
ヒト化モノクローナル抗体であるトラスツズマブとトポイソメラーゼI阻害剤であるデルクステカンを共有結合させた抗体薬物複合体の一種。
注3:DESTINY-Gastric01試験
日本と韓国で実施された非盲検無作為化第II相試験です。主要コホートではHER2 陽性(IHC3+もしくはIHC2+かつISH陽性)切除不能進行・再発胃がん、または胃食道接合部腺がん(以下「胃がん」)患者を対象にトラスツズマブ デルクステカンと化学療法が比較され、奏効割合と生存期間の改善を認めました。また、探索コホートにおいては、T-DXdのHER2低発現例に対する有効性が検討されました。
(https://www.nejm.org/doi/10.1056/NEJMoa2004413)(外部サイトにリンクします)
(https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9901967)(外部サイトにリンクします)
注4:リキッドバイオプシー(Liquid biopsy: 血液検体)
患者さんの血液、尿、涙、唾液、乳汁、脳脊髄液、胸水、腹水など採取可能な体液サンプルを指し、経時的な検査のために繰り返し採取・測定可能であるため、身体への負担が少ない利点が挙げられます。
注5:血中循環腫瘍DNA(ctDNA)
血液中にごく微量に存在するがん由来のDNA。
注6:バイオマーカー
ある疾患の有無や、病状の変化・進行・治療効果などで指標となる項目(血圧、心拍数、心電図、認知機能テストなど)および生体内の物質(タンパク質、代謝物や遺伝子など)を指します。
注7:遺伝子パネル検査
患者さんの組織や血液に含まれるがんに関連する遺伝子の異常を数十から数百種類まとめて調べる検査法で、次世代シークエンスと呼ばれる新技術が使われていいます。
お問い合わせ先
研究に関する問い合わせ
国立研究開発法人国立がん研究センター
東病院 消化管内科
設楽 紘平
Eメール:kshitara●east.ncc.go.jp
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室(柏キャンパス)
電話番号:04-7133-1111(代表)
Eメール:ncc-admin●ncc.go.jp
