小児白血病の新しいゲノム解析法―速く柔軟にゲノムの構造を読む―
国立大学法人東京大学
国立研究開発法人国立がん研究センター
発表のポイント
- 「ロングリードシークエンサーを用いたアダプティブサンプリング」という新しいゲノム解析手法を応用することで、小児白血病のゲノム異常を迅速かつ網羅的に検出できることを示しました。
- 新たなゲノム解析技術として注目されているロングリード解析は、まだその技術をどのように生かすかについては手探りでしたが、本研究により、診療で用いられている従来のゲノム解析手法では検出が難しい構造異常の検出に優れていることを示しました。
- 診療でがんゲノム医療として実施されているがんゲノムプロファイリング検査には、構造異常の検出や検査時間の長さなどの課題があり、このアダプティブサンプリング技術はこれらの課題に対応できることが期待され、小児白血病のゲノム医療をさらに進歩させるだけでなく、小児白血病以外にも様々な疾患のゲノム解析にも応用できる可能性があります。
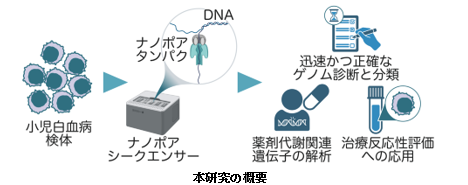
ロングリードシークエンサーの1種であるナノポアシークエンサーを用い、28症例の小児白血病に対してアダプティブサンプリングによるゲノム解析を行った。
発表内容
国立大学法人東京大学大学院医学系研究科小児医学講座の加登翔太(医学博士課程)、加藤元博教授と国立研究開発法人国立がん研究センター研究所ゲノム解析基盤開発分野白石友一分野長らによる研究グループは、ロングリードシークエンサーの1種であるナノポアシークエンサー注1を用いたアダプティブサンプリングという新しいゲノム解析手法を応用して、小児白血病の様々なゲノム異常を迅速かつ網羅的に検出できることを示しました。
がんの診療において、診断や予後予測、治療標的の同定のためにゲノム解析は必須の検査であり、次世代シークエンサーを用いたターゲットキャプチャーシークエンス(図1左)によるがんゲノムプロファイリング検査注2が「ゲノム医療」としてすでに診療に実装されています。しかし、がんゲノムプロファイリング検査ではプローブを用いて標的とする領域のゲノムを選択的に濃縮することから、解析される領域が非連続的になり、構造異常注3やコピー数異常注4を検出しづらいという課題がありました。また、検体の提出から結果の返却までに1か月以上の時間がかかることも解決が望まれている点でした。
これらの問題を解決するために、本研究グループはロングリード解析が可能なナノポアシークエンサーを用いたアダプティブサンプリング(図1右)という新しいゲノム解析手法に着目しました。アダプティブサンプリングはナノポアシークエンサーの「リアルタイム性」を利用して、DNAをシークエンスしながら標的領域の濃縮を行うターゲットシークエンス法です。解析領域が連続的になるため構造異常やコピー数異常の検出に優れていることが特徴であり、また、従来の次世代シークエンサーよりも迅速なシークエンスが可能です。小児白血病では、構造異常やコピー数異常が疾患の発症に深く関与するため、アダプティブサンプリングによるゲノム解析の有用性が特に高いと考えました。しかし、アダプティブサンプリングの解析手法は確立しておらず、がん領域での有用性も確認されていませんでした。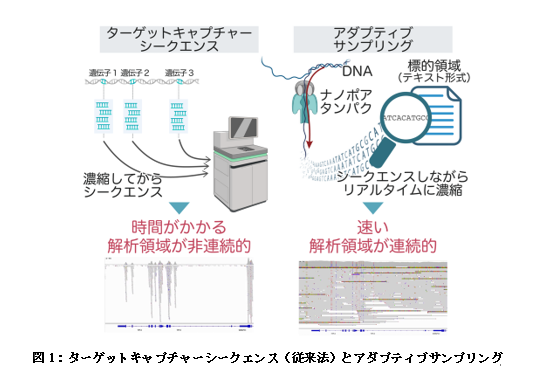 ターゲットチャプチャーシークエンスではゲノム上の標的領域に結合するRNAプローブを用いて標的領域を濃縮してからシークエンスを行うため、解析領域が非連続的になる。
ターゲットチャプチャーシークエンスではゲノム上の標的領域に結合するRNAプローブを用いて標的領域を濃縮してからシークエンスを行うため、解析領域が非連続的になる。
アダプティブサンプリングはDNAをシークエンスしながら塩基配列解析を行い、リアルタイムに標的領域を濃縮していく。標的領域をテキスト形式で指定するため、ゲノム上の連続した広い範囲を標的領域にすることができ、解析領域が連続的になる。
本研究では小児白血病に対するアダプティブサンプリングにより得られた解析データを処理するパイプライン注5を構築し、28症例(急性骨髄性白血病10症例、B細胞性急性リンパ芽球性白血病13症例、T細胞性急性リンパ芽球性白血病5症例)のデータを用いてその有用性を評価しました。データを取得しながらスーパーコンピューターを用いて処理することで、検体の調製から72時間以内に結果を出力できる迅速な解析パイプラインを構築できました。28症例のうち24症例では、病型の分類に関わる重要なゲノム異常を検出することができました。このうち12症例は通常の診療で実施する検査ではゲノム異常を検出できていなかったもので、全て融合遺伝子注6などの構造異常でした。その他にも病型分類には直接は関わらないものの白血病の発生に関わることが報告されているゲノム異常が2症例、生殖細胞系列注7のバリアントが1症例で検出され、これらも全て構造異常でした(図2)。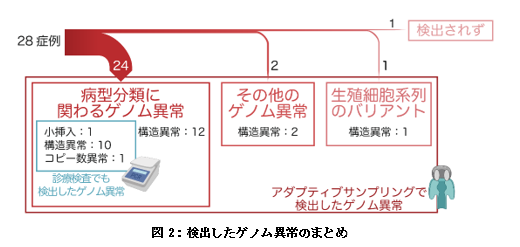
検出した構造異常の具体例としては、染色体検査などの診療検査では検出が難しかった“隠れ融合遺伝子”や、ターゲットキャプチャーシークエンスでは検出が難しい遺伝子全体あるいは広範囲の欠失などがありました(図3)。またターゲットキャプチャーシークエンスと異なり、アダプティブサンプリングでは非標的領域の情報もゲノム全域にわたって得られるため、このデータも用いることで、コピー数異常も効率的に検出できました(図4)。
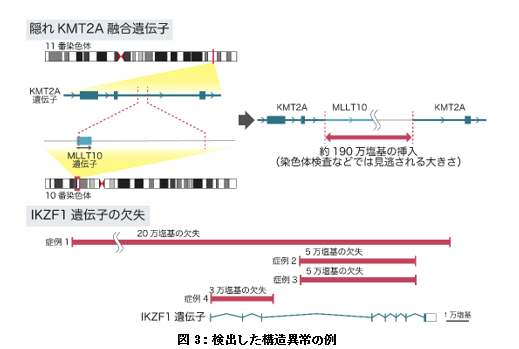
上)10番染色体のMLLT10遺伝子を含む約190万塩基の領域が11番染色体のKMT2A遺伝子に挿入されることでKMT2A::MLLT10融合遺伝子を形成していた。この程度の大きさの染色体の構造変化は染色体検査などでは見逃される。
(下)4症例でIKZF1遺伝子の全長あるいは部分的な欠失を検出した。IKZF1遺伝子の異常は小児急性リンパ芽球性白血病の予後不良因子として知られているが、このような遺伝子全体、あるいは部分的な欠失は、ターゲットキャプチャーシークエンスでは検出しづらい。
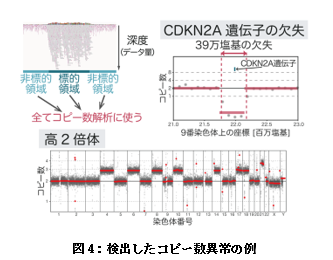
アダプティブサンプリングでは非標的領域についても深度(データ量)は小さいもののシークエンスの結果が出力される(左上)。ゲノム全体に分布する非標的領域のデータもコピー数解析に使うことで、染色体レベルの大きいコピー数異常(下)も、局所的なコピー数異常(右上)も効率的に検出できた(正常な細胞のX・Y染色体を除く染色体のコピー数は2である)。
その他にも本研究で構築した解析パイプラインを用いて、薬剤代謝に関わる遺伝子の詳細な解析や、治療効果の指標となりうるゲノム異常の検出が可能であり、この技術の応用範囲が広いことを示すことができました。
さらに、28症例のうち21症例については、従来の次世代シークエンサーによる全ゲノム解析結果と今回のアダプティブサンプリングによるゲノム解析結果を比較しました。従来の次世代シークエンサーと比較して、アダプティブサンプリングは一塩基置換や小挿入・欠失などの検出は不得手であり、解析ソフトなどの改善による検出率の向上が必要と考えられました。一方で構造異常のうち、免疫グロブリン遺伝子やT細胞受容体遺伝子の再構成などはロングリード解析を用いたアダプティブサンプリングのみで検出されており、この技術の構造異常検出における優位性を示しました。
本研究グループが構築したアダプティブサンプリングの解析パイプラインにより、小児白血病のゲノム異常、特に小児白血病の発生に重要な構造異常やコピー数異常を迅速かつ網羅的に検出できるため、本解析手法を診療に実装することでより迅速かつ有用な小児白血病のゲノム解析を実現できる可能性があります。また、本解析手法は小児白血病以外にも様々な疾患のゲノム解析に応用できると考えられるため、本研究成果がゲノム医療のさらなる進歩に寄与することが期待されます。
発表者
国立大学法人東京大学
大学院医学系研究科 生殖・発達・加齢医学専攻 小児医学講座
加登 翔太 (医学博士課程)
兼:東京大学医学部附属病院 小児科 病院診療医
加藤 元博 教授
兼:東京大学医学部附属病院 小児科 科長
国立研究開発法人国立がん研究センター
研究所 ゲノム解析基盤開発分野
白石 友一 分野長
論文情報
雑誌名
Blood Cancer Journal
タイトル
Genome profiling with targeted adaptive sampling long-read sequencing for pediatric leukemia
著者
Shota Kato, Aiko Sato-Otsubo, Wataru Nakamura, Masahiro Sugawa, Ai Okada, Kenichi Chiba, Nao Takasugi, Tomoya Irikura, Moe Hidaka, Masahiro Sekiguchi, Kentaro Watanabe, Yuichi Shiraishi, Motohiro Kato*(*:責任著者)
DOI
10.1038/s41408-024-01108-5
URL
https://www.nature.com/articles/s41408-024-01108-5(外部サイトにリンクします)
研究助成
本研究は、日本医療研究開発機構(AMED)革新的がん医療実用化研究事業「小児がんの全ゲノム解析等のデータ基盤の充実と診療応用に資する成果の創出(研究開発代表者:加藤元博、課題番号:JP23ck0106876)」、「がん全ゲノム解析等による実践的個別化医療体系構築と拡充をめざした多施設共同研究(研究開発代表者:角南久仁子、課題番号:JP23ck0106870)」および日本白血病研究基金「アダプティブサンプリングによる小児白血病のゲノム・エピゲノム解析(令和5年度臨床医学特別賞)」の支援により実施されました。
用語解説
注1 ロングリードシークエンサー、ナノポアシークエンサー
従来の次世代シークエンサーはDNAやRNAを100~200塩基ずつ解析していくショートリード(短鎖)シークエンサーであるのに対し、ロングリード(長鎖)シークエンサーは数千~数百万塩基の長さのDNA・RNAを解析することができ、繰り返し配列などゲノム上の複雑な領域の解析に優れている。ナノポアシークエンサーはロングリードシークエンサーの1種で、DNAやRNAがナノポアタンパクという微小(=ナノ)な穴状(=ポア)のタンパクを通過する際に生じる電流変化を利用してゲノム解析を行う。
注2 がんゲノムプロファイリング検査
次世代シークエンサーを用いたターゲットキャプチャーシークエンス(プローブを用いて標的とする領域のゲノムを選択的に濃縮し、そのゲノム情報を取得する方法)により、多数(100以上)のがんの病態に関与する遺伝子を網羅的に解析すること。日本では固形腫瘍に対してすでにがんゲノムプロファイリング検査が診療実装されている。
注3 構造異常
ゲノムに生じる約1000塩基以上の欠失や挿入、逆位(ゲノムの一部分が通常と逆方向に構成されること)、転座(異なる2つの染色体に切断が起こり、入れ替わって結合すること)の総称。
注4 コピー数異常
正常なヒト細胞には父由来および母由来の計2つ(2コピー)の染色体がある。ゲノム上の一部分の数が少なくなったり(0コピー、1コピー)、多くなったり(3コピー以上)することをコピー数異常と言う。
注5 パイプライン
取得したデータを解析するための、様々な解析手法を組み合わせた一連の処理手順のこと。
注6 融合遺伝子
染色体転座の結果2つの遺伝子が結合したもの。がんでは、融合遺伝子の形成によって細胞の増殖などに関与する遺伝子の機能の調節が破綻する(多くの場合亢進する)ことで、異常な細胞が増殖し疾患を発症することがある。
注7 生殖細胞系列
生まれつきもっている全身の細胞、およびそのゲノム情報のこと。がんの多くは遺伝子の後天的な変異(体細胞変異)によって生じるが、約10%は生殖細胞系列の遺伝子の病的な変化(バリアント)によって生じることが近年明らかになってきた。
お問い合わせ先
研究に関するお問合せ
国立大学法人東京大学 大学院医学系研究科 生殖・発達・加齢医学専攻 小児医学講座
(東京大学医学部附属病院 小児科)
教授 加藤 元博(かとう もとひろ)
国立研究開発法人国立がん研究センター 研究所 ゲノム解析基盤開発分野
分野長 白石 友一(しらいし ゆういち)
広報窓口
国立大学法人東京大学 医学部附属病院 パブリック・リレーションセンター
担当:渡部、小岩井
Tel:03-5800-9188(直通)
E-mail:pr●adm.h.u-tokyo.ac.jp
国立研究開発法人国立がん研究センター 企画戦略局 広報企画室
Tel:03-3542-2511(代表)
E-mail:ncc-admin●ncc.go.jp
