クローディン18.2陽性胃がんに対するゾルベツキシマブと化学療法併用による長期の生存延長効果を公表
2024年9月18日
国立研究開発法人国立がん研究センター
発表のポイント
- 本研究では、二つの第III相試験の統合解析を実施し、抗クローディン18.2 抗体であるゾルベツキシマブと化学療法の併用療法がプラセボと化学療法の併用と比較して有意にクローディン18.2陽性の進行再発胃がん患者の生存期間を延長することを確認しました。
- 二つの比較試験において、クローディン18.2陽性であることが確認された1072例の患者さんがゾルベツキシマブと化学療法もしくはプラセボと化学療法の併用にランダム化されました。
- 無増悪生存期間の中央値はゾルベツキシマブ併用群で9.2カ月,化学療法単独で8.2カ月であり、増悪もしくは死亡までのリスクは29%軽減されました (ハザード比 0.71)。
- 全生存期間の中央値はゾルベツキシマブ併用群で16.4カ月, 化学療法単独群で13.7カ月であり、死亡リスクが23%減少したことが確認されました (ハザード比 0.77)。
- 本研究は、ゾルベツキシマブ併用の長期の有効性を示したことが評価され、科学雑誌「The New England Journal of Medicine」に掲載されました。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)東病院(病院長:土井 俊彦、千葉県柏市)設楽 紘平 消化管内科長らの研究グループは、クローディン18.2陽性胃がん注1に対するゾルベツキシマブ注2と化学療法の長期の有効性を確認するために、グローバルで行われた二つの第III相試験 (SPOTLIGHT試験、GLOW試験注3) の統合解析を行いました。
その結果、ゾルベツキシマブと化学療法の併用による無増悪生存期間や全生存期間の延長を再確認しました。悪心・嘔吐はゾルベツキシマブ併用群で化学療法単独と比較して増加していましたが、長期の経過観察による新たな懸念は認められませんでした。また健康状態/生活の質の全般的なスコアの経時的変化については、両群で同様の傾向が見られ、ゾルベツキシマブが健康状態や生活の質を損ねないことが示唆されました。
本研究は、ゾルベツキシマブ併用の長期の有効性を示したことが評価され、科学雑誌「The New England Journal of Medicine」(米国東部時間2024年9月16日, Correspondence)に掲載されました。
背景
SPOTLIGHT試験・GLOW試験は、全世界で実施された二つの盲検無作為化第III相試験であり、クローディン18.2陽性(中等度以上の染色性が腫瘍細胞の75%以上に確認される場合)の切除不能進行・再発胃がん、または胃食道接合部腺がん(以下「胃がん」)患者さんを対象に、クローディン18.2抗体であるゾルベツキシマブと標準的な初回化学療法の併用と、プラセボと化学療法の併用(化学療法単独)が比較されました。
いずれの試験においても主要評価項目である無増悪生存期間の有意な延長と、中間解析時点における全生存期間の有意な改善を認めました(https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(23)00620-7/abstract; https://www.nature.com/articles/s41591-023-02465-7)(外部サイトにリンクします)。
これらの結果に基づきゾルベツキシマブと化学療法の併用は2024年3月26日にクローディン18.2陽性の治癒切除不能な進行・再発の胃がんを効能・効果として日本における製造販売承認が得られています。これら二つの試験はいずれも国際共同試験として実施されましたが、国別の患者登録数に差異があり、また異なる化学療法が用いられました。そこで今回、研究グループは生存結果について最終解析を行い、二つの試験を統合した解析を実施しました。
研究成果
二つの試験を統合して1072例の患者さんがゾルベツキシマブと化学療法 (SPOTLIGHT試験ではmFOLFOX6療法、GLOW試験ではCapeOX療法) の併用 (ゾルベツキシマブ併用群, 537例)もしくはプラセボと化学療法の併用 (化学療法単独群, 535例) にランダム化されて治療を受けました。
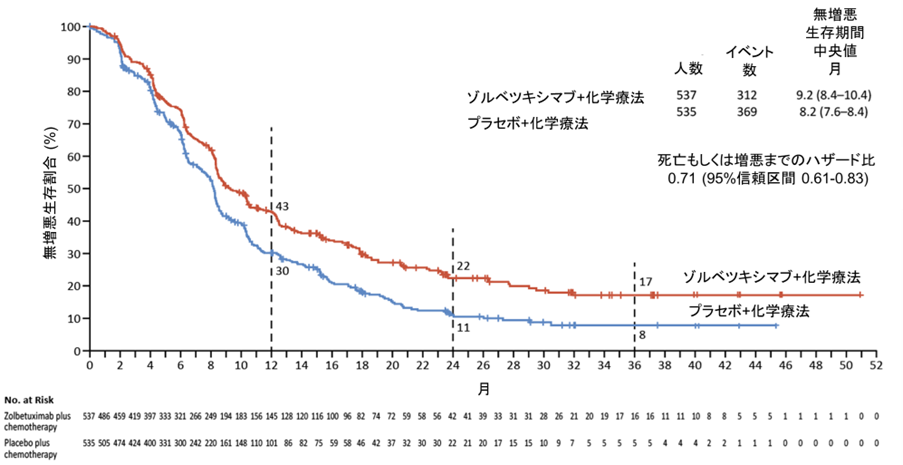
無増悪生存期間の中央値はゾルベツキシマブ併用群で9.2カ月,化学療法単独で8.2カ月であり、増悪もしくは死亡までのリスクは29%軽減されました (ハザード比 0.71, 95%信頼区間0.61-0.83,図1)。2年の無増悪生存割合は併用群で11%の上乗せを認めました(ゾルベツキシマブ併用群22%、化学療法単独11%)。
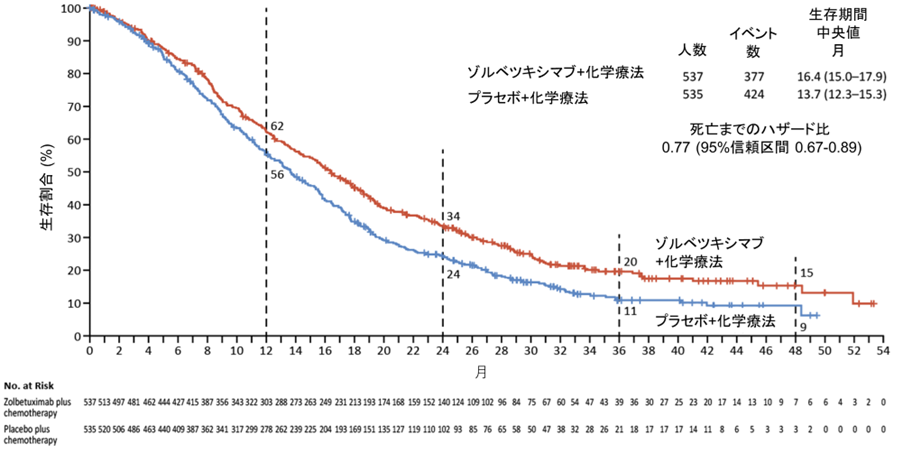
全生存期間の中央値はゾルベツキシマブ併用群で16.4カ月, 化学療法単独群で13.7カ月であり、死亡リスクが23%減少したことが確認されました (ハザード比 0.77, 95%信頼区間0.67-0.89,図2)。2年の生存割合は併用群で10%の上乗せを認めました(ゾルベツキシマブ併用群34%、化学療法単独24%)。
事前に規定されたサブグループ解析において一貫した生存延長効果が確認され、また二つの試験それぞれにおいても生存延長効果が確認されました (SPOTLIGHT試験の生存期間中央値 18.2 vs 15.6カ月, GLOW試験14.4カ月 vs 12.2カ月)。一方で腫瘍縮小効果については両群で大きな差を認めませんでした。
ゾルベツキシマブ併用群で頻度の高かった有害事象は、悪心(ゾルベツキシマブ併用群:76.0%、化学療法単独群:56.2%)と嘔吐(66.8%、34.2%)であり、追跡調査による新たな安全性における懸念は認められませんでした。また、これらの有害事象は初回投与に多く発生し、その後頻度は明らかに減少することが両試験ともに確認されています。
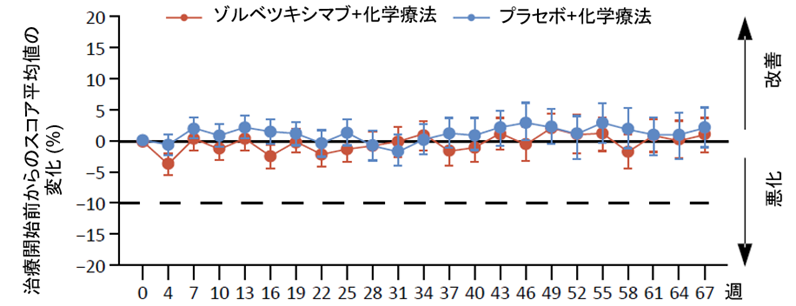
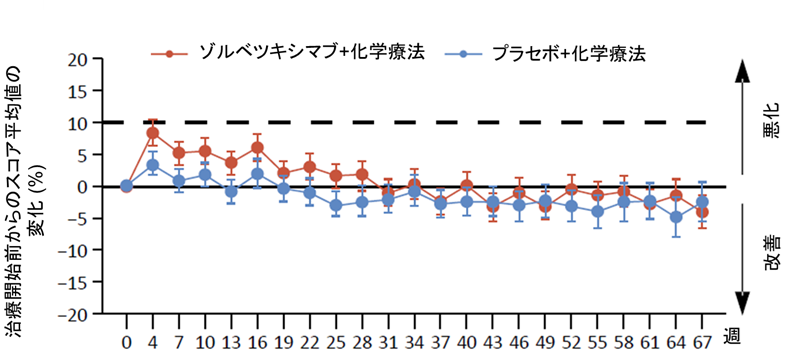
患者さんから報告された健康状態/生活の質の全般的なスコアの経時的変化については、両群でほぼ同様の傾向がみられ、ゾルベツキシマブが全般的な健康状態や生活の質を損ねないことが示唆されました(図3)。嘔気や嘔吐に関するスコアは治療開始初期にゾルベツキシマブ群で悪化する傾向にありましたが、両群において19週程度で治療開始前のスコアに戻り、以後差を認めませんでした(図4)。
展望
本研究の結果、クローディン18.2陽性胃がんに対してゾルベツキシマブと化学療法の併用が化学療法単独と比較して有意に増悪までの期間や全生存期間を延長することが再確認され、ゾルベツキシマブと化学療法の併用が最適な標準治療の選択肢として支持される結果と考えられます。
論文情報
雑誌名
The New England Journal of Medicine
タイトル
Zolbetuximab in Gastric or Gastroesophageal Junction Adenocarcinoma
著者
Kohei Shitara*, Manish A. Shah*, Florian Lordick, Eric Van Cutsem, David H. Ilson, Samuel J. Klempner, Yoon-Koo Kang, MD, Sara Lonardi, Yi-Ping Hung, Kensei Yamaguchi, Peter Enzinger, Tomoko Nakajima, Maria Matsangou, Ying Cao, Ran Li, Diarmuid Moran, Rupesh Pophale, Mok Oh, Radhika Ranganath, Jaffer A. Ajani†, Rui-Hua Xu†
*共同筆頭著者 †共同責任著者
DOI
10.1056/NEJMc2409512
掲載日
2024年9月16日午前3時(米国東部時間)
URL
https://www.nejm.org/doi/full/10.1056/NEJMc2409512(外部サイトにリンクします)
研究費
-
研究費名:アステラス製薬
-
研究課題名:クローディン(CLDN)18.2陽性,HER2陰性の局所進行性切除不能又は転移性胃腺癌及び食道胃接合部(GEJ)腺癌患者を対象とした,Zolbetuximab(IMAB362)+mFOLFOX6とプラセボ+mFOLFOX6の一次治療としての有効性を比較する,第III相国際多施設共同二重盲検ランダム化試験 (SPOTLIGHT), クローディン(CLDN)18.2陽性,HER2陰性の局所進行性切除不能又は転移性胃腺癌及び食道胃接合部(GEJ)腺癌患者を対象とした,Zolbetuximab(IMAB362)+CapeOXとプラセボ+ CapeOX の一次治療としての有効性を比較する,第III相国際多施設共同二重盲検ランダム化試験 (GLOW)
用語説明
注1 クローディン18.2陽性胃がん
免疫染色でクローディン18蛋白発現を判定し、中等度から強い染色を75%以上の腫瘍細胞の細胞膜に認める場合を示します。クローディン18.2は細胞接着に関わる膜貫通型の蛋白であり、正常の胃粘膜に発現していますが、胃癌においても約40%で陽性例が認められます。
注2 ゾルベツキシマブ
クローディン18.2 に対するキメラIgG1モノクローナル抗体のこと。二つの第III相試験の結果に基づき、クローディン18.2陽性の治癒切除不能な進行・再発の胃がんを効能・効果として日本における製造販売承認が得られています。
注3 SPOTLIGHT試験とGLOW試験
いずれもゾルベツキシマブと化学療法の有効性・安全性をプラセボと化学療法を比較した第III相試験です。SPOTLIGHT試験では化学療法としてmFOLFOX6療法(フルオロウラシルとレボホリナートにオキサリプラチンを併用する)が用いられ、GLOW試験ではCapeOX療法(カペシタビンにオキサリプラチンを併用する)が用いられました。いずれも全世界の国々で実施されましたが、国別の患者登録数の差異がありました。特にGLOW試験では中国からの患者数が29%と多くを占めました。いずれの試験にも日本からの患者さんが参加されています。結果として、両試験において主要評価項目である無増悪生存期間の有意な延長と、中間解析時点における全生存期間の有意な改善を認めました。両試験において、併用による嘔気・嘔吐の増加を認めましたが、これらの有害事象は初回投与時に多く発生し、その後の投与時には頻度が明らかに減少することが確認されています。
(https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(23)00620-7/abstract)(外部サイトにリンクします)
(https://www.nature.com/articles/s41591-023-02465-7)(外部サイトにリンクします)
お問い合わせ先
研究に関するお問い合わせ
国立研究開発法人国立がん研究センター東病院
消化管内科 設楽 紘平
電話番号:04-7133-1111
Eメール:kshitara●east.ncc.go.jp
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室(柏キャンパス)
電話番号:03-3542-2511(代表)
Eメール:ncc-admin●ncc.go.jp
