胃食道がんにおけるニボルマブと化学療法併用またはニボルマブとイピリムマブ化学療法併用のバイオマーカー解析結果が明らかに(CheckMate 649試験から)
2025年3月13日
国立研究開発法人国立がん研究センター
発表のポイント
- 本研究では、免疫チェックポイント阻害剤であるニボルマブと化学療法併用、もしくはニボルマブ及び別の免疫チェックポイント阻害剤であるイピリムマブ化学療法併用を受けた胃食道がん患者さんにおける腫瘍検体を解析し、奏効例の特徴や抵抗性に関与する機序を検討しました。
- KRAS遺伝子異常を有する場合に、ニボルマブと化学療法併用が化学療法と比較して生存の上乗せ効果が特に顕著でした。
- 間質細胞に関わる遺伝子の発現レベルをまとめて数値化した遺伝子発現スコアや血管新生に関わる遺伝子発現が低い際には、ニボルマブ併用レジメン(薬物療法を行う上で、薬剤の用量や用法、治療期間を明記した治療計画)の生存延長効果が発揮されやすく、制御性T細胞に関連した遺伝子発現が高い場合には、ニボルマブ+イピリムマブ群で生存延長効果が示唆されました。
- この研究結果は、ニボルマブを含む治療によるがん治療がより有効な患者さんを特定し、患者さんの治療成績を向上させることに繋がることが期待されます。
- 本研究は、胃がんにおける大規模な臨床試験におけるバイオマーカーの意義を示したことが評価され、科学雑誌「Nature Medicine」に掲載されました。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)東病院(病院長:土井 俊彦、千葉県柏市)設楽 紘平 消化管内科長らの研究グループは、日本を含む全世界で実施されたニボルマブ注1化学療法併用、またはニボルマブとイピリブマブ注2化学療法併用と比較した「CheckMate 649試験」注3に参加された患者さんのバイオマーカー注4と生存延長効果との関連を検討するため、参加された患者さんから採取した腫瘍組織を用いてバイオマーカー解析を行う研究を実施しました。
その結果、ニボルマブ+化学療法併用と、ニボルマブ+イピリムマブ療法併用、それぞれの有効性もしくは抵抗性に影響するバイオマーカーを明らかにしました。本研究は、科学雑誌「Nature Medicine」(2025年3月7日)に掲載されました。
背景
CheckMate 649試験において、進行胃食道腺がんに対する一次治療としてのニボルマブ+化学療法併用は、化学療法と比較して、生存期間を有意に延長することが示されています。一方で、ニボルマブ+イピリムマブ療法併用は、化学療法と比較して一部の患者集団における持続的な奏効及び高い生存割合を示しましたが、事前に規定した有効性の基準を満たさなかったことがすでに報告されています。
これまでの検討では、マイクロサテライト不安定性が高い場合や免疫チェックポイントであるPD-L1発現(combined positive score、CPS)が高い場合にはニボルマブの効果が発揮されやすい可能性が確認されていますが、それ以外にどのようなバイオマーカーが治療効果や抵抗性に関わっているかは明らかではありませんでした。本研究では探索的なバイオマーカー解析を追加で行い、治療効果との関連を検討しました。
研究成果(方法・結果)
本研究では、CheckMate 649試験に参加され、ニボルマブと化学療法併用または化学療法の治療にランダム化された1581名のうち、685例の腫瘍組織を用いて全エクソーム解析注5を実施し、また809例の腫瘍組織のRNAを解析し遺伝子発現スコア(gene expression score)注6を検討しました。また、ニボルマブ+イピリムマブ療法併用または化学療法群にランダム化された813名のうち、366名を全エクソーム解析により、402名をRNA解析により分析しました。
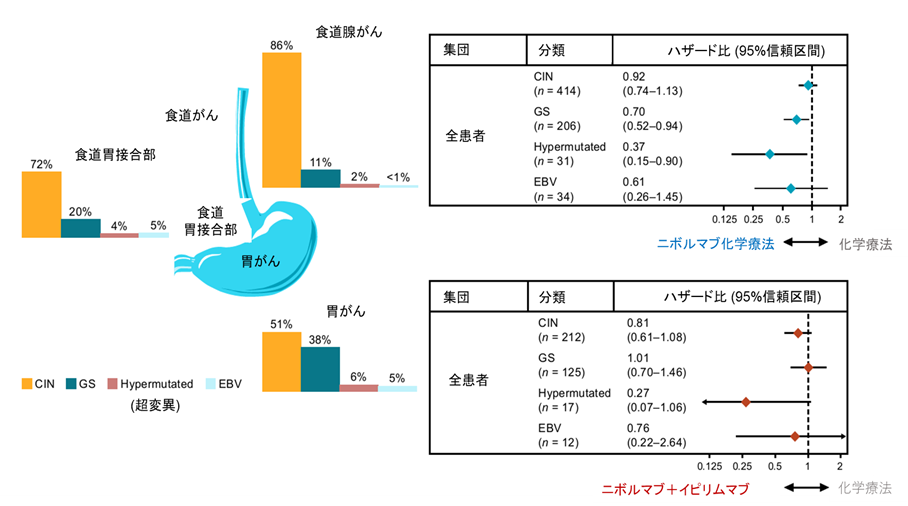
本研究の結果、遺伝子変異数を多く有する超変異サブタイプ(hypermutated)では、化学療法と比べて、ニボルマブを含むいずれの治療も生存延長効果が顕著に示唆されました(ニボルマブ+化学療法の死亡ハザード比 0.37、ニボルマブ+イピリムマブ療法の死亡ハザード比 0.27、図1)。
また、ニボルマブ+化学療法併用による治療効果を他の胃癌の分子学的分類で比較したところ、ゲノム安定性サブタイプ(genomic stable、GSタイプ、ハザード比0.70)やEBウイルス(EBV)陽性サブタイプ(ハザード比 0.61)と比較して、染色体不安定性(chromosomal instable、CINタイプ)の患者さんにおいて効果がやや乏しい結果でした。PD-L1 CPSが5以上の集団に限定しても同様の傾向が認められました。一方で、ニボルマブ+イピリムマブ療法併用では異なる傾向が認められ、CINサブタイプでハザード比は0.81、EBVサブタイプで0.76であったのに対し、GSサブタイプでは1.01でした(図1)。
図1. 胃がんの分子学的分類別の生存延長効果
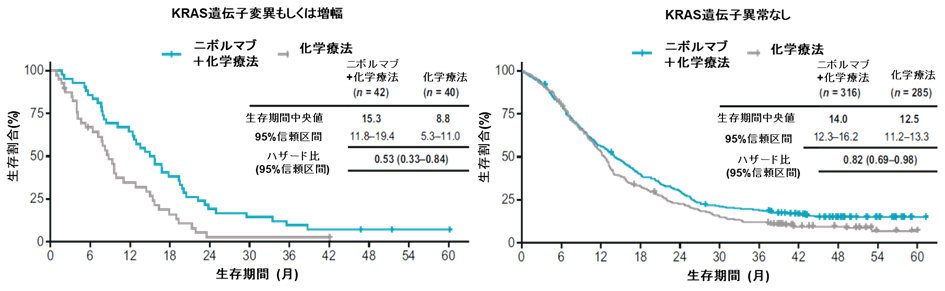
本研究で、頻度が高く認められた遺伝子変異は、TP53(55%)、ARID1A(13%)、KRAS(12%)でした。これらの遺伝子変異の有無で比較を行ったところ、ニボルマブ+化学療法併用はすべての遺伝子グループにおいて化学療法と比べて生存延長傾向が認められました。また、KRAS遺伝子変異もしくは遺伝子増幅を認めるサブグループで、より生存延長の程度が大きい傾向が認められました。
図2. KRAS遺伝子異常の有無別の生存延長効果
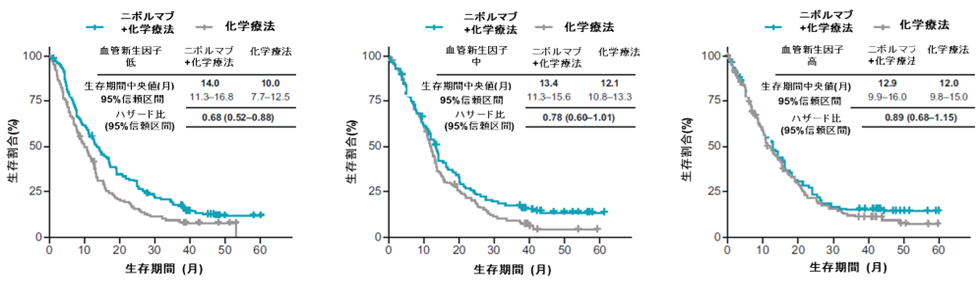
ニボルマブ+化学療法併用は、化学療法と比較したとき、血管新生に関わる遺伝子発現スコア(gene expression score)注7 が低い患者さんでは、CPS5以上でハザード比0.62であり、CPS5未満でハザード比0.66と、PDL1の発現に関わらず一貫して良好な生存延長効果が示唆されました(図3)。一方で、血管新生に関わる遺伝子発現スコアが高い患者さんではCPS5以上でハザード比0.85であり (図右上)、CPS5未満で0.89であり、生存延長効果が乏しい傾向でした。
図3. 血管新生に関わる遺伝子発現別の生存延長効果 (全体集団)
また、腫瘍間質に関わる遺伝子発現が低い場合や、MAPK経路注8に関わる遺伝子発現が高い場合に、ニボルマブの上乗せ効果が示唆されました。
ニボルマブ+イピリムマブ併用と化学療法の比較においては、特に制御性T細胞(regulatory T cell、Treg)注9に関する遺伝子発現が高い集団における生存の延長傾向が示唆されました。また、この傾向はPD-L1の発現グループに関わらず一貫して確認されました(図4)。
図4. 制御性T細胞(Treg) 遺伝子発現別のニボルマブ+イピリムマブと化学療法の比較
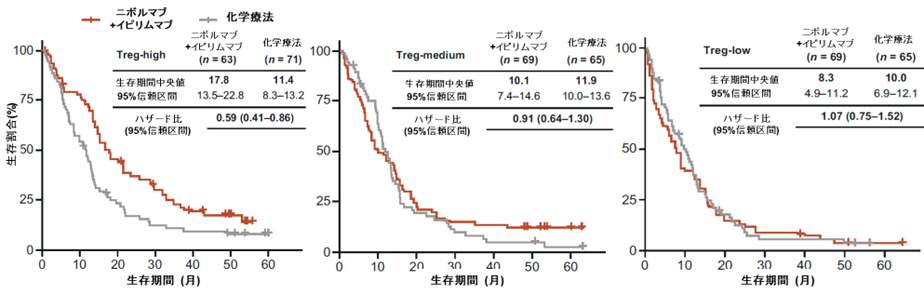
また、細胞遊走に関わるケモカイン12種類の遺伝子発現や、炎症に関わる10種類の遺伝子発現スコアが高い集団においても生存延長効果が示唆される傾向でした(それぞれハザード比0.59, 0.63)。
展望
本研究の結果、一次治療としてのニボルマブと化学療法、及びニボルマブとイピリブマブの化学療法は、生存延長効果が得られやすい、もしくは得られにくい可能性のある患者集団を特定できる可能性が示唆されました。これらのバイオマーカーを治療選択に実際に利用可能であるかを明らかにするための臨床試験の実施や、抵抗性を改善するための新たな治療法の開発に繋がることが期待されます。
論文情報
雑誌名
Nature Medicine
タイトル
Nivolumab plus chemotherapy or ipilimumab in gastroesophageal cancer: exploratory biomarker analyses of a randomized phase 3 trial
著者
Kohei Shitara, Yelena Y. Janjigian, Jaffer Ajani, Markus Moehler, Jin Yao, Xuya Wang, Aparna Chhibber, Dimple Pandya, Lin Shen, Marcelo Garrido, Carlos Gallardo, Lucjan Wyrwicz, Kensei Yamaguchi, Tomasz Skoczylas, Arinilda Bragagnoli, Tianshu Liu, Michael Schenker, Patricio Yañez, Ruben Kowalyszyn, Michalis Karamouzis, Thomas Zander, Kynan Feeney, Elena Elimova, Parul Doshi, Mingshun Li, Ming Lei
DOI
10.1038/s41591-025-03575-0
掲載日
2025年3月7日
URL
https://www.nature.com/articles/s41591-025-03575-0 (外部サイトにリンクします)
研究費
研究費名(支援先)
ブリストル・マイヤーズスクイブ株式会社、小野薬品工業株式会社
研究課題名
治療歴のない進行性又は転移性胃がん若しくは胃食道接合部がん患者を対象に、ニボルマブとイピリムマブの併用療法又はニボルマブとオキサリプラチン及びフルオロピリミジンの併用療法とオキサリプラチン及びフルオロピリミジンの併用療法を比較する多施設共同第III相無作為化非盲検試験
研究代表者名
ブリストル・マイヤーズスクイブ株式会社
用語解説
注1 ニボルマブ
免疫チェックポイント阻害剤の一つであり、PD1とPD-L1の結合を阻害することで、腫瘍に対する免疫応答を回復させる機序を有する薬剤のこと。
注2 イピリブマブ
免疫チェックポイント阻害剤の一つであり、主としてCTLA4と抗原提示細胞上のCD80/86の結合を阻害することで、腫瘍に対する免疫応答を回復させる機序を有する薬剤のこと。注3 CheckMate 649試験
日本を含む世界29国で実施された非盲検無作為化第III相試験です。未治療の切除不能進行再発胃がん・食道腺がん患者を対象に、ニボルマブと化学療法、ニボルマブ+イピリムマブ療法併用、または化学療法の治療が比較されました。ニボルマブと化学療法は生存期間を延長することが示され、日本を含む世界各国における標準治療の一つとなりました。一方で、ニボルマブ+イピリムマブ療法併用は、化学療法と比較して有意に生存期間を延長することはできませんでした。
(https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(21)00797-2/fulltext)(外部サイトにリンクします)
(https://www.nature.com/articles/s41586-022-04508-4)(外部サイトにリンクします)
注4 バイオマーカー
ある疾患の有無や、病状の変化・進行・治療効果などで指標となる項目(血圧、心拍数、心電図、認知機能テストなど)および生体内の物質(タンパク質、代謝物や遺伝子など)を指します。
注5 全エクソーム解析
タンパク質のもとになる設計図であるDNAの一部であるエクソンという領域を腫瘍組織において網羅的に解析したもの。
注6 RNA発現の遺伝子発現スコア(gene expression score)
DNAから塩基配列が映し出されたRNAの腫瘍組織における発現レベルを検討し数値化したもの。
注7 血管新生因子
がん細胞や正常組織における血管の新生・増殖を促進する因子のこと。
注8 MAPK経路
マイトジェン活性化プロテインキナーゼの略であり、細胞分裂促進因子活性化タンパク質酵素のこと。
注9 制御性T細胞 (regulatory T cell、Treg)
免疫にブレーキをかける免疫抑制機能を有するT細胞のこと。
お問い合わせ先
研究に関するお問い合わせ
国立研究開発法人国立がん研究センター東病院
消化管内科 設楽 紘平
04-7133-1111(代表)
Eメール:kshitara●east.ncc.go.jp
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室(柏キャンパス)
電話番号:04-7133-1111(代表)
Eメール:ncc-admin●ncc.go.jp
