節性T濾胞ヘルパー細胞リンパ腫の分子分類とその臨床的有用性~4つの分子亜型への分類とTP53やCDKN2A異常を有する予後不良群の同定~
北海道大学病院
国立研究開発法人国立がん研究センター
慶応義塾大学
発表のポイント
- これまでで最大である173例の節性T濾胞ヘルパー細胞リンパ腫(nTFHL)の遺伝子解析を行い、nTFHLにおける遺伝子異常の全体像を明らかにしました。
- TET2、RHOA、IDH2、TP53、CDKN2A遺伝子の異常に基づき、臨床像や生命予後の異なるnTFHLの4つの分子亜型[TR-I(+), TR-I(-), AC53, NSD]を同定しました。
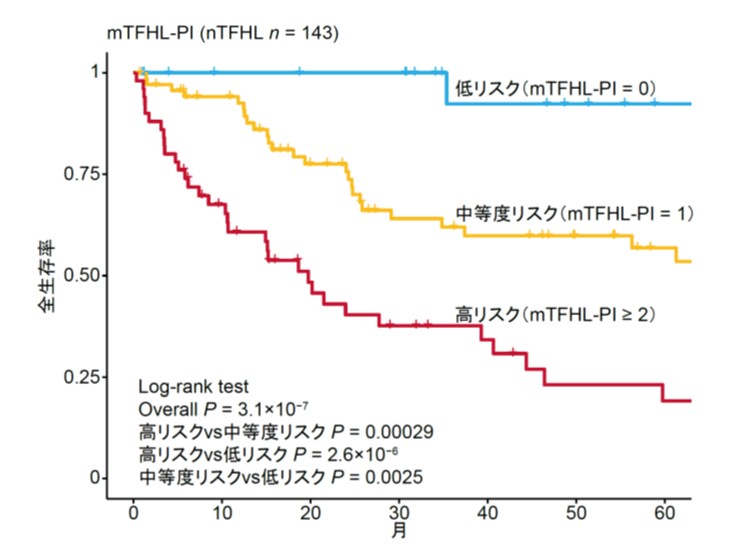
- 遺伝子異常情報と臨床因子により構成されるmTFHL-PIを開発し、nTFHLの予後が層別化されることを明らかにしました。
概要
北海道大学病院 下埜城嗣元医員 (当時)と北海道大学病院 中川雅夫講師らの研究グループは、国立研究開発法人国立がん研究センター研究所 分子腫瘍学分野 伊藤勇太(任意研修生)、慶應義塾大学医学部内科学教室(血液) 片岡圭亮教授(国立がん研究センター研究所 分子腫瘍学分野 分野長を兼任)、久留米大学医学部病理学講座 河本啓介氏、三好寛明教授、大島孝一教授らと共同で、予後不良な悪性リンパ腫のひとつである節性T濾胞ヘルパー細胞リンパ腫(nTFHL)の遺伝子異常の全体像と、それに基づいた分子分類(注1)の臨床的有用性を明らかにしました。
悪性リンパ腫は、血液を構成するリンパ球に由来する血液がんの一種です。本研究の対象であるnTFHLは、その中でもT細胞に由来する末梢性T細胞リンパ腫に分類され、病理学的にはPD1やICOS等のT濾胞ヘルパー(TFH)関連マーカーを発現し、遺伝学的にはRHOA G17VやTET2、IDH2等のエピゲノム修飾因子やT細胞受容体シグナル経路を活性化する遺伝子変異を特徴としています。nTFHLは一般的には予後不良でありながら、一部には緩徐に進行する症例も存在するなど、臨床的に不均一な疾患であり、より鋭敏な予後予測因子の探索やそれに基づいた適切な治療選択が必要です。
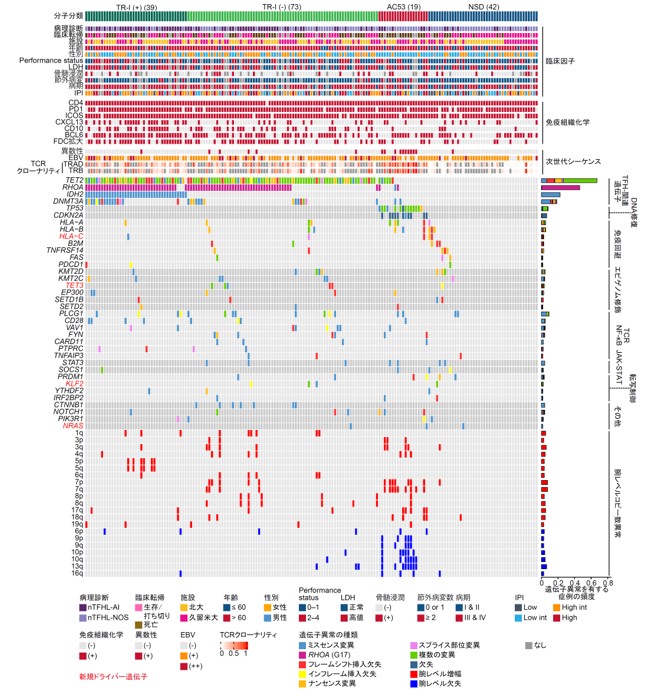
本研究では、これまでに報告されたnTFHLを対象とした遺伝子解析研究としては最大の173例を対象に、T/NK細胞腫瘍における242個のドライバー遺伝子を対象とした標的シーケンスを用いて変異(注2)とコピー数異常(注3)の解析を行いました。その結果、4個の新規遺伝子(TET3、HLA-C、KLF2、NRAS)を含む36個のドライバー遺伝子(注4)を同定し、これらの遺伝子異常の多様性がnTFHLの臨床的な不均一性と関連していることが示唆されました。
これらの解析結果に基づき、TET2、RHOA、IDH2、TP53、CDKN2A異常に着目して臨床像や生命予後の異なる4つの分子亜型からなる分子分類を作成しました。特に、TP53とCDKN2A異常を有する亜型(AC53)は極めて予後不良である一方で、これらのいずれの異常も認めない亜型(NSD)は予後が良好でした。これらの結果に基づいて、1.TP53またはCDKN2Aの異常、2.いずれかのドライバー異常、3.臨床因子である国際予後指標(IPI)(注5)の高リスク、の3項目により構成される臨床遺伝学的予後予測モデル「mTFHL-PI」を開発しnTFHLの予後が層別化されることを示しました。
本研究の成果により、nTFHLにおける遺伝子異常の全体像が明らかとなり、その情報が予後層別化に有用であることが示され、今後の個別化医療や新規治療開発の基盤となることが期待されます。
なお、本研究成果は、2025年5月2日公開の英科学誌「Leukemia」誌にオンライン掲載されました。
背景
節性T濾胞ヘルパー細胞リンパ腫(nodal T follicular helper cell lymphoma, nTFHL)は血液がんの最新の分類基準であるWHO分類第5版ではじめて導入された疾患単位です。T濾胞ヘルパー(TFH)形質を有する末梢性T細胞リンパ腫の一つであり、病理学的にはPD1やICOS等のT濾胞ヘルパー(TFH)関連マーカーを発現していることが特徴で、さらに血管免疫芽球型(nTFHL-angioimmunoblastic type, nTFHL-AI)、非特定型(nTFHL-not otherwise specified, nTFHL-NOS)、濾胞型(nTFHL-follicular type, nTFHL-F)の3病型に分類されます。
これまでの遺伝子解析研究により、nTFHL-AIにおいては、疾患特異的な変異であるRHOA G17Vやエピゲノム修飾因子であるTET2、IDH2等の変異、T細胞受容体シグナル経路を活性化するPLCG1等の変異を高頻度に認めることが報告されていますが、nTFHL全体および3つの病型における遺伝子異常の全体像や、病型間での異常パターンの違いについては十分に検討されていませんでした。
また、nTFHLの予後は一般には不良ですが、一部には緩徐に進行する症例があることが知られており、臨床的には不均一な疾患であることから、患者さん一人ひとりの病態や予後リスクを正確に把握し、治療内容を調整するなどのきめ細やかな治療選択が必要です。国際予後指標(international prognostic index, IPI)等の、臨床因子に基づいた予後予測モデルが提唱されていますが、ここに遺伝子異常情報を組み合わせることで予後測性能が改善するかどうかについては検証がされていませんでした。
そこで私達は、nTFHLを含む患者集団を対象とした遺伝子解析としては最大の173例を解析し、遺伝子異常の全体像を明らかにするとともに、臨床病理学的特徴の異なる4つの亜型からなる分子分類を作成しました。さらに、これらの遺伝子異常が予後に与える影響について検証を行いました。
研究手法
今回、北日本血液研究会(北海道大学病院を含む)と久留米大学から最新のWHO分類5版の診断基準に合致するnTFHLの検体を合計173例収集しました。これまでの遺伝子解析研究の結果を参考にして、T/NK細胞腫瘍における242個のドライバー遺伝子を対象とした標的シーケンス(平均シーケンス深度:800×)を施行しました。これらの遺伝子の変異と、TP53およびCDKN2Aを標的にするコピー数異常を解析しました。
研究成果
標的シーケンスのデータを用いて、まずは変異に着目した解析を行った結果、nTFHLでは4個の新規遺伝子(TET3、HLA-C、KLF2、NRAS)を含む35個のドライバー遺伝子が同定されました(図1)。なかでもTET2 (67%)が最も高頻度であり、RHOA (46%), IDH2 (23%), DNMT3A (18%), PLCG1 (9%), TP53 (8%), HLA-A (5%), HLA-B (5%)の変異がそれぞれ5%以上の症例で検出されました。また、コピー数解析を行うと、CDKN2Aの限局的な欠失が6%に認められました。TP53およびCDKN2Aの欠失情報を変異の情報に併せて、合計36個の遺伝子について計算すると、145例(84%)が少なくとも1つのドライバー異常を有していました。これらの結果は、nTFHLにおける遺伝的背景の多様性を示しています。
次に、これらの遺伝子異常によって、nTFHLを分類することができるか検証しました。このために、まず高頻度に認められたドライバー変異とコピー数異常を用いて階層的クラスタリングを実施し、遺伝学的に異なる4つのプロトタイプ亜型を同定しました。その後、これらのプロトタイプ亜型の特徴を参考に、より簡便で臨床的に使いやすい分類法とするために、TET2、RHOA、IDH2、TP53、CDKN2A異常に基づく4つの分子亜型[TR-I (+)、TR-I (-)、AC53、NSD]からなる分子分類を作成しました(図2)。これらの分子亜型は臨床的に明確な特徴を示しました。図2には示していませんが、特にTR-I(+)は特筆すべきことに、AC53は極めて予後不良である一方で、NSDは予後良好であり、特にドライバー異常を有さないNSD症例では極めて良好な予後を示しました(図3)。これらの知見に基づいて、1.TP53またはCDKN2A異常の有無、2.ドライバー異常の有無、3.臨床因子である国際予後指標(IPI)高リスクの3項目からなる、新しい臨床遺伝学的予後予測モデル「molecular TFHL-prognostic index (mTFHL-PI)」を作成し、0点を低リスク、1点を中等度リスク、2点以上を高リスクに分類することで、nTFHLの予後が有効に層別化されることを示しました(図4)。
今後への期待
今回の研究により、nTFHLにおける遺伝子異常の全体像を明らかにし、臨床的および遺伝学的に異なる4つの分子亜型を同定しました。さらに、臨床因子と遺伝子異常情報を統合することでより有効な予後予測スコアを構築することができました。これらの成果は、nTFHLにおける個別化医療の推進や新規治療の開発につながることが期待されます。
謝辞
本研究の遂行にあたり、東京大学医科学研究所ヒトゲノム解析センターのスーパーコンピュータSHIROKANEを利用しました。また、本研究は独立行政法人 日本学術振興会 科学研究費助成事業(JP21H05051、JP21H02775)、国立研究開発法人 科学技術振興機構 ムーンショット型研究開発事業(JPMJMS2022)、公益財団法人 武田科学振興財団の⽀援を受けて遂⾏されたものです。
研究成果(データ)
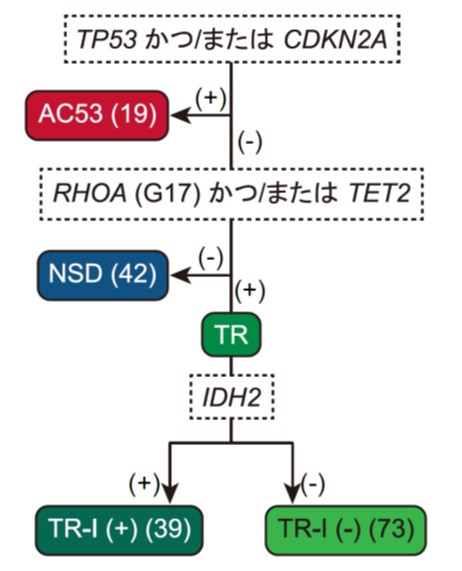
図2 ドライバー異常に基づく分子分類アルゴリズム
()内は、本研究における症例数、(+): 該当する遺伝子異常あり、(-): 該当する遺伝子異常なし
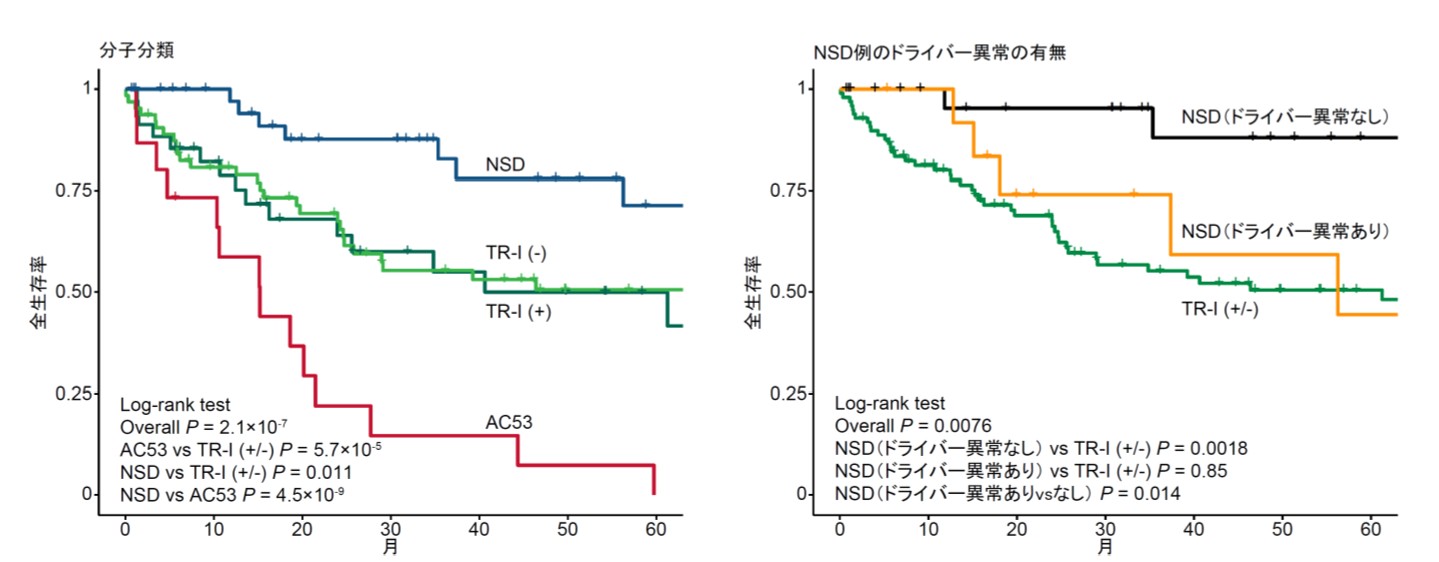
図3 nTFHLにおける分子分類(左)とNSD例におけるドライバー異常の有無(右)による全生存率
論文情報
論文名
TP53 and CDKN2A Alterations Define a Poor Prognostic Subgroup in Patients with Nodal T Follicular Helper Cell Lymphoma
著者名
Yuta Ito, Joji Shimono, Keisuke Kawamoto, Kanako C. Hatanaka, Yasunori Kogure, Mariko Tabata, Yuki Saito, Kota Mizuno, Sara Horie, Yosuke Mizukami, Junji Koya, Koichi Murakami, Takanori Teshima, Yutaka Hatanaka, Kenichi Chiba, Ai Okada, Yuichi Shiraishi, Hiroaki Miyoshi, Yoshihiro Matsuno, Koichi Ohshima, Keisuke Kataoka, and Masao Nakagawa
雑誌名
Leukemia
DOI
http://dx.doi.org/10.1038/s41375-025-02631-5(外部サイトにリンクします)
公開日
2025年5月2日
用語の説明
注1 分子分類
遺伝子異常の有無や遺伝子発現の違いといった情報によって腫瘍の亜型を分類すること。
注2 変異
ゲノムDNAに生じる異常の一種で、1から十数塩基対程度の短い挿入・欠失や一塩基置換からなる。
注3 コピー数異常
正常では2コピー(父由来・母由来)あるゲノムDNAが、1コピー以下(欠失)、あるいは3コピー以上(増幅)となっている現象。
注4 ドライバー遺伝子・ドライバー異常
異常をきたすことで、がんの発生・進行などの直接的な原因となる遺伝子のこと。がん遺伝子とがん抑制遺伝子からなる。ドライバー遺伝子に生じ、がんの発生や進行に関与する異常をドライバー異常と呼ぶ。
注5 国際予後指標(International Prognostic Index, IPI)
アグレッシブリンパ腫の予後指標の一つであり、年齢、血清LDH値、performance status、病期、節外病変数の5つの臨床因子から構成される。
お問い合わせ先
北海道大学病院血液内科
講師 中川雅夫(なかがわ まさお)
TEL 011-706-7214 FAX 011-706-7823 メール nakagawam●med.hokudai.ac.jp
報道に関するお問い合わせ先
北海道大学病院総務課総務係(〒060-8648 札幌市北区北14条西5丁目)
TEL 011-706-7631 FAX 011-706-7627 メール pr_office●huhp.hokudai.ac.jp
国立研究開発法人国立がん研究センター企画戦略局 広報企画室
TEL 03-3542-2511 メール ncc-admin●ncc.go.jp
慶應義塾大学信濃町キャンパス総務課広報
TEL 03-5363-3611 FAX 03-5363-3612 メール med-koho●adst.keio.ac.jp