胃がんに対する二次治療としてのトラスツズマブ デルクステカンが生存期間を有意に延長
2025年6月2日
国立研究開発法人国立がん研究センター
発表のポイント
- 本研究では、HER2陽性の切除不能または転移性胃・食道接合部腺がんに対し、トラスツズマブ デルクステカン(T-DXd)が、これまでの二次治療の標準治療であるラムシルマブ+パクリタキセルと比較して生存期間を有意に延長させることを確認しました。
- 全生存期間の中央値はT-DXd群で14.7カ月、ラムシルマブ+パクリタキセル群で11.4カ月であり、死亡リスクが30%減少したことを確認しました。
- 無増悪生存期間の中央値はT-DXd群で6.7カ月、ラムシルマブ+パクリタキセル群で5.6カ月であり、増悪もしくは死亡までのリスクは25%軽減されました。
- 腫瘍縮小を示す奏効割合もT-DXdで有意に上回っていました。
- T-DXd群で間質性肺疾患の頻度が高かったものの、大部分は管理可能であり、新たな安全性上の懸念は確認されませんでした。
- 本研究は、HER2陽性胃がんに対するT-DXdの二次治療における有効性・安全性を比較試験で示した意義が評価され、2025年5月31日の米国臨床腫瘍学会(ASCO, American Society of Clinical Oncology)における学会発表と同時に科学雑誌「The New England Journal of Medicine」に掲載されました。
概要
国立研究開発法人国立がん研究センター(理事長:間野 博行、東京都中央区)東病院(病院長:土井 俊彦、千葉県柏市)設楽 紘平消化管内科長らの研究グループは、HER2陽性(IHC3+もしくはIHC2+かつISH陽性)注1の切除不能または転移性胃・食道接合部腺がん(以下胃がん)に対する抗HER2抗体薬物複合体「トラスツズマブ デルクステカン(T-DXd)注2」の有効性と安全性を検証するため、グローバル規模で実施された第III相無作為化比較試験「DESTINY-Gastric04試験」を実施しました。
本試験では、トラスツズマブを含む前治療後に再生検注3を行い、HER2陽性が再確認された患者を対象に、T-DXd単剤とこれまでの標準的な二次治療である血管新生注4阻害剤ラムシルマブ+パクリタキセルを直接比較しました。その結果、T-DXdは主要評価項目である全生存期間を有意に延長し、副次評価項目である無増悪生存期間や奏効割合も有意に改善しました。安全性については、間質性肺疾患など既知の有害事象は認められたものの、大部分は低グレード注5で管理可能であり、新たな安全性上の懸念は確認されませんでした。
本研究は、HER2陽性胃がんに対するT-DXdの二次治療における有効性・安全性をグローバル規模で初めて示した意義が評価され、科学雑誌「The New England Journal of Medicine」(英国時間2025年5月31日)に掲載されました。
背景
胃がんは世界的に依然として予後不良な疾患であり、HER2陽性の胃がんは全体の5-17%程度を占めます。一次治療では化学療法に抗HER2抗体であるトラスツズマブを加えた療法が標準とされています。T-DXdは、トポイソメラーゼI阻害薬を搭載した抗HER2抗体薬物複合体であり、第II相DESTINY-Gastric01試験注6やDESTINY-Gastric02試験等により、HER2陽性胃がんの後治療としての有効性が示されてきました。特にDESTINY-Gastric01試験は、日本と韓国で実施された非盲検無作為化第II相試験であり、主要コホートでは、HER2 陽性切除不能進行・再発胃がん患者さんを対象に、T-DXdと化学療法が比較されました。日本と韓国から187例が登録され、主要評価項目である奏効割合と副次的評価項目である全生存期間の有意な改善を認めました(https://www.nejm.org/doi/10.1056/NEJMoa2004413 外部サイトにリンクします)。また欧米で行われたDESTINY-Gastric02試験は、トラスツヅマブを含む化学療法後に進行し再生検によりHER2陽性であることを確認された胃がん患者さんが対象となった単群第II相試験であり、二次治療であるT-DXdの有効性が示唆されました。今回のDESTINY-Gastric04試験は、トラスツズマブ治療歴があり、再検査でHER2陽性が確認された切除不能または転移性胃がん患者さんを対象に、T-DXdとラムシルマブ+パクリタキセルを直接比較した国際共同第III相試験です。
研究成果(方法・結果)
DESTINY-Gastric04試験では、2021年5月から2024年10月までの期間にグローバル152施設より1088例がトラスツズマブを含む前治療後にHER2検査が行われ、最終的にHER2陽性かつ適格基準を満たす計494例の患者さんがT-DXd群(246例)とラムシルマブ+パクリタキセル群(248例)に1時1分で無作為に割り付けられました。主要評価項目は全生存期間であり、副次評価項目として無増悪生存期間、奏効割合、奏効期間、安全性などが検討されました。
主要評価項目である全生存期間(図1)において、T-DXd群の中央値は14.7ヵ月(95%信頼区間:12.1-16.6ヵ月)であり、ラムシルマブ+パクリタキセル群の11.4ヵ月(95%信頼区間:9.9-15.5ヵ月)と比較して有意に延長していました。死亡リスクのハザード比は0.70(95%信頼区間:0.55-0.90, P=0.0044)であり、事前に定められたO’Brien–Fleming境界(P=0.022)を越えて統計学的有意性が確認されました。死亡リスクが30%減少したことを確認しました。
図1. 全生存期間の生存曲線
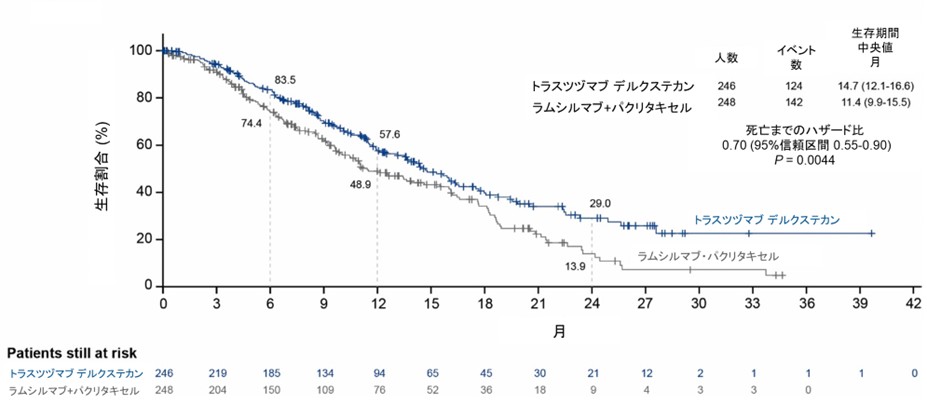
副次評価項目である無増悪生存期間(図2)においても、T-DXd群は中央値6.7ヵ月(95%信頼区間:5.6-7.1ヵ月)であり、ラムシルマブ+パクリタキセル群の5.6ヵ月(95%信頼区間:4.9-5.8ヵ月)と比較して有意に良好な結果を示しました(HR:0.74、P=0.0074)。増悪もしくは死亡までのリスクは25%軽減されました。
図2. 無増悪生存期間の生存曲線
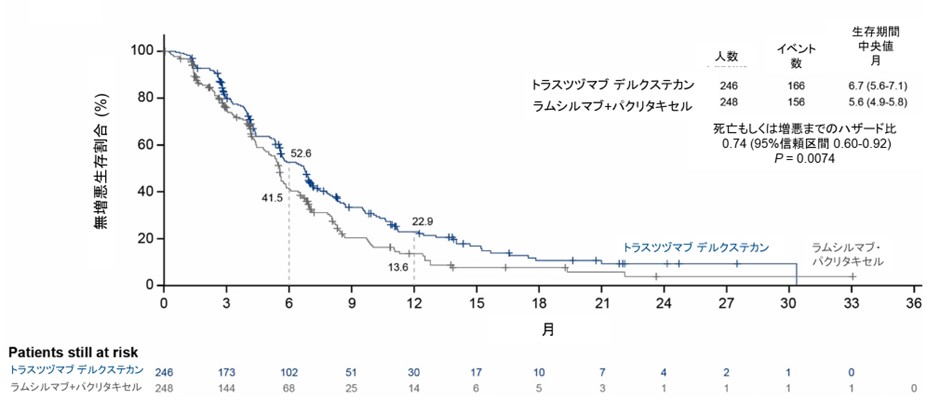
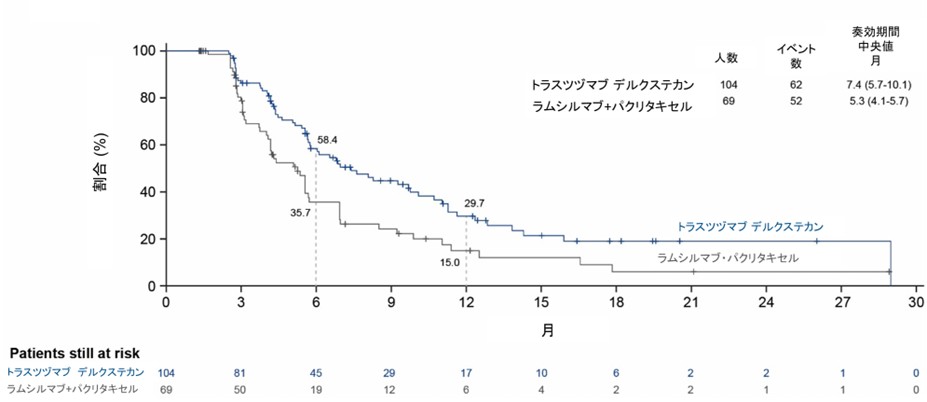
同様に副次評価項目である奏効割合は、T-DXd群で44.3%(95%信頼区間:37.8-50.9)、ラムシルマブ+パクリタキセル群の29.1%(95%信頼区間:23.4-35.3)と比較して統計学的に有意な改善が認められました(P=0.0006)。奏効期間の中央値はT-DXd群で7.4ヵ月、比較群で5.3ヵ月であり、奏効維持割合も6ヵ月時点で58.4% vs 35.7%、12ヵ月時点で29.7% vs 15.0%とT-DXd群で良好な結果でした(図3)。
図3. 奏効例における奏効持続期間の生存曲線
サブグループ解析では、大半のグループにおいてT-DXdの良好な生存延長効果が示唆されました。アジアにおいてはラムシルマブ+パクリタキセル群の後治療として41.7%の患者さんにT-DXdが使用されましたが、死亡のハザード比は0.82とT-DXd群に良好な傾向でした。
有害事象については、T-DXd群での治療関連有害事象(全グレード)は93.0%、グレード3以上は50.0%でした。ラムシルマブ+パクリタキセル群ではそれぞれ91.4%, 54.1%であり、両群に大きな差を認めませんでした。T-DXd群で多くみられたグレード3以上の有害事象は、好中球減少(28.7%)、貧血(13.9%)でした。ラムシルマブ+パクリタキセル群では好中球減少(35.6%)、貧血(13.7%)、白血球減少(12.4%)が主でした。治療中止に繋がった治療関連有害事象はT-DXd群で11.5%, ラムシルマブ+パクリタキセル群で13.3%と確認されました。T-DXd群では間質性肺疾患が13.9%と認められましたが1例のグレード3を除き、他はグレード1-2であり、致死的な症例は報告されませんでした。ラムシルマブ+パクリタキセル群では間質性肺疾患は1.3%と頻度は少なかったものの、3例がグレード3以上であり、うち1例がグレード5(死亡)でした。
患者さんから報告された健康状態/生活の質の全般的なスコアの経時的変化については、両群でほぼ同様の傾向がみられ、T-DXdがラムシルマブ+パクリタキセルと比較して全般的な健康状態や生活の質を損ねないことが示唆されました。
展望
本研究の結果により、T-DXdはHER2陽性胃・食道接合部腺がんにおける二次治療として新たな標準治療となる可能性が示され、さらに多くの患者さんにT-DXdが全世界で使用可能となることが期待されます。今後は一次治療への応用やバイオマーカー注7を活用した個別化医療の推進、さらには治療抵抗性克服を目指した新規治療戦略の開発が期待されます。
論文情報
雑誌名
The New England Journal of Medicine
タイトル
Trastuzumab Deruxtecan or Ramucirumab plus Paclitaxel in Gastric Cancer
著者
Kohei Shitara, Eric Van Cutsem, Mahmut Gümüş, Sara Lonardi, Christelle de la Fouchardière, Clélia Coutzac, Jeroen Dekervel,Daniel Hochhauser, Lin Shen, MWasat Mansoor, Bo Liu, Lorenzo Fornaro, Min-Hee Ryu, Jeeyun Lee, Cátia Faustino, Jean-Philippe Metges,Josep Tabernero, Fábio Franke, Yelena Y. Janjigian, Fabricio Souza, Lori Jukofsky, Yumin Zhao, Takahiro Kamio, Aziz Zaanan, Filippo Pietrantonio
DOI
10.1056/NEJMoa2503119
掲載日
2025年5月31日
URL
https://www.nejm.org/doi/full/10.1056/NEJMoa2503119 (外部サイトにリンクします)
研究費
研究費名(支援先)
第一三共株式会社、アストラゼネカ株式会社
研究課題名
トラスツズマブを含むレジメンの治療中又は治療後に増悪が認められたHER2陽性の治癒切除不能な進行・再発の胃腺癌又は胃食道接合部腺癌患者を対象としたトラスツズマブ デルクステカンの多施設共同2群無作為化非盲検第III相試験 (DESTINY-Gastric04)
研究代表者名
第一三共株式会社、国立がん研究センター東病院 設楽 紘平
用語解説
注1 HER2陽性胃がん
HER2発現を認める胃がんのこと。免疫染色で蛋白発現を分類し強陽性(3+)の場合か、中等度陽性(2+)かつ遺伝子増幅(ISH法による)を認める場合のこと。
注2 トラスツズマブ デルクステカン(T-DXd)
ヒト化モノクローナル抗体であるトラスツズマブとトポイソメラーゼI阻害剤であるデルクステカンを共有結合させた抗体薬物複合体の一種。
注3 生検
がん組織の一部を採取し、病理検査・HER2検査などを実施すること。胃がんの場合には、内視鏡下で胃がんから生検を採取する・転移巣から針生検を行うなどの方法がある。
注4 血管新生因子
がん細胞や正常組織における血管の新生・増殖を促進する因子のこと。
注5 グレード
副作用はCTCAE(Common Terminology Criteria for Adverse Events)の規準に従って判断される。これは、がん治療や薬剤使用による有害事象の重症度を評価するための国際的に用いられる基準である。グレード1から5までの5段階で分類され、グレードが高いほど重症度が高いことを示す。
注6 DESTINY-Gastric01試験
日本と韓国で実施された非盲検無作為化第II相試験。主要コホートではHER2 陽性(IHC3+もしくはIHC2+かつISH陽性)切除不能進行・再発胃がん、または胃食道接合部腺がん患者を対象にトラスツズマブ デルクステカンと化学療法が比較され、奏効割合と生存期間の改善を認めた。
https://www.nejm.org/doi/10.1056/NEJMoa2004413(外部サイトにリンクします)
注7 バイオマーカー
ある疾患の有無や、病状の変化・進行・治療効果などで指標となる項目(血圧、心拍数、心電図、認知機能テストなど)及び生体内の物質(タンパク質、代謝物や遺伝子など)を指す。
お問い合わせ先
研究に関するお問い合わせ
国立研究開発法人国立がん研究センター東病院
消化管内科 設楽 紘平
電話番号:04-7133-1111(代表)
Eメール:kshitara●east.ncc.go.jp
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室(柏キャンパス)
電話番号:04-7133-1111(代表)
Eメール:ncc-admin●ncc.go.jp
