胃がんに対する一次治療としての化学療法・レンバチニブ・ペムブロリズマブの併用療法を検討したLEAP15試験の結果
2025年6月2日
国立研究開発法人国立がん研究センター
発表のポイント
- 本研究では、切除不能または転移性胃・食道接合部腺がんに対する、一次治療としての化学療法レンバチニブ・ペムブロリズマブの併用と化学療法単独の場合を比較しました。
- 無増悪生存期間、奏効割合は併用群で上回っていたものの、生存期間の有意な延長は確認できませんでした。
- PD-L1陽性(Combined Positive Score 1以上)例における全生存期間の中央値は、併用群で12.6カ月、化学療法単独で12.9カ月であり、統計学的に有意な差が確認できませんでした。
- PD-L1陽性例における無増悪生存期間の中央値はPD-L1陽性例において併用群で7.3カ月、化学療法単独で7.0カ月であり、増悪もしくは死亡までのリスクは有意に軽減されました。
- 腫瘍縮小を示す奏効割合は併用群で有意に上回っていました。
- グレード3以上の有害事象の頻度は併用群で高い結果でした。
- 本研究は、胃がんに対する新たな併用療法の可能性を比較試験において検討した意義が評価され、2025年5月31日の米国臨床腫瘍学会(ASCO, American Society of Clinical Oncology)における学会発表と同時に科学雑誌「Journal of Clinical Oncology」に掲載されました。
概要
国立研究開発法人国立がん研究センター(理事長:間野 博行、東京都中央区)東病院(病院長:土井 俊彦、千葉県柏市)設楽 紘平 消化管内科長らの研究グループは、HER2陰性注1の進行・転移性胃・胃食道接合部腺がん(以下胃がん)に対し、レンバチニブ注2とペムブロリズマブ注3に化学療法を加えた新規治療レジメンの有効性と安全性を検証する国際共同第III相試験「LEAP-015試験」を実施しました。その結果、二つの主要評価項目の一つである無増悪生存期間において統計学的に有意な延長が認められましたが、もう一つの主要評価項目である全生存期間については事前に設定された有意性の閾値を満たしませんでした。
本研究は、胃がんに対するマルチキナーゼ阻害薬と免疫チェックポイント阻害薬、化学療法の併用療法の有効性を大規模に評価した初の国際共同第III相試験であり、今後の治療戦略を再考するためのデータとなると考えられ、科学雑誌「Journal of Clinical Oncology」(英国時間2025年5月31日)に掲載されました。
背景
胃がんは依然として世界的にがん死亡の主要な原因の一つであり、特に進行例では予後が不良です。近年、免疫チェックポイント阻害薬を含む一次治療の有効性が示されていますが、グローバル試験における全生存期間の中央値は依然として12-14ヵ月程度にとどまっています。血管新生を標的とする治療法の追加は、特に二次治療以降で一定の有効性が示されており、レンバチニブは血管新生に関わるVEGFR・FGFR・PDGFRなどの複数の因子を阻害する経口マルチキナーゼ阻害薬であり、非臨床試験において抑制性マクロファージの阻害等を介した腫瘍微小環境の変化を基に免疫チェックポイント阻害薬であるペムブロリズマブとの併用効果を示し、腎がん・子宮体がん等に対する臨床での併用効果も報告されてきました。さらに、国立がんセンター東病院の臨床試験グループは、レンバチニブとペムブロリズマブとの併用を進行胃がんに対する一次・二次治療として検討する医師主導治験としての第II相試験(EPOC1706)を実施し、69%の奏効割合を報告していました(https://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(20)30271-0/abstract 外部サイトにリンクします)。
LEAP-015試験はこれらの知見を基に、一次化学療法+レンバチニブ+ペムブロリズマブの併用療法を化学療法単独と比較し、その有効性と安全性を評価することを目的とした国際共同第III相試験です。
研究成果(方法・結果)
LEAP-015試験では、まず2020年12月から2021年1月までに安全性確認のためパート1に15例が登録され、化学療法であるCAPOX(カペシタビン+オキサリプラチン)またはFOLFOX(フルオロウラシル+ロイコボリン+オキサリプラチン)とレンバチニブとペムブロリズマブの併用療法の安全性が検討されました。1例でグレード注43の疲労と1例でグレード4の好中球減少が認められたものの、他に重篤な副作用を認めず、安全性が許容範囲であると判断され、ランダム化パートであるパート2が開始されました。2021年5月から2023年3月までの期間にグローバル157施設より880例の患者さんが化学療法とレンバチニブとペムブロリズマブの併用療法 (443例)もしくは化学療法単独(437例)に割り付けられました。主要評価項目は全生存期間と無増悪生存期間であり、副次評価項目として奏効割合、奏効期間、安全性などが検討されました。PD-L1のCPS(Combined Positive Score)注5は登録時に検査され、全体の約80%に相当する688例の患者さんがCPS ≥1を示していました。
主要評価項目での一つである無増悪生存期間(図1)の中央値は、PD-L1 CPS ≥1集団において併用群で7.3ヵ月、化学療法群で6.9ヵ月(ハザード比0.75、95%信頼区間: 0.62–0.90、P=0.0012)、全体集団ではそれぞれ7.2ヵ月対7.0ヵ月(ハザード比0.78、95%信頼区間: 0.66–0.92、P=0.0019)であり、無増悪生存期間の統計学的有意差が認められました。
図1. 無増悪生存期間の生存曲線(CPS ≥1集団)
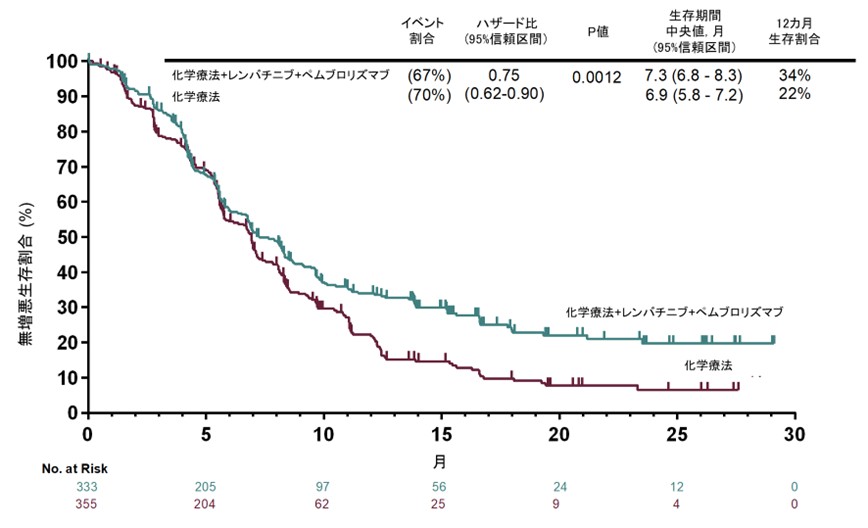
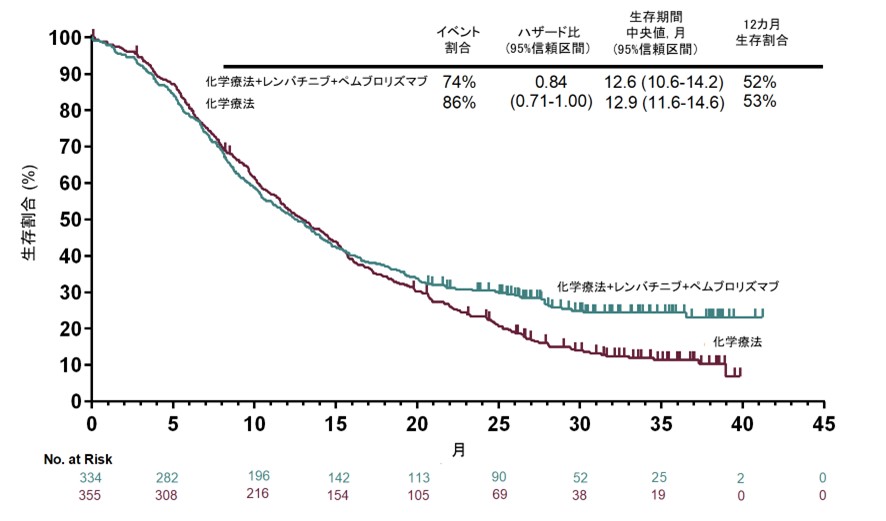
一方、もう一つの主要評価項目である全生存期間の中央値はPD-L1 CPS ≥1集団でそれぞれ12.6ヵ月対12.9ヵ月(HR 0.84、95%信頼区間: 0.71–1.00、P=0.0244)で、有意性の閾値(P=0.0204)には届きませんでした。全体集団の全生存期間は13.1ヵ月対13.0ヵ月(HR 0.87、95%信頼区間: 0.75–1.01)でした。
図2. 全生存期間の生存曲線(CPS≥1集団)
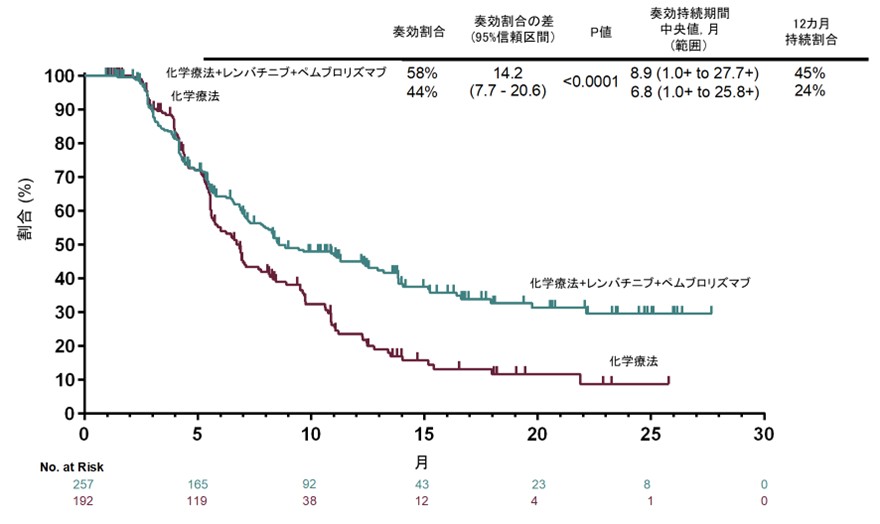
奏効割合はPD-L1 CPS ≥1集団で59.5%対45.4%、全体集団で58.0%対43.9%(いずれもP<0.0001)と有意な改善が確認されました。奏効期間の中央値は全体集団で8.9ヵ月対6.8ヵ月でした。奏効維持割合も12ヵ月時点で45% vs 24%と併用群で良好な結果でした(図3)。
図3. 奏効例における奏効持続期間の生存曲線
主要評価項目である全生存期間のサブグループ解析において、PD-L1 CPS ≥10、原発が食道胃接合部がんである症例、ECOG PS 0の集団で、併用群が比較的良好な傾向を示しました。ただし、各サブグループの解析は検出力が限定的であり、探索的な解釈にとどまります。
後治療は併用群で46%, 化学療法群で63%の患者さんに使用され、抗PD-1/PD-L1抗体(5% vs 19%)、血管新生阻害剤(19% vs 29%)は化学療法群で多い傾向でした。
全グレードの治療関連有害事象は併用群で97%、化学療法群で92%に発現しました。グレード3以上の有害事象は、それぞれ65%および48%に発現しました。治療中止を要した有害事象は併用群で20.4%、化学療法群で11.3%に認められました。頻度の高かった治療関連有害事象(全グレード)は、好中球減少症(併用群:46%、化学療法群:45%)、嘔気(39% vs 40%)、下痢(38% vs 25%)、高血圧(32% vs 0%)、食欲減退(30% vs 18%)、蛋白尿(21% vs <1%)などでした。レンバチニブ特有の高血圧および蛋白尿が併用群に多く見られました。免疫関連有害事象は併用群で46%、化学療法群で12%に発現し、グレード3以上の免疫関連有害事象は10%対1%でした。治療関連死は併用群で5%、化学療法群で<1%でした。
QOL(生活の質)については、EORTC QLQ-C30スコアを用いて評価されました。全般的な健康状態・生活の質スコアの経時的変化は、レンバチニブ併用群と化学療法単独群の間で大きな差は認められませんでした。症状尺度においては、下痢および食欲低下のスコアが併用群で一時的に悪化する傾向がありましたが、時間経過とともに回復する傾向を示しました。
展望
本試験は、化学療法と、レンバチニブ、ペムブロリズマブの併用が無増悪生存期間を有意に延長し、奏効割合も改善することを示しました。一方で全生存期間の有意差は確認されず、副作用が増加することが確認されました。この治療が最適な患者さんを同定するバイオマーカー注6研究や適正使用の検討が求められます。
雑誌名
Journal of Clinical Oncology
タイトル
Lenvatinib Plus Pembrolizumab and Chemotherapy Versus Chemotherapy in Advanced Metastatic Gastroesophageal Adenocarcinoma: The Phase III, Randomized LEAP-015 Study
著者
Kohei Shitara, Sylvie Lorenzen, Jin Li, Yuxian Bai, Manuel González Fernández, Mynor Aguilar, Hirokazu Shoji, Felipe Reyes, Yovany Rodriguez Peña, Luis Corrales, Lucjan Wyrwicz, Daniel Acosta Eyzaguirre, Yueyin Pan, Min-Hee Ryu, Deirdre J. Cohen, Zev A. Wainberg, Geoffrey Ku, Josep Tabernero, Eric Van Cutsem, Shu-Kui Qin, Do-Youn Oh, Jianming Xu, Li Wen Liang , Sonal Bordia, Pooja Bhagia, Sun Young Rha
DOI
10.1200/JCO-25-00748
掲載日
2025年5月31日
URL
https://ascopubs.org/doi/10.1200/JCO-25-00748 (外部サイトにリンクします)
研究費
研究費名(支援先)
Merck・MSD株式会社、エーザイ株式会社
研究課題名
進行又は転移性胃食道腺癌患者を対象に、一次治療としてレンバチニブ(E7080/MK-7902)+ペムブロリズマブ(MK-3475)+化学療法の有効性及び安全性を標準治療と比較する無作為化第 III相試験(LEAP-015)
研究代表者名
Merck・MSD株式会社、国立がん研究センター東病院 設楽 紘平
用語解説
注1 HER2陽性胃がん
HER2発現を認める胃がんのこと。免疫染色で蛋白発現を分類し強陽性(3+)の場合か、中等度陽性(2+)かつ遺伝子増幅(ISH法による)を認める場合のこと。今回のLEAP15試験はHER2陰性例を対象にしている。
注2 レンバチニブ
VEGFR・FGFR・PDGFRなどがん細胞や正常組織における血管の新生・増殖や、腫瘍増殖に関わる複数の酵素(チロシンキナーゼ)を阻害する経口薬。
注3 ペムブロリズマブ
PD-1(プログラム細胞死1)を標的とするモノクローナル抗体であり免疫チェックポイント阻害薬の一つである。
注4 グレード
副作用はCTCAE(Common Terminology Criteria for Adverse Events)の規準に従って判断される。これは、がん治療や薬剤使用による有害事象の重症度を評価するための国際的に用いられる基準である。グレード1から5までの5段階で分類され、グレードが高いほど重症度が高いことを示す。
注5 CPS(Combined Positive Score)
がん組織におけるPD-L1発現の程度を評価する指標の一つであり、腫瘍細胞と免疫細胞の両方に発現するPD-L1を合算して評価します。
https://www.nejm.org/doi/10.1056/NEJMoa2004413(外部サイトにリンクします)
注6 バイオマーカー
ある疾患の有無や、病状の変化・進行・治療効果などで指標となる項目(血圧、心拍数、心電図、認知機能テストなど)及び生体内の物質(タンパク質、代謝物や遺伝子など)を指す。
お問い合わせ先
研究に関するお問い合わせ
国立研究開発法人国立がん研究センター東病院
消化管内科 設楽 紘平
電話番号:04-7133-1111(代表)
Eメール:kshitara●east.ncc.go.jp
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室(柏キャンパス)
電話番号:04-7133-1111(代表)
Eメール:ncc-admin●ncc.go.jp
