小児悪性脳腫瘍において新規の遺伝子異常を発見 発症メカニズム未解明の髄芽腫の治療開発に向けた基礎研究の大きな一歩Nature誌に論文発表
2022年9月27日
国立研究開発法人国立がん研究センター
発表のポイント
- 小児悪性脳腫瘍である髄芽腫(ずいがしゅ)のうち約60%の症例では、発症メカニズムが解明されていないため、有効な治療法の研究開発が進んでいませんでした。
- 国際共同研究チームは小児の髄芽腫腫瘍検体を用いて遺伝子異常解析を行い、小脳・橋・延髄へと分化する胎児期発達脳における菱脳の菱脳唇(りょうのうしん)(注1)と呼ばれる部位で強く発現するCBFA複合体を構成する遺伝子群で遺伝子異常が生じていることを発見しました。
- 胎児期菱脳唇に存在する細胞は、CBFA複合体により神経細胞へと分化し出生時には通常消失します。CBFA複合体に異常が生じることで、神経細胞へ分化できなくなり、出生後も異常な細胞として残存し、髄芽腫に移行すると考えられました。
- 本研究成果により今まで不明であった髄芽腫の起源細胞と発生メカニズムが解明されました。分化の異常により生じることが明らかとなったため、異常細胞の予防的切除や分化誘導などを含めた、基礎研究や治療開発が進んでいくことが大きく期待されます。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)研究所(所長:間野 博行)の脳腫瘍連携研究分野 鈴木 啓道 分野長、The Hospital for Sick Children (カナダ) のDr. Michael D. Taylor、University of Manitoba (カナダ) のDr. Tamra E. Werbowetski-Ogilvie、Seattle Children’s Research Institute (アメリカ)のDr. Kathleen J. Millenを中心とした国際共同研究チームは、小児で最も頻度の高い悪性脳腫瘍である髄芽腫の約60%を占めるタイプにおいて、新しい遺伝子異常を発見しました。
悪性脳腫瘍は小児における病的死因のうち、最も多い病気です。小児悪性脳腫瘍の最も多くを占める髄芽腫は小脳に発生し、遺伝子の発現特徴などから4つのタイプ(サブグループWNT、 SHH、 Group 3、 Group 4)に分類されています。このうち全体の約60%を占めているGroup 3とGroup 4の髄芽腫は腫瘍を引き起こす原因となる遺伝子異常が十分に同定されておらず、なぜ腫瘍が生じるのか解明されていませんでした。
本研究では、545症例のヒト小児髄芽腫腫瘍検体を使用し、RNAに対するシークエンス解析を行いました。遺伝子変異の解析の結果、菱脳唇の脳室下帯と呼ばれる部位に発現が認められるCBFA複合体を形成するCBFA2T2, CBFA2T3の遺伝子に異常を同定しました。
ヒト胎児脳の一細胞レベルの発現解析データを調べると、CBFA2T2およびCBFA2T3は菱脳唇の脳室下帯と呼ばれる部位に発現が認められました。この細胞は髄芽腫とよく似た特徴を持っていることから、CBFA複合体に異常が生じることで正常な神経細胞に分化できなくなり髄芽腫が発生すると考えられました。
今まで解明されなかったGroup 3、 Group 4の髄芽腫の発症メカニズム解明の一歩となり、今後研究が進むことが期待されます。
研究結果は英国科学誌「Nature」に2022年9月21日に掲載されました。
背景
髄芽腫は最も頻度が高い小児の悪性脳腫瘍であり、治療が困難な病気です。手術・放射線・化学療法を組み合わせた非常に強い治療を行いますが、5年生存率は60から70%程度です。有効な分子標的薬がないため、治療による合併症も問題となっており、多くの生存者は機能障害や二次的ながんの発生に悩まされることになります。髄芽腫はこれまでひとつの病気と考えられていましたが、最近の研究により4つのタイプ(サブグループWNT、SHH、Group 3、Group 4)に分類され、WNT・SHH髄芽腫はそれぞれWNTシグナル伝達経路・SHHシグナル伝達経路に遺伝子異常が起こることがわかっていました。一方で、髄芽腫の約60%を占めるGroup 3とGroup 4髄芽腫では、特徴的な遺伝子異常が同定されておらず、なぜ腫瘍が発生するのか十分に解明されていませんでした (図1)。そのため今回の研究では、Group 3とGroup 4髄芽腫でどのような遺伝子異常が起きているかどのように腫瘍が発生するのか調べました。
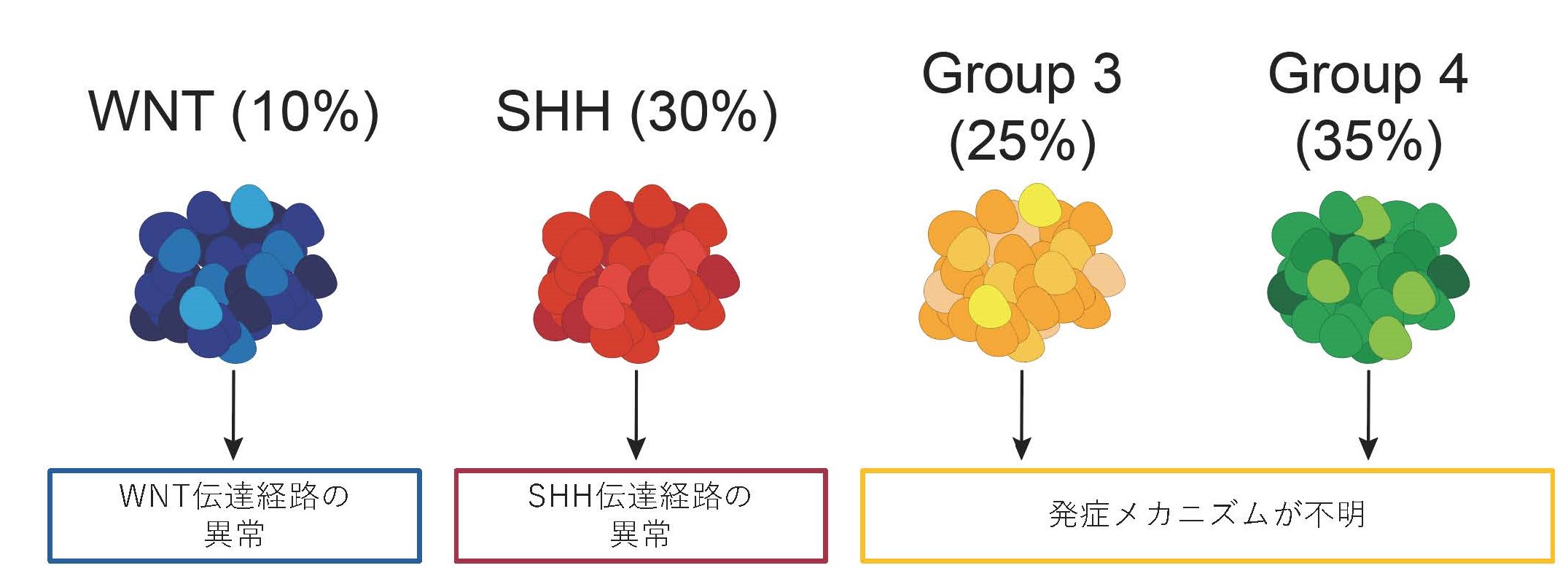
図1 髄芽腫のサブグループについて
研究方法
子供のがんは大人のがんに比べると稀なため、多くの症例を集めるには国際的な共同研究が必要です。カナダのThe Hospital for Sick Childrenを中心に髄芽腫の国際共同研究Medulloblastoma Advanced Genomics International Consortium (MAGIC) が結成され、非常に多くの髄芽腫症例に対してシークエンスを行いました。本研究では、MAGICが行ったシークエンスデータを使用し、髄芽腫を引き起こす遺伝子異常を探索しました。
1.シークエンスデータを用いた遺伝子異常解析
遺伝子異常の解析はがん細胞からDNA(注2)を取り出してシークエンスを行うことが一般的です。今回はDNAのシークエンスデータは数に限りがあったため、代わりにRNA(注3)のシークエンスデータを使用しました。RNAシークエンスを用いることで、これまでの最大規模である545症のGroup 3およびGroup 4髄芽腫の解析を行うことが可能となりました。一方で、RNAシークエンスを用いた遺伝子異常解析はDNAシークエンスに比べ精度が劣ってしまいます。そのため、解析方法に工夫を重ねることで精度の高い結果を得ることができました。その結果、これまで同定されていなかったCBFA2T2という遺伝子に変異が起きていることを発見しました。
次に、SNPアレイ(注4)を使用した染色体のコピー数異常(注5)の解析を行いました。その結果、Group 3およびGroup 4髄芽腫では、染色体16q24という場所の欠失が高頻度に起きていることを発見しました。16q24の領域にはCBFA2T3遺伝子が存在しており、この遺伝子が無くなっている症例が多く認められました。
今回異常が生じていることが発見されたCBFA2T2およびCBFA2T3遺伝子はCBFAタンパク質複合体を構成する遺伝子ファミリー(注6)に含まれる遺伝子です。CBFA遺伝子ファミリーはPRDM遺伝子ファミリーと相互作用することがこれまで報告されておりました。Group 4髄芽腫の一部の症例ではPRDM6遺伝子が高発現(注7)していることが報告されておりました。そのため、CBFA2T2、 CBFA2T3、 PRDM6は互いに協調して髄芽腫の細胞内で機能していることが推測されました (図2)。これら3つの遺伝子異常は、それぞれの症例において重複して認められることがほとんどないことから、腫瘍発生の原因となっている可能性が強く疑われました。
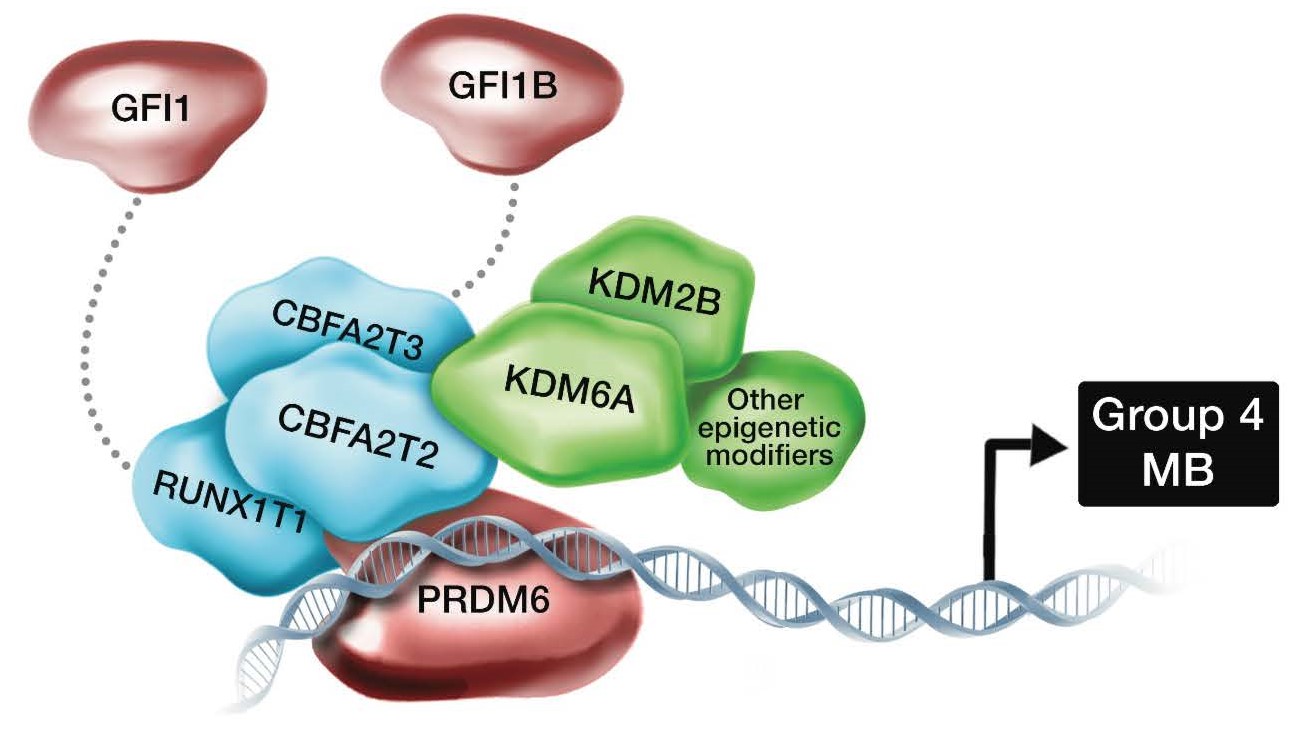
図2 CBFAタンパク複合体
2.CBFA遺伝子ファミリーの機能解析
CBFA2T2、 CBFA2T3の遺伝子については、どのような働きをしているのかこれまで十分に解明されておりませんでした。そのため髄芽腫細胞株(注8)を使用してTurboID(注9)という手法を用いることで、CBFA複合体がどのようなタンパク質に作用しているか調べました。髄芽腫細胞内でCBFA2T2のすぐ近くに存在するタンパク質を同定しパスウェイ解析(注10)を行ったところ、エピゲノム修飾(注11)と神経細胞の発達に関連するタンパク質が多く同定され、CBFA複合体の異常が神経細胞の発達に異常をきたすことが予想されました。神経の発達においてはエピゲノムの変化により細胞内の遺伝子の発現が変化し、細胞が正しく分化しますが、CBFA複合体の異常により正しい分化が妨げられている可能性が示唆されました。
3.ヒト胎児の発達脳におけるCBFA複合体の発現解析
様々な時期のヒト胎児脳に対して免疫染色(注12)を行い、髄芽腫が発生する小脳の神経細胞の分化に伴う遺伝子発現の解析を行いました。CBFA2T2およびCBFA2T3の遺伝子は菱脳唇と呼ばれる部位で発現していました。ヒトの菱脳唇は妊娠11週で急激に発達し、血管により2つに分離され、菱脳唇脳室帯(RLvz : Rhombic lip ventricular zone)と菱脳唇脳室下帯(RLsvz : Rhombic lip subventricular zone)を形成します。菱脳唇の中でもCBFA2T2とCBFA2T3は菱脳唇脳室下帯で発現しておりました。
髄芽腫およびヒト胎児脳に対する一細胞RNA-seq(注13)を行い、起源細胞(注14)の推測及び発達に伴う遺伝子発現の変化を解析しました。一細胞レベルで遺伝子発現の類似性を比較すると、Group 3髄芽腫は菱脳唇脳室帯もしくは菱脳唇脳室下帯の神経細胞とGroup 4髄芽腫は菱脳唇脳室下帯の神経細胞とよく似ていることがわかりました (図3)。この結果から、一部のGroup 3髄芽腫はより未分化な菱脳唇脳室帯から発生し、その他のGroup 3髄芽腫及びGroup 4髄芽腫は菱脳唇脳室下帯から発生していると考えられました。
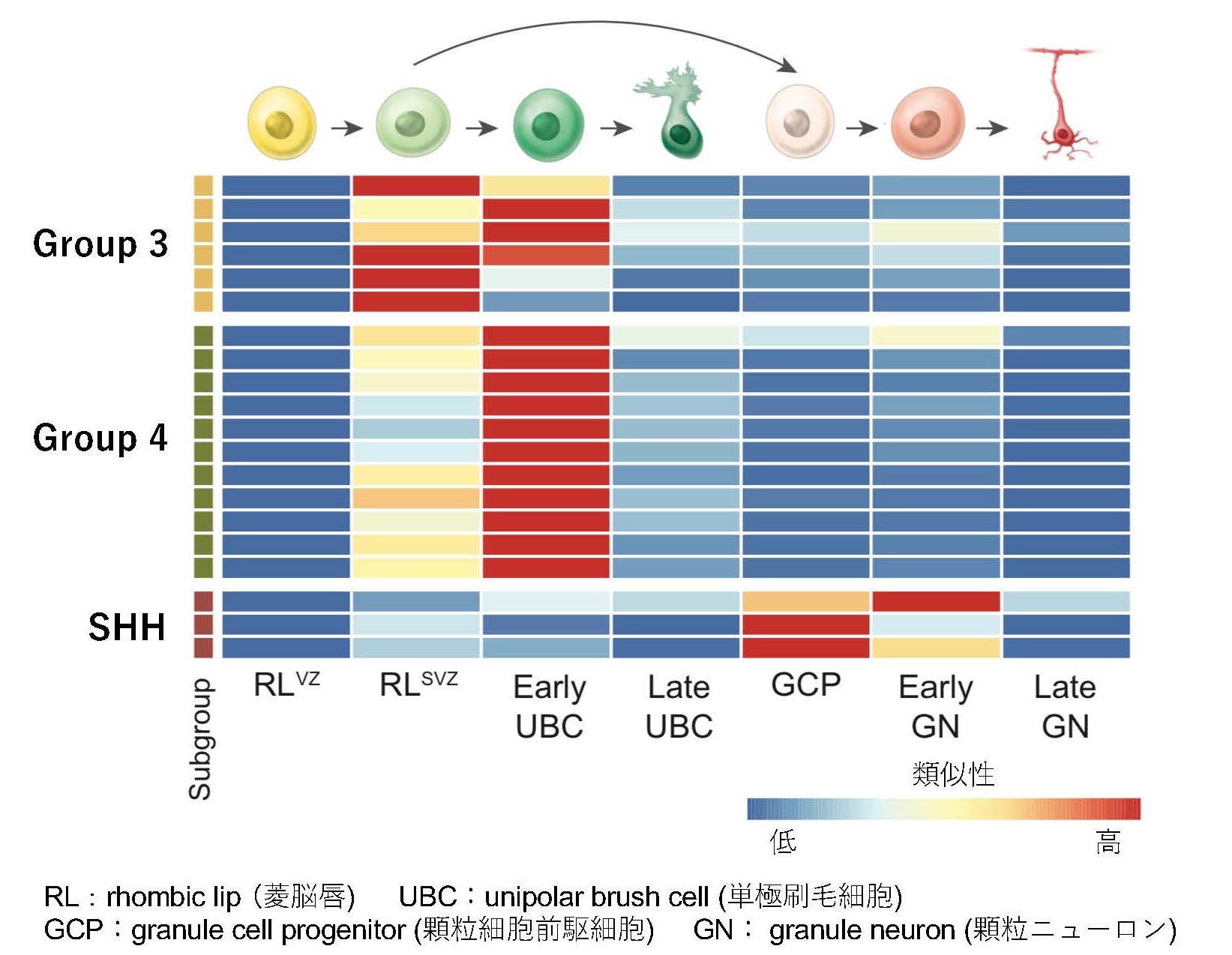
図3 髄芽腫およびヒト胎児脳に対する一細胞RNA-seqによる、起源細胞の推測及び発達に伴う遺伝子発現の変化を解析(矢印は分化の過程を表す)
OTX2はGroup 3及びGroup 4髄芽腫の一部の症例で遺伝子が高度に増幅(注15)されている遺伝子です。OTX2は菱脳唇脳室帯や菱脳唇脳室下帯で発現が亢進していましたが、CBFA2T2またはCBFA2T3を発現している細胞では発現が低下していました。さらに、CBFA複合体の異常が生じている髄芽腫ではOTX2の発現が低いことがわかりました。細胞株を用いた実験では、OTX2をノックダウン(注16)するとCBFA2T2とCBFA2T3の遺伝子発現が増加してくることから、OTX2はCBFA2T2とCBFA2T3の遺伝子発現を抑制していることがわかりました。
このことから、菱脳唇における神経細胞はOTX2、 CBFA2T2、 CBFA2T3遺伝子の発現が正しく制御されることで正常な神経細胞に分化していると考えられました。OTX2、 CBFA2T2、 CBFA2T3の異常が起こることで、神経細胞の分化が妨げられ異常な細胞となり、髄芽腫が生じると考えられました。
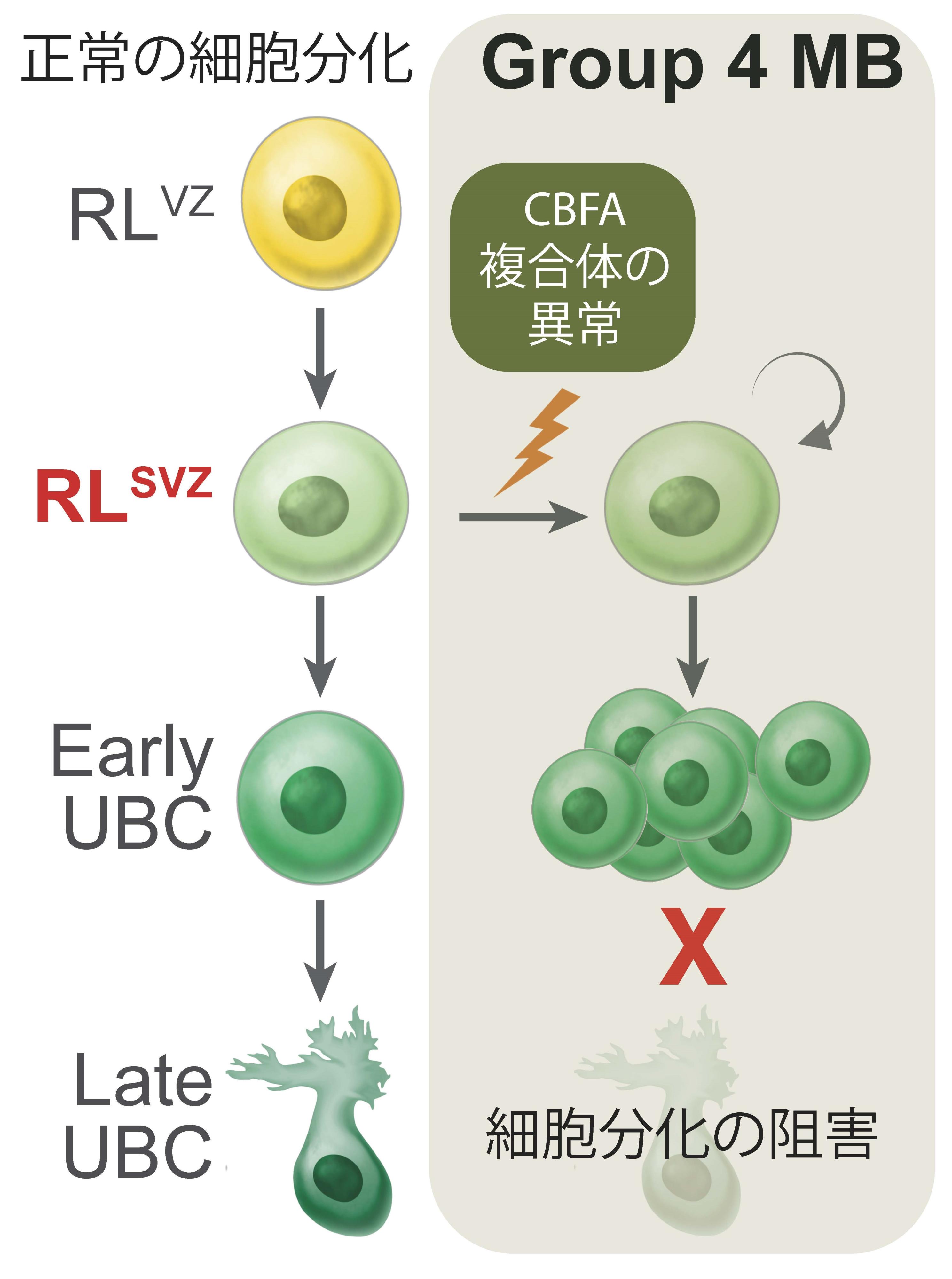
図4 今回の研究で明らかとなったGroup 4の髄芽腫の発生過程
結果
本研究により、Group 3とGroup 4髄芽腫ではCBFA複合体の遺伝子異常が生じていることが明らかになりました。またそれは胎生期の菱脳唇の神経細胞から発生していると考えられます。菱脳唇の神経細胞はOTX2、 CBFA2T2、CBFA2T3の適切な遺伝子発現により正常な神経への分化が誘導されますが、これらの遺伝子のいずれかに異常が生じることで、正常な分化ができない神経細胞が残存してしまい、この細胞が将来的に髄芽腫となると考えられます。
展望
Group 3およびGroup 4の髄芽腫では腫瘍の発生メカニズムが不明だったため、治療の開発は進んでおりませんでした。今回、我々の研究グループが髄芽腫発症のメカニズムを解明したため、治療開発にむけた基礎研究が進むと考えられます。
また、髄芽腫になりうる細胞集団が同定されたため、それらの細胞の存在を調べることが可能な方法が開発されると、髄芽腫の早期発見・早期治療介入につながる可能性があります。
発表論文
雑誌名
Nature
タイトル
Failure of human rhombic lip differentiation constitutes medulloblastoma
著者
Liam D. Hendrikse、*, Parthiv Haldipur*, Olivier Saulnier,*, Jake Millman, Alexandria H. Sjoboen, Anders Erickson, Winnie Ong, Victor Gordon, Ludivine Coudière-Morrison, Audrey L. Mercier, Mohammad Shokouhian, Raúl A. Suárez, Michelle Ly, Stephanie Borlase, David S. Scott, Maria C. Vladoiu, Hamza Farooq, Olga Sirbu, Takuma Nakashima, Shohei Nambu, Yusuke Funakoshi, Alec Bahcheli, J. Javier Diaz-Mejia, Joseph Golser, Kathleen Bach, Tram Phuong-Bao, Patryk Skowron, Evan Y. Wang, Sachin A. Kumar, Polina Balin, Abhirami Visvanathan, John J.Y. Lee, Ramy Ayoub, Xin Chen, Xiaodi Chen, Karen L. Mungall, Betty Luu, Pierre Bérubé, Yu C. Wang, Stefan M. Pfister, Seung-Ki Kim, Olivier Delattre, Franck Bourdeaut, François Doz, Julien Masliah-Planchon, Wieslawa A. Grajkowska, James Loukides, Peter Dirks, Michelle Fèvre-Montange, Anne Jouvet, Pim J. French, Johan M. Kros, Karel Zitterbart, Swneke D. Bailey, Charles G. Eberhart, Amulya A.N. Rao, Caterina Giannini, James M. Olson, Miklós Garami, Peter Hauser, Joanna J. Phillips, Young S. Ra, Carmen de Torres, Jaume Mora, Kay K.W. Li, Ho-Keung Ng, Wai S. Poon, Ian F. Pollack, Enrique López-Aguilar, G. Yancey Gillespie, Timothy E. Van Meter, Tomoko Shofuda, Rajeev Vibhakar, Reid C. Thompson, Michael K. Cooper, Joshua B. Rubin, Toshihiro Kumabe, Shin Jung, Boleslaw Lach, Veronica Ferrucci, Pasqualino de Antonellis, Massimo Zollo, Giuseppe Cinalli, Shenandoah Robinson, Duncan S. Stearns, Erwin G. Van Meir, Paola Porrati, Gaetano Finocchiaro, Maura Massimino, Carlos G. Carlotti, Claudia C. Faria, Martine F. Roussel, Frederick Boop, Jennifer A. Chan, Kimberly A. Aldinger, Ferechte Razavi, Evelina Silvestri, Roger E. McLendon, Eric M. Thompson, Marc Ansari, Maria L. Garre, Fernando Chico, Pilar Eguía, Mario Pérezpeña, A. Sorana Morrissy, Florence M.G. Cavalli, Xiaochong Wu, Craig Daniels, Jeremy N. Rich, Steven J.M. Jones, Richard A. Moore, Marco A. Marra, Xi Huang, Jüri Reimand, Poul H. Sorensen, Robert J. Wechsler-Reya, William A. Weiss, Trevor J. Pugh, Livia Garzia, Claudia L. Kleinman, Lincoln D. Stein, Nada Jabado, David Malkin, Olivier Ayrault, Jeffrey A. Golden, David W. Ellison, Brad Doble, Vijay Ramaswamy, Tamra E. Werbowetski-Ogilvie#, Hiromichi Suzuki#, Kathleen J. Millen#, Michael D. Taylor# (*:共同第一著者、#:共同責任著者)
掲載日
2022年9月21日
DOI
10.1038/s41586-022-05215-w
URL
https://www.nature.com/articles/s41586-022-05215-w(外部サイトにリンクします)
研究費
- 国立がん研究センター研究開発費(2021-A-1) (研究代表者 鈴木啓道)
- 科学研究費助成事業 研究活動スタート支援 (21K21001) (研究代表者 鈴木啓道)
用語解説
(注1)菱脳唇
ヒトの脳は母親のおなかの中にいる時から発達している。発生の初期には前脳、中脳、菱脳に別れ、菱脳は出生時には小脳・橋・延髄になる。菱脳唇は菱脳の一部であり、神経へと分化する細胞が多く存在している。
(注2) DNA
ヒト細胞の核の中の染色体という場所にある遺伝子の主体となる成分で、A(アデニン)、T(チミン)、G(グアニン)、C(シトシン)の4種類の核酸と呼ばれる要素からできている。ヒトの体の設計図はこのDNAの配列で記録されている。
(注3)RNA
DNAと同じく細胞核の中に存在している。A(アデニン)、G(グアニン)、C(シトシン)、U(ウラシル)の四種の塩基を含む。DNAを転写した一本鎖で構成され、DNAに記録されている情報の伝達やタンパク質の合成を行う。
(注4) SNPアレイ
ヒトの遺伝子配列は、SNP(一塩基多型)と呼ばれるDNA配列が1塩基だけ異なる部位が多数認められ、その違いが個性や体質に関連していると考えられている。SNPアレイはこのSNPを一度にたくさん調べる手法であり、応用することで染色体の数を調べることができる。
(注5) コピー数異常
ヒトの細胞には正常であれば父由来および母由来の2本(2コピーという)の染色体がある。腫瘍細胞で遺伝子の異常により、特定の領域が欠けて染色体が1本や0本になってしまったり、あるいは増えて3本やそれ以上に増幅してしまっている異常の総称。
(注6)遺伝子ファミリー
似た機能を有する遺伝子の集まりのこと。生物の進化の過程で、ひとつの遺伝子が重複して子孫に受け継がれるなどして、複数存在するようになったと考えられる。
(注7) 高発現
遺伝子の持っている遺伝情報がRNAやタンパク質として現れることを発現といい、遺伝子異常やその他の要因などによりその発現が正常よりも高くなっている状態を高発現という。
(注8) 髄芽腫細胞株
髄芽腫細胞を採取し、それを細胞の増殖に必要な栄養素が含まれる培地で人工的に培養して研究用に確立された(株化された)腫瘍細胞のこと。一般的には生体内の腫瘍細胞と性質が類似していることが確認できているもののことを指す。
(注9) TurboID
目的とするタンパク質を特殊な分子で標識することにより、異なる細胞・組織・発生段階などにおけるタンパク質の相互作用を解析する手法。
(注10) パスウェイ解析
遺伝子はヒトの体の中で単一で機能するわけではなく、複数の遺伝子やタンパク質と共同でお互いの作用を高めたり抑制したりすることによってその機能の調整や信号の伝達を行っている。相互作用する特定の遺伝子群による経路をパスウェイと呼び、発現が増加または現象した遺伝子群がどのパスウェイに多く含まれていたかを調べる解析手法のこと。
(注11) エピゲノム修飾
DNAによって表される遺伝情報全体のことをゲノムと呼び、そのゲノムの配列を変更せずに加えられた修飾のことを指す。様々な修飾パターンが認められるが、これらによりDNAが記録している遺伝子の発現を制御・調節して細胞が正常に機能するようにしている。
(注12) 免疫染色
観察したいタンパク質が持っている抗原という目印に対して、それと結合する抗体を用いて、目的のタンパク質のみを染色する手法のこと。この手法を用いることでどの細胞でタンパク質が発現しているか調べることができる。
(注13) 一細胞RNA-seq
ひとつひとつの細胞レベルでの遺伝子発現をみるRNAシークエンスの手法。通常のRNAシークエンスは組織レベル(たくさんの細胞をまとめて解析)で行うため、複数の細胞の遺伝子発現が集合した平均値を見ている事になり、その組織を構成する細胞1つ1つがどのような特徴をもっているかは解析できない。そのため一細胞レベルでのRNAシークエンスを行うことで細胞ごとの機能的特徴の違いや細胞の分類などを行う。
(注14) 起源細胞
腫瘍はもともと正常細胞であったものが何かしらのきっかけにより異常な増殖をし始めることにより発生する。この腫瘍が発生する起源の正常細胞のことを起源細胞と呼ぶ。
(注15) 増幅
正常細胞では遺伝子は通常2つ(常染色体または女性の性染色体)または1つ(男性の性染色体)存在する。腫瘍細胞では、特定の遺伝子の数が異常に増加することがあり、これを遺伝子増幅と呼ぶ。
(注16) ノックダウン
目的のRNAの機能を調べるため、細胞株に人工的な操作を加えて目的のRNAの機能を一時的に低減させる手法のこと。
問い合わせ先
研究に関する問い合わせ
国立研究開発法人国立がん研究センター
研究所 脳腫瘍連携研究分野
鈴木 啓道
電話番号: 03-3542-2511(代表) Eメール: hiromics●ncc.go.jp
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
電話番号: 03-3542-2511(代表) Eメール: ncc-admin●ncc.go.jp
