全ゲノム解析により胃がんの新たな発がん機構を解明
2023年6月23日
国立研究開発法人国立がん研究センター
発表のポイント
- 臨床情報が付随した胃がんの大規模な全ゲノム解析により、染色体構造異常の全体像と、新たな発がん機構として注目されている染色体外DNAが胃がんの発生に寄与していることを初めて明らかにしました。
- 本研究をさらに発展させることにより、胃がんの予防・診断・治療開発の新たな戦略となることが期待されます。
- 今回明らかにした染色体外DNAは胃がんの新たな治療標的や分子マーカーとなる可能性があります。がん遺伝子パネル検査では検出できないことから、今後全ゲノム解析を活用した新たな検査法の開発が期待されます。
概要
国立研究開発法人国立がん研究センター (理事長:中釜 斉、東京都中央区) 研究所(所長:間野博行) がんゲノミクス研究分野分野長 柴田龍弘らの研究チームは、臨床情報が付随した170症例の胃がん全ゲノム解読データを用いて、染色体の増幅や欠損といった染色体構造異常の全体像を明らかにしました。また胃がんの染色体構造異常には特徴的な6種類のパターンがあることを見出し、喫煙の有無やドライバー遺伝子との関連などその発生機序を推定しました。
更に全ゲノム解析データから染色体外DNA (Extra-chromosomal DNA: ecDNA)を同定することに成功し、ecDNAがFGFR2,ERBB2, CCNE1といった既知のがん遺伝子の高度増幅を引き起こし、胃がんの発生・進展に重要な役割を果たしていることを明らかにしました。
全ゲノム解析によって明らかとなった胃がんの染色体構造異常の要因を解明することで新たな予防研究への展開が期待され、また染色体外DNAは胃がんの新たな治療標的や分子マーカーとなる可能性があります。本研究をきっかけとして全ゲノム解析の医療現場への活用が期待されます。
本研究成果は、英国科学雑誌「Nature Communications」に、英国時間2023年6月22日(日本時間同日)付で掲載されました。
背景
これまでの胃がんのゲノム解析と医療現場への活用状況
胃がんは、日本における罹患者数 (2019年)と死亡数 (2021年)がともに3位と上位に位置する対策が極めて重要ながんであり(出展:国立がん研究センターがん情報サービス)、その予防・診断・治療に向けた研究が強く期待されています。
がんにおける遺伝子異常は、大きく点突然変異に代表される塩基置換と、染色体転座や逆位などに代表される染色体構造異常に分類できます。胃がんは消化器がんの中でも染色体構造異常が多いがんの一つとして知られていましたが (PCAWG, Nature 2020)、その全体像はこれまで十分明らかにされていませんでした。その理由の一つとして、多数の胃がん症例の全ゲノムデータを集積し、精度の高い解析ツールで統一的に解析した研究が無かったことが挙げられます。
現在医療現場で使用されているがん遺伝子パネル検査は標的遺伝子の変異を把握することに長けていますが、胃がんのゲノム異常に多いとされている染色体構造異常については検出ができません。今回用いた全ゲノム解析は、遺伝子異常について網羅的に検出することができ、がん遺伝子パネル検査で検出できる点突然変異のほか、染色体構造異常や染色体外DNA(ecDNA)の検出が可能です(表1)。
表1 がん遺伝子パネル検査と全ゲノム解析の比較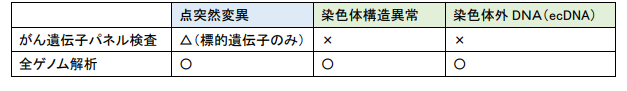
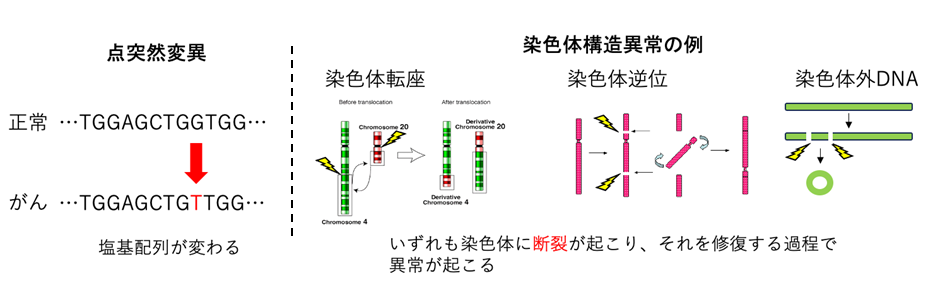
図1 点突然変異、染色体構造異常の例の模式図
染色体構造異常の種類とパターンについて
がんゲノムにおける染色体構造異常には、あるゲノム領域が欠失する(deletion)、反転する (inversion)、重複する (duplication)、他の染色体との融合(染色体転座:translocation)やトランスポゾンによる転位 (transposition)といったパターンがあり(図1)、更にこうした異常が複数同時に起こる複雑なパターン (崩壊と再編成:Chromothripsis、連環染色体断裂融合:Chromoplexy)があることが知られています。染色体構造異常によって、ドライバー遺伝子の増幅や欠失、あるいは融合遺伝子が生成され、発がんに寄与することが知られています。しかしどのような発がん要因によってこうした染色体構造異常が起こるのか、またそのパターンに特定の偏りがあるのかについては十分に解明されていません。染色体構造異常の種類に加え、発生した領域のサイズやエピゲノム情報などを使って染色体構造異常を分類し、数学的に得られた特徴的なパターンのことを染色体構造異常シグネチャー (SV signature)と呼びます。
染色体外DNA(ecDNA)について
最近の研究から、がん細胞において、染色体DNAの一部が断裂後、環状になり、染色体とは別に複製、増幅し、細胞分裂時に分配されるという機構が発見され、染色体外DNA (Extra-chromosomal DNA: ecDNA)と呼ばれています(図2)。ecDNAはしばしば高度に(10コピー以上)コピー数を増やすことから、環状DNAにがん遺伝子が含まれていた場合、発がんの大きな駆動力になることが推定されます。また染色体と異なり、細胞分裂時の分配がランダムに起こることから、がん細胞の多様性創生においても重要な鍵となる機構です。しかし、これまで胃がんでのecDNAの意義や役割については明らかになっていませんでした。ecDNAは蛍光物質をつけたプローブ(標的遺伝子と相補的な塩基配列を有する合成遺伝子)を標的遺伝子と結合させ、蛍光顕微鏡下で可視化する手法であるFISH(Fluorescence in situ hybridization)法によって核内に点状に確認できる他、一部のecDNAは再び染色体に再挿入され、FISH 法で強く染まるHomogeneous Staining Region (HSR)として確認できます。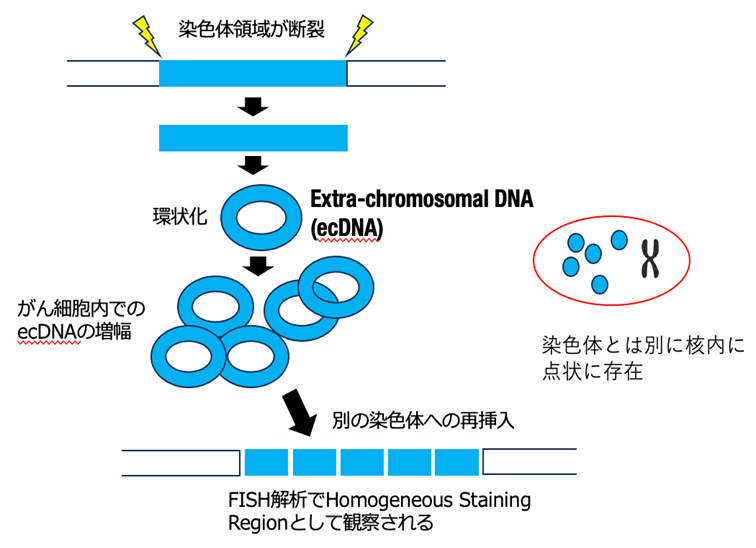
図2 染色体外DNA (ecDNA)の生成
研究方法
アジア人の胃がん170症例(日本81症例、香港89症例)のショートリード全ゲノム解読データに対して、独自に開発したツール (callallSV)を適用し、全部で49,059箇所の染色体構造異常を同定しました。その中には、22,179 個の欠失 (deletion)、 11,234 個の重複(duplication)、 8,534 個の反転(inversion)、7,112 個の染色体転座(translocation)が含まれていました。また局所的に染色体構造異常が密集している領域について、そのパターンを解析し、FISH法での確認を行いました。
研究結果
1.胃がん全ゲノム解析による染色体構造異常のパターンの発見
染色体構造異常を、その種類、サイズ、局所的集中度、エピゲノム情報によって分類し、数学的手法(NMF)を用いて、染色体構造異常シグネチャー (SV signature)の抽出を行いました。その結果胃がんには特徴的な6種類の染色体構造異常シグネチャー(RS1~6)があることを見出しました(図3)。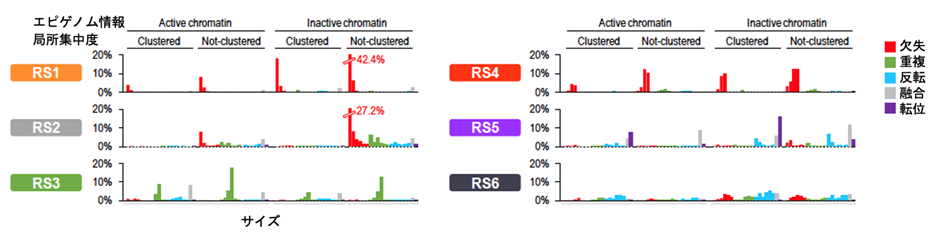
図3 胃がんに見られた染色体構造異常シグネチャー
今回の解析で胃がんに見られた6種類の染色体構造異常シグネチャー (RS1~6)を示す。
更に各染色体構造異常シグネチャーの貢献度を用いて全症例を分類した所、各染色体構造異常シグネチャーで特徴づけられる7つの胃がんサブグループが同定できました (RS1~6がそれぞれ多いものと、RS2とRS6の混合型の7つ)。この結果は、各染色体構造異常シグネチャーはランダムに起こるのではなく、それぞれのパターンが限定して起こりやすい症例があることを示しています。更に臨床データやドライバー遺伝子との相関について調べたところ、こうしたサブグループは特定のドライバー遺伝子異常(BRCA異常、TP53変異、マイクロサテライト不安定性)、胃がんの組織型(びまん型)、喫煙の有無と相関しており(図4)、これらが染色体構造異常シグネチャーの発生に関連していることが推定されました。
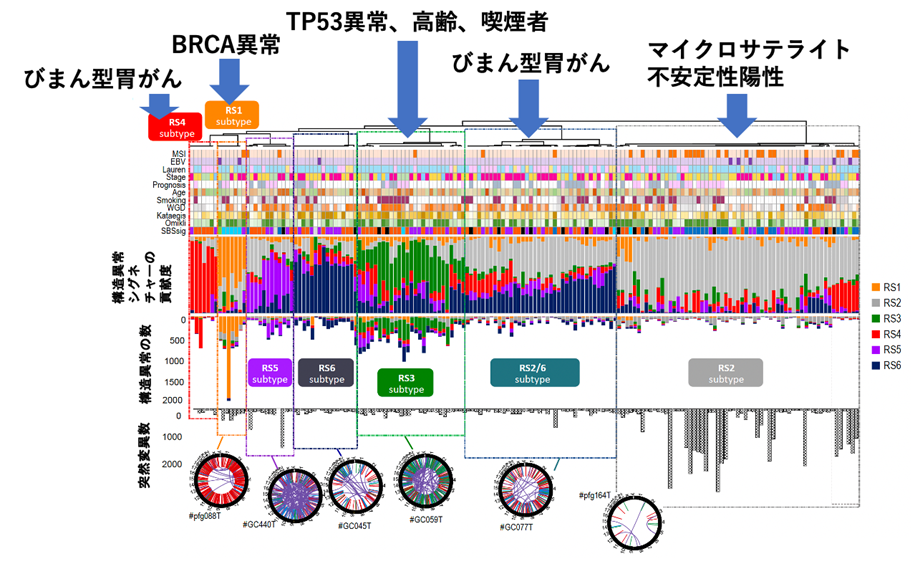
図4 染色体構造異常シグネチャーによる胃がん分類
RS1~6の貢献度によって7つのグループに分けられ、特徴的なドライバー異常や臨床的背景との相関を示す。
2.胃がんにおける染色体外DNA (ecDNA)の同定
次に局所的に染色体構造異常が密集している領域の解析を行いました。ヒトゲノム上には染色体構造異常が起こりやすい脆弱な領域 (Common Fragile Site: CFS)が知られており、こうした領域では染色体欠失を中心とした染色体構造異常が集中していました (CFS型)。一方で複製時エラー(non-allelic homologous recombination-mediated duplication:NAHRD)や染色体断裂による分配異常(breakage-fusion-bridge cycles: BFBC)に伴う局所的な染色体構造異常集中領域には染色体増幅が多くみられました。
更に本研究では、こうした既知の分子機構では説明できない新たな構造異常パターンを発見しました。このパターンは環状DNAが存在する際の特徴を示すことから、染色体外DNA (Extra-chromosomal DNA: ecDNA)による機構の寄与が疑われました(図5)。そこで該当症例についてFISH法による確認を行い、ecDNAとして胃がん細胞に存在していることを確認しました(図6)。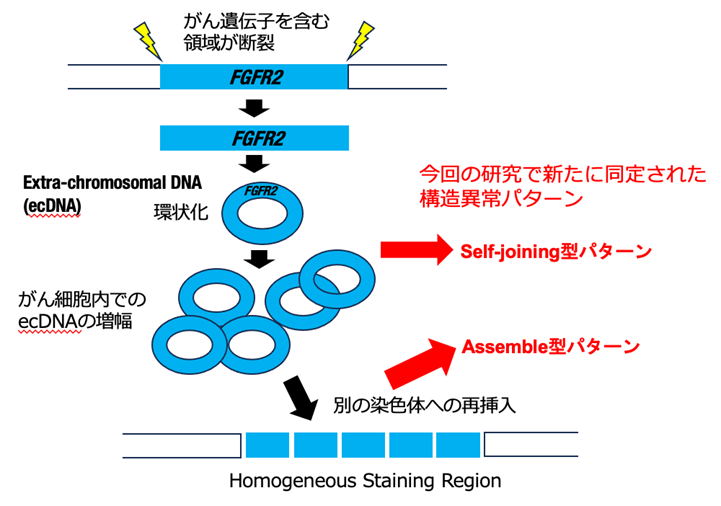
図5 今回同定した新たな構造異常シグネチャーとecDNAとの関連
未知の原因により生成した染色体断片が環状となるとSelf-joining型と呼ぶ特徴的なパターンが発生し、更に環状DNAが染色体に再挿入されるとAssemble型と呼ぶパターンが発生する。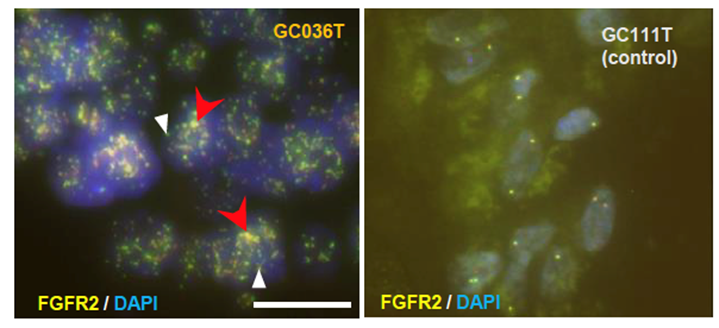
図6 FISH法によるecDNAの検証
全ゲノム解析データの解析からFGFR2遺伝子を含んだecDNAの存在が示唆された症例についてFISH解析を行った(左)。その結果FGFR2遺伝子を含む領域(黄色)ががん細胞内に点状に分布し(白矢頭)、染色体に再挿入されたHSR(赤矢印)も確認できる。本症例を含め検討した全ての症例でecDNAが確認できた。右はecDNAが無い症例のFISH法の結果を示す。
胃がんにおけるecDNAはFGFR2、ERBB2、CCNE1といった既知のがん遺伝子を含み、その高度な遺伝子増幅に寄与していることを明らかにしました。中でもFGFR2遺伝子にはecDNAによる増幅が多いことも観察されました(図7)。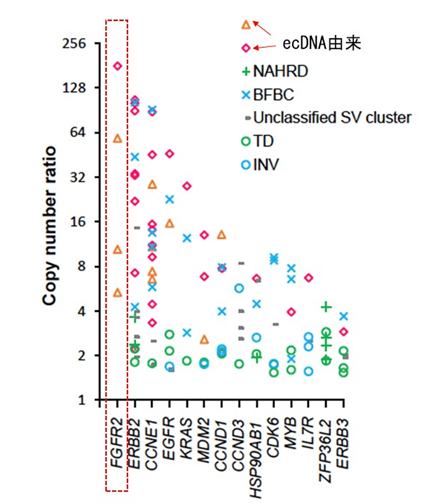
図7 胃がんにおける遺伝子増幅の分子機構
複数症例において観察できた遺伝子増幅の分子機構一覧。ecDNA由来の増幅はオレンジ三角と赤ダイヤモンドで示す。FGFR2は増幅のあった4例全てがecDNA由来であった(赤点線四角)。
ecDNAを含む局所的な染色体構造異常密集領域には、胃がんにおけるがん遺伝子が多数含まれていました(図8青丸)。一方で密集は見られるものの、これまでに明らかながん遺伝子の存在を指摘されていない領域(図8赤丸)も見いだされ、こうした領域には新規の胃がんドライバー遺伝子が存在している可能性が示唆されました。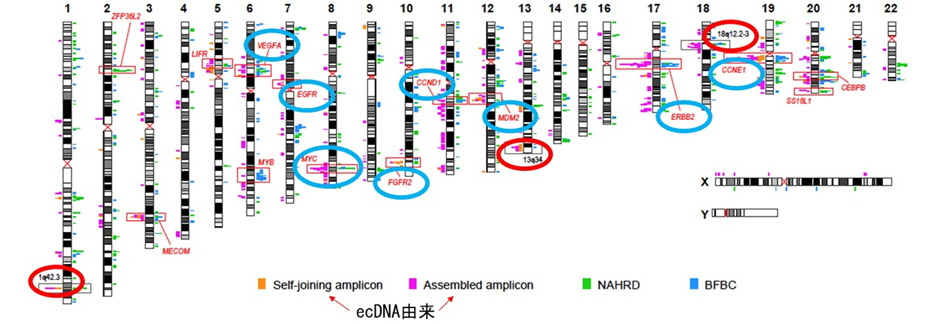
図8 胃がんにおける染色体増幅の全体像
遺伝子増幅について分子機構によって色分けをし、ゲノム全体における分布を示す。四角で囲った領域は特に陽性症例が多く、かつ胃がんのドライバー遺伝子(遺伝子名を記載、主なものを青丸で示す)を含んでいる。一方で、増幅が集積しているが、既知のがん遺伝子が存在していない領域(赤丸)も見いだされた。
展望
本研究では臨床情報が付加された大規模な胃がん全ゲノム解析データを活用することで、胃がんの染色体構造異常の全体像を明らかにできました。胃がんの染色体構造異常には一定のパターンが存在し、特徴的な臨床背景と相関していることが初めて明らかになりました。今後は、その要因を解明することで新たな予防研究への展開が期待されます。
また、全ゲノム解析によって染色体外DNAが胃がんの重要なドライバー遺伝子異常に寄与していることを明らかにできました。今回の研究ではショートリード解析のみですが、今後ロングリード解析(注)を追加することで、より詳細な検討を行うことができます。具体的には、未知である染色体外DNAの発生機序の解明によって胃がん発生の引き金となる要因を解明できる可能性があります。近年、染色体外DNAは予後不良や治療抵抗性といった悪性形質と関連することが報告されており、今後胃がんの診断や治療において染色体外DNAが新たな治療標的や分子マーカーとなる可能性があります。
本研究によって、現在医療現場で使用されているがん遺伝子パネル検査だけでは検出できない遺伝子異常が全ゲノム解析で発見できることが示されました。全ゲノム解析を医療現場に活用するためには、コスト・技術・結果の解釈など様々な面で検討する余地がありますが、本研究をきっかけとして全ゲノム解析の医療現場への活用が進むことが期待されます。
発表論文
雑誌名
Nature Communications
タイトル
Oncogenic structural aberration landscape in gastric cancer genomes
著者
Mihoko Saito-Adachi, Natsuko Hama, Yasushi Totoki, Hiromi Nakamura, Yasuhito Arai, Fumie Hosoda, Hirofumi Rokutan, Shinichi Yachida, Mamoru Kato, Akihiko Fukagawa, Tatsuhiro Shibata
DOI
10.1038/s41467-023-39263-1
URL
https://www.nature.com/articles/s41467-023-39263-1(外部サイトにリンクします)
掲載日
2023年6月22日(日本時間同日)付
研究費
- 革新的がん医療実用化研究事業 (国立研究開発法人日本医療研究開発機構):国際共同研究に資する大規模日本人がんゲノム・オミックス・臨床データ統合解析とゲノム医療推進に向けた知識基盤構築
- 国立がん研究センターがん研究開発費 (2020-A7)
用語解説
(注)ロングリード解析
従来の次世代シークエンサーではDNAを断片化して、その両端の短い配列を解読する(ショートリード解析)という手法であったが、新技術であるロングリード解析では長いDNA(数万塩基単位)をそのまま解読することができる。この技術は最新のヒトゲノム完全長解読 (telomere-to-telomere)にも応用されている。
問い合わせ先
研究に関する問い合わせ
国立がん研究センター研究所
がんゲノミクス研究分野 分野長 柴田 龍弘
Eメール:tashibat●ncc.go.jp
広報窓口
国立がん研究センター企画戦略局 広報企画室
電話番号:03-3542-2511(代表)FAX:03-3542-2545
Eメール:ncc-admin●ncc.go.jp
