標的タンパク質分解誘導薬E7820の腫瘍縮小効果をJ-PDX(日本人がん患者由来組織移植モデル)で確認し、医師主導治験を開始新規抗がん剤開発を加速させる創薬研究システムの確立をめざす
2024年9月12日
国立研究開発法人国立がん研究センター
エーザイ株式会社
In English
発表のポイント
- エーザイの標的タンパク質分解誘導薬E7820のがん種横断的な薬効評価を、患者由来のがん組織を免疫不全マウスに移植した患者由来組織移植(PDX)モデル(膵がん、胆道がん、胃がん、子宮体がん)で実施し、全体では1%、胆道がんでは58.3%、子宮体がんでは55.6%で腫瘍の縮小を観察しました。
- PDXモデルは治療効果の予測精度が高く、臨床データとPDXモデルの反応性の間に高い類似性があることから、本研究結果は胆道がんおよび子宮体がんにおけるE7820の腫瘍縮小効果を示唆しています。
- PDXモデルの全エクソンシークエンスを行い、E7820の有効性予測バイオマーカーとして期待できる遺伝子変異を同定しました。
- 本研究成果は、査読付き学術誌「npj Precision Oncology」に掲載されました。
- 本研究で明らかとなったE7820の有効性が期待されるがん種とバイオマーカーの情報に基づいて、国立がん研究センター中央病院と東病院で、日本人における忍容性を含む安全性評価と探索的な有効性評価を目的とした医師主導治験を開始します。
- 創薬開発に国立がん研究センターのJ-PDX(日本人がん患者由来組織移植モデル)ライブラリーを用いることで、がん種毎の薬効評価と有効性予測バイオマーカーの同定、さらには臨床試験の立ち上げまでを一気通貫で速やかに実現することが可能となりました。今後、このような事例を積み重ね、新規抗がん剤開発を加速させる創薬研究システムとしての確立をめざします。
概要
国立研究開発法人国立がん研究センター(所在地:東京都中央区、理事長:中釜 斉、以下国立がん研究センター)とエーザイ株式会社(本社:東京都文京区、代表執行役CEO:内藤 晴夫、以下エーザイ)は、新規抗がん剤開発を加速させる創薬研究システムの確立をめざし、国立研究開発法人日本医療研究開発機構(AMED)の医療研究開発革新基盤創成事業(CiCLE)の支援により、「希少がんならびに難治性がんに対する抗がん剤治療開発を加速させる創薬研究手法に関する研究」を2021年より実施しています。
本研究において、国立がん研究センターとエーザイは、エーザイ創製の新薬候補E7820について、国立がん研究センター研究所(所長:間野 博行)が構築している日本人がん患者由来の腫瘍組織を免疫不全マウスに移植した動物モデルであるJ-PDXのライブラリーを用いて非臨床試験を行い、42のPDX注1モデル(膵がん12モデル、胆道がん12モデル、胃がん9モデル、子宮体がん9モデル)で薬効を評価しました。
その結果、E7820 100 mg/kg投与によって42モデル中16モデル(38.1%)、胆道がんでは12モデル中7モデル(58.3%)、子宮体がんでは9モデル中5モデル(55.6%)で、腫瘍の縮小が観察されました。PDXモデルは治療効果の予測精度が高く、臨床データとPDXモデルの反応性の間に高い類似性があることから、本研究の結果は胆道がんおよび子宮体がんにおいてE7820の腫瘍縮小効果を示唆しています。
さらに、E7820の腫瘍縮小効果と相関するバイオマーカー注2を探索するため、PDXモデルの全エクソンシークエンス注3を実施したところ、腫瘍縮小効果が認められたPDXモデルにおいては、BRCA1、BRCA2またはATMといった、DNA修復機構の一つである相同組換え修復(HRR)関連遺伝子注4の変異が高頻度に認められ、当該遺伝子変異がE7820の有効性のバイオマーカーとなる可能性が示唆されました。
本研究成果は、査読付き学術誌「npj Precision Oncology」に掲載されました。
これらの結果に基づき、国立がん研究センター中央病院(病院長:瀬戸 泰之)および東病院(病院長:土井 俊彦)は、固形がんに対するE7820の日本人における安全性および有効性を評価する第I相医師主導治験注5(NCCH2303)を開始しました。本試験において、E7820の忍容性注6の確認および推奨用法・用量を決定した後、国立がん研究センターとエーザイは、特定のがん種やバイオマーカーを有する固形がんに対する有効性を確認する第II相、さらには承認申請用試験の実施を検討し、薬事承認をめざしてまいります。また、本研究で構築したシステムを、新規抗がん剤開発を加速させる創薬研究システムとして確立をめざします。
背景
PDXモデルは、がん患者さんの腫瘍組織を免疫不全マウスに直接移植することによって作成するがんモデルの一つで、非臨床試験や研究に活用されています。PDXモデルは、元のがん患者さんの腫瘍の不均一性と遺伝子変異の多くを維持しており、従来用いられてきた細胞株や、細胞株をマウスに移植したモデルマウスと比較して、治療効果の予測精度が高く、臨床データとPDXモデルの反応性の間に高い類似性があることが報告されています。
国立がん研究センター研究所は、臨床情報を付帯した日本人がん患者由来のJ-PDXライブラリーを2020年に構築し、がん種横断的に651モデルのPDXを保有し(2024年7月3日時点)、創薬開発での活用が進んでいます。
エーザイは、がん領域を戦略的重要領域の一つとし、グローバルに承認を取得した微小管ダイナミクス阻害剤エリブリンメシル酸塩(製品名:ハラヴェン®)とマルチキナーゼ阻害剤レンバチニブメシル酸塩(製品名:レンビマ®)に関する経験を活かしながら、Deep Human Biology Learning創薬体制のもとで新たな標的や作用機序を有する革新的新薬を創出し、がんの治癒の実現に向けて貢献することをめざしています。
E7820は、選択的なタンパク質分解に関わるDCAF15とスプライシング因子RBM39を結合させる分子糊として作用し、RBM39を選択的に分解するスルホンアミド系抗がん剤です。本作用によってRNAスプライシング注7の異常が誘導され、がんの増殖を抑える効果が期待されます。海外ではE7820を用いた臨床試験の実績があります。
図1
E7820は、スプライシング因子RBM39をユビキチンリガーゼDCAF15と結合させます。
ユビキチンリガーゼ複合体に取り込まれたRBM39はユビキチン化され、プロテアソームによって分解されます。
RBM39の分解によってスプライシング異常が誘導され、抗腫瘍効果が発揮されます。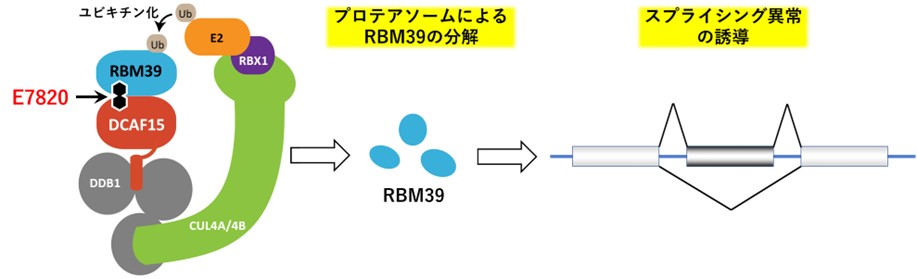
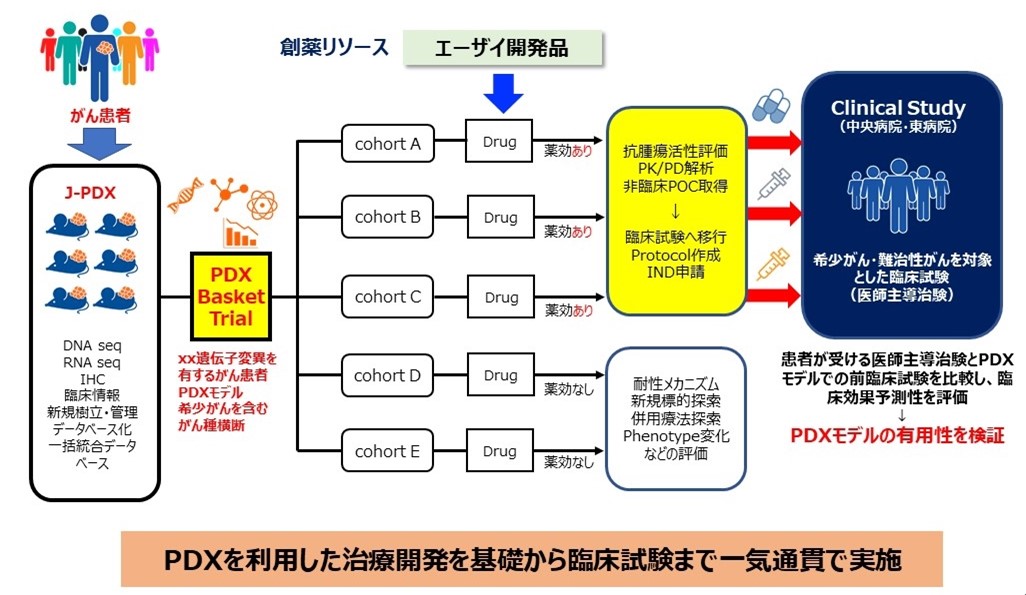
国立がん研究センターとエーザイは、「希少がんならびに難治性がんに対する抗がん剤治療開発を加速させる創薬研究手法に関する研究」において、エーザイ創製の新薬候補品に対して、J-PDXを用いて臓器横断的に非臨床試験を行い、希少がんならびに難治性がんを対象に医師主導治験を実施し、臨床での有用性を確認するとともに、承認申請をめざしています(図2)。さらに、治療前後の腫瘍組織からPDXを樹立し、薬剤応答性ならびにがんゲノムの比較解析を行い、新規創薬ターゲットの探索と薬剤耐性機序の解明に取り組み、新たな創薬への展開について検討を進めています。これらの取り組みにより、新規抗がん剤開発を加速させる創薬研究システムの確立をめざしています。
* 2021年5月14日プレスリリース
国立研究開発法人国立がん研究センターとエーザイ株式会社が治療効果予測能が高いPDXとがんゲノムデータを用いた「希少がんならびに難治性がんに対する抗がん剤治療開発を加速させる創薬研究手法に関する研究」を開始
https://www.ncc.go.jp/jp/information/pr_release/2021/0514/index.html
研究成果
PDXマウスモデルを用いたE7820の薬効評価スクリーニング
42のPDXモデル(膵がん12モデル、胆道がん12モデル、胃がん9モデル、子宮体がん9モデル)に、E7820を100 mg/kgもしくは200 mg/kgを21日間連日経口投与し、スクリーニング評価を実施しました。
その結果、腫瘍の有意な縮小(薬剤投与した群における腫瘍体積の増加率<-30%)が観察されました(図3a)。全奏効率は、本剤100 mg/kg投与で38.1%(16例)、200 mg/kg投与で54.8%(23例)でした。100 mg/kg投与で最も奏効率が高かったのは胆道がん(58.3%)、次いで子宮体がん(55.6%)、胃がん(33.3%)でした。最も奏効率が低かったのは膵がんの8.3%で、がん種によって効果が異なることが分かりました(図3b)。
図3
PDXマウスモデルを用いたE7820の薬効評価スクリーニングと全エクソン解析により
E7820の薬剤感受性を示すがん種やバイオマーカーが同定されました。 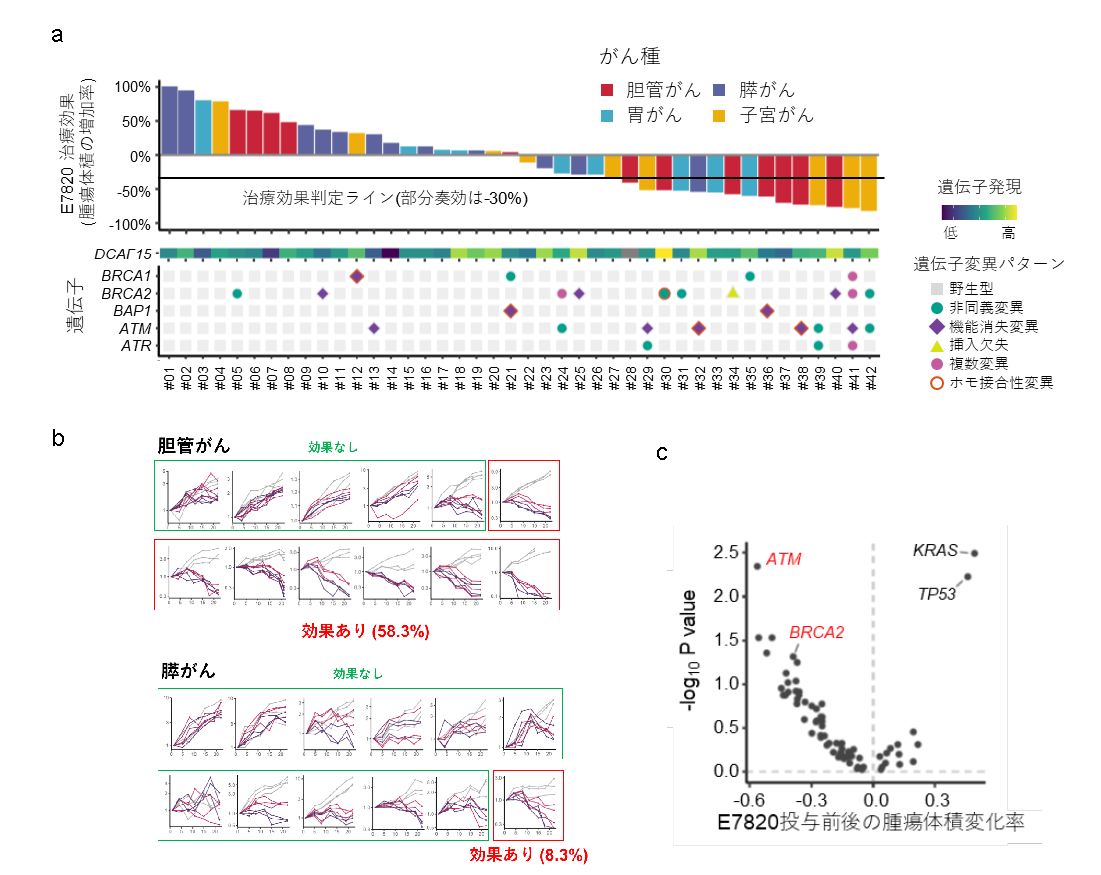
HRR関連遺伝子異常はE7820感受性のPDXで高頻度に観察される
E7820感受性に関連する分子マーカーを同定するために、全エクソンシークエンスおよび全トランスクリプトーム解析注8を実施しました。全エクソンシークエンスによる変異解析により、BRCA1、BRCA2またはATMといったHRR関連遺伝子の変異が薬の効果が認められたPDXにおいて高頻度に認められました(図3a)。変異のあるPDXと変異のないPDXのE7820感受性を比較すると、ATM変異は感受性群に有意に濃縮されており(p=4.5×10-3, FDR=0.14)、BRCA2変異も感受性群に濃縮されている傾向にありました(p=4.8×10-2, FDR=0.51)(図3c)。対照的に、TP53は非感受性群で有意に変異が認められましたが(p=5.9×10-3, FDR=0.14)、この濃縮は膵がんにおけるTP53の高変異陽性率に関連している可能性が考えられました。
E7820の長期投与は相同組換え修復欠損(homologous recombination deficiency: HRD)陽性細胞の増殖阻害をもたらす
最近の報告では、E7820がいくつかのHRR遺伝子のRNAスプライシングに影響を与えることが示されていましたが、HRR経路の機能喪失であるHRDがE7820の反応性を予測するバイオマーカーとなることは示されていませんでした。PDXモデルによるスクリーニングでは、HRD陽性腫瘍に顕著な腫瘍縮小が認められたことから、本化合物に長期的に曝露されると、増殖抑制が生じるのではないかと予想しました。そこで、BRCA2をノックアウトした大腸がん細胞株(DLD1-BRCA2-KO)またはノックアウトしていない親株(DLD1-P)を短期培養(3日間)または長期培養(12日間)して薬効を評価しました。DLD1-BRCA2-KO細胞は、DLD1-P細胞に比べ、12日目のE7820に対して高い感受性を示しました(図4a)。
DNA損傷応答に関与する他の遺伝子がE7820に対する感受性に影響を及ぼすかどうかをさらに調べるため、DLD1-P細胞においてATM、ATRまたはBAP1遺伝子をノックアウトし、次いで薬物投与したとこころ、DLD1-P細胞はE7820に感受性を示すようになることが明らかになりました(図4b)。
図4
(a)(b) HRD陽性細胞に対して、E7820の長期投与は増殖阻害をもたらします。
(c) BRCA2の機能不全がある細胞ではE7820によるDNA二本鎖切断が増加します。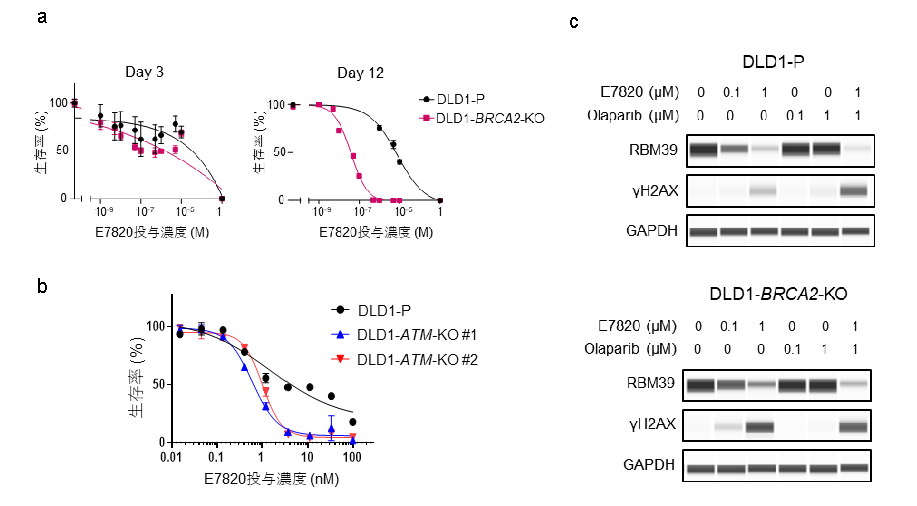
BRCA2の機能不全はE7820によるDNA二本鎖切断を増加させる
DLD1-BRCA2-KOはE7820に感受性を示したことから、E7820の曝露はDNA損傷を引き起こす可能性があると考えました。DNA二本鎖切断のマーカーであるγH2AXの発現を、E7820またはPARP阻害剤注9であるオラパリブで72時間培養した細胞で評価したところ、E7820(1μM)投与はオラパリブ(1μM)投与よりも多くのγH2AXの出現を誘導しました(図4c)。
E7820投与に関連するトランスクリプトームの変化
E7820がどのようにDNA二本鎖切断を誘導するかを明らかにするために、全トランスクリプトーム解析を行い、6つのがん細胞株でE7820処理により共通して発現上昇または発現低下する遺伝子を評価しました。その結果、1,655個の発現上昇遺伝子(fold change >1.1)と2,787個の発現低下遺伝子(fold change <0.9)が3つ以上の細胞株で観察されました。発現低下した遺伝子に濃縮していた細胞内パスウェイには、「ヌクレオチド除去修復」、「遺伝性乳がん関連シグナル」、「DNA損傷反応におけるBRCA1関連」といったDNA損傷修復に関連するシグナル伝達経路が含まれていました(図5a)。これらの経路に関連する遺伝子として、PALB2、BRIP1、BRCA1、RAD50、MRE11、ATR、FANCファミリー遺伝子などのHRR関連遺伝子ならびに、XPCやERCC2のようなヌクレオチド除去修復(NER)に必須な遺伝子も含まれていました。次に、E7820によって誘導されるスプライシング異常を調べたところ、DLD1-PとDLD1-BRCA2-KOの両方において、イントロンの保持が薬剤投与で最も増加したスプライシング異常であり、最も減少したスプライシング異常はシングルエクソンスキッピングでした(図5b)。また、薬剤投与により発現低下したDNA修復に関連する41遺伝子のうち25遺伝子(61%)に、イントロンの保持が誘導されていました(図5c)。
図5
E7820投与に関連するトランスクリプトームの変化を解析すると、
DNA損傷修復に関連するシグナル伝達経路に関わる遺伝子の発現低下やイントロン保持の誘導がみられました。
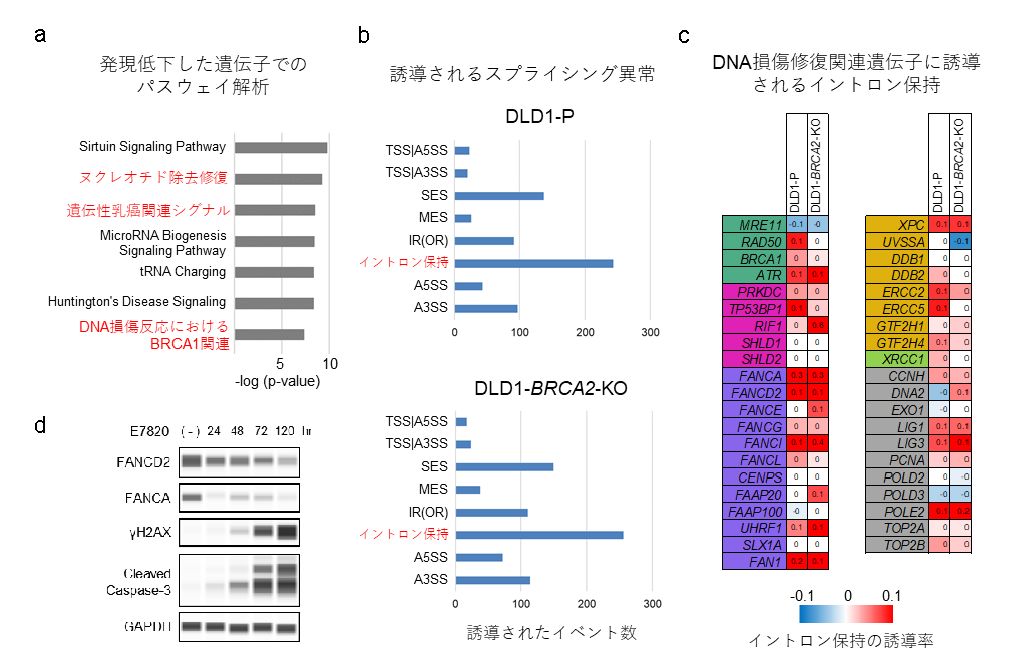
mRNAのミスプライシングは、対応する成熟タンパク質の翻訳に重大な影響を与えます。そこで、DLD1-BRCA2-KO細胞におけるFANCD2とFANCAのタンパク質レベルを測定しました(図5d)。E7820投与により、FANCD2およびFANCAタンパク質のレベルは、時間依存的に顕著に低下しました。重要なことに、FANCD2/FANCAタンパク質レベルの減少は、γH2AXの蓄積とカスパーゼ-3の切断(細胞のアポトーシスの特徴)と一致していました。
PDX(patient-derived xenograft)モデルを用いた創薬利用について
これまでの抗がん剤開発での課題の一つには、治療効果予測に用いる細胞株による実験モデルでの予測能が低いことが挙げられます。一方でPDXは、がん患者さんのがん組織を免疫不全マウスに移植し腫瘍を再現する動物モデルで、がん組織の特徴を保持できるため、高い再現率を有するとの報告があり、創薬利用が急速に進んでいます。国立がん研究センターでは、子宮がん肉腫患者さんから作製したPDXモデルでの抗HER2療法の効果予測と臨床で有効性が一致していることを確認しています。*
国立がん研究センターが構築した日本人がん患者由来の大規模PDXライブラリー「J-PDX」は、1. 臓器横断的にPDXを樹立し、メジャーながんに加え、希少がん(骨肉腫・横紋筋肉腫など)、アジアに多いがんにも注力したこと、2. 手術検体だけでなく薬剤耐性期の検体からもPDXを樹立したこと、3. 治療歴を含む詳細な臨床情報を付帯したPDXであることが特徴で、新規抗がん剤開発での活用促進、開発の加速が期待されます。
* 2023年4月10日プレスリリース
子宮がん肉腫でトラスツズマブ デルクステカンによる抗HER2療法の有効性を確認
PDXモデルでの効果予測とも一致し希少がんの治療開発への道を開く
https://www.ncc.go.jp/jp/information/pr_release/2023/0410/index.html
発表論文
雑誌名
npj Precision Oncology
タイトル
A molecular glue RBM39-degrader induces synthetic lethality in cancer cells with homologous recombination repair deficiency
著者
Shinji Kohsaka, Shigehiro Yagishita, Yukina Shirai, Yusuke Matsuno, Toshihide Ueno, Shinya Kojima, Hiroshi Ikeuchi, Masachika Ikegami, Rina Kitada, Ken-ichi Yoshioka, Kohta Toshimitsu, Kimiyo Tabata, Akira Yokoi, Toshihiko Doi, Noboru Yamamoto, Takashi Owa, Akinobu Hamada, Hiroyuki Mano
国立がん研究センター
研究所 細胞情報学分野 分野長 高阪 真路
研究所 細胞情報学分野 ユニット長 上野 敏秀
研究所 細胞情報学分野 主任研究員 池上 政周
研究所 細胞情報学分野 任意研修生 白井 由紀奈
研究所 細胞情報学分野 任意研修生 小島 進也
研究所 細胞情報学分野 任意研修生 来田 里奈
研究所 分子薬理研究分野 分野長 濱田 哲暢
研究所 分子薬理研究分野 ユニット長 柳下 薫寛
研究所 ゲノム安定性制御研究ユニット ユニット長 吉岡 研一
研究所 ゲノム安定性制御研究ユニット 学振研究員 松野 悠介
研究所 ゲノム安定性制御研究ユニット 外来研究員 松尾 理加
研究所 所長 間野 博行
中央病院 先端医療科 科長 山本 昇
東病院 先端医療科 科長 土井 俊彦
エーザイ株式会社
DHBL Cell Lineage & Differentiationドメイン 研究員 利光 孝太
DHBL Cell Lineage & Differentiationドメイン 研究員 田端 君代
DHBL Cell Lineage & Differentiationドメイン ヘッド 横井 晃
チーフサイエンティフィックオフィサー 常務執行役 大和 隆志
DOI
10.1038/s41698-024-00610-0
掲載日
2024年5月24日
URL
https://www.nature.com/articles/s41698-024-00610-0(外部サイトにリンクします)
固形がんに対するE7820の日本人における安全性および有効性を評価する国内医師主導第I相治験について
本試験は、用量確認パートにおいて標準治療に不応または不耐の固形がん患者さんを対象にE7820の日本人における忍容性、薬物動態などを確認します。引き続き、拡大パートにおいて、胆道がん、子宮体がん、相同組換え修復遺伝子変異を有する固形がん患者さんを対象に用量確認パートで忍容性が確認された用法・用量で探索的にE7820の有効性と安全性評価を実施します。エーザイから治験薬の提供を受けて実施します。海外においては、E7820を用いた臨床試験の実施成績があり、1日1回連日経口投与における最大耐量(MTD)は100 mgとされています。
試験名
固形がんに対するE7820の日本人における安全性および有効性を評価する国内医師主導第I相治験(治験実施計画書番号:NCCH2303、試験略称:CIRCUS)
使用される新薬(治験薬)
E7820(経口薬:スルホンアミド系スプライシング制御薬)
治験に参加いただける患者さんの身体状況(患者選択基準)
- 文書による同意が得られる
- 固形がんであり、切除不能な進行・再発と診断されている
- 標準治療がない、または標準治療に不応もしくは不耐であると診断されている
- 治験への登録時において、年齢が18歳以上
- 各臓器機能が規定内に保たれている
注:上記の患者選択基準は概要であり、上記に該当していてもこの治験に参加できないことがありますので、ご了承ください。
研究代表者
山本 昇(国立がん研究センター中央病院 先端医療科 科長)
医師主導治験(CIRCUS試験)参加施設一覧
国立がん研究センター中央病院(東京都中央区築地5-1-1)
国立がん研究センター東病院(千葉県柏市柏の葉6-5-1)
臨床研究実施計画・研究概要公開システム
jRCT番号:jRCT2031240210
本治験の詳細は、臨床研究実施計画・研究概要公開システムよりご確認ください。
https://jrct.niph.go.jp/latest-detail/jRCT2031240210(外部サイトにリンクします)
研究費
本試験は下記事業の支援を受けて行われます。
日本医療研究開発機構 医療研究開発革新基盤創成事業(CiCLE)(JP20pc0101051)
展望
企業での創薬開発に国立がん研究センターのJ-PDXライブラリーを用いることで、新規薬剤候補に対する薬効評価と有効性予測バイオマーカーの同定、さらには臨床試験の立ち上げまでを速やかに実現することが可能となりました。本試験において、E7820の忍容性を含む安全性の確認および推奨用量を決定した後、国立がん研究センターとエーザイは、特定のがん種やバイオマーカーを有する固形がんに対する有効性を確認する第II相さらには承認申請用試験の実施を検討し、薬事承認をめざしてまいります。
また、本研究で構築したシステムを、新規抗がん剤開発を加速させる創薬研究システムとして確立をめざします。
用語解説
注1 PDX(patient-derived xenograft):マウスモデル
がん患者さんの腫瘍組織を免疫不全マウスに直接移植することによって作成する、がんモデルの一つです。
注2 バイオマーカー
タンパク質や遺伝子などの分子で、病気の存在や、治療法選択などの指標となるものです。
注3 全エクソンシークエンス
ヒトゲノムのうちタンパク質をコードするエクソン領域を選択的に濃縮し、効率的に解析する手法です。
注4 相同組換え修復(homologous recombination repair)
DNA二本鎖切断修復における主要な機構の一つであり、姉妹染色分体を鋳型にして修復を行います。
注5 医師主導治験
新しい薬が承認され、保険で使えるようになるためには新薬の臨床開発(治験)が必要です。有望な医薬品でありながら、企業主導では治験が実施されない医薬品について、製薬企業の協力を得て、医師自らが治験を行うことを医師主導治験といいます。
注6 忍容性
忍容性とは治験薬が投与された場合に生じる副作用が、人において許容される程度か否かを表す言葉です。具体的には治験薬を人に投与した場合に、許容し難いと考えられる副作用の発症頻度やその重症度などを参考に検討されます。
注7 RNAスプライシング
RNAスプライシングは、mRNA前駆体からイントロンを除去して成熟mRNAを産生する、遺伝子発現に必須の機構です。
注8 全トランスクリプトーム解析
細胞中に存在する全ての遺伝子転写産物(トランスクリプトーム)の配列・発現量を解析する手法です。
注9 PARP阻害剤
DNA修復など細胞内で重要な役割を果たす酵素のポリアデノシン5'二リン酸リボースポリメラーゼ(PARP:poly ADP-ribose polymerase)を阻害することで、相同組換え修復遺伝子に変異を有する腫瘍細胞で合成致死を誘導します。
お問い合わせ先
非臨床試験に関するお問い合わせ
国立研究開発法人国立がん研究センター
研究所 細胞情報学分野
高阪 真路(こうさか しんじ)
電話番号: 03-3542-2511(代表)
Eメール: skohsaka●ncc.go.jp
医師主導治験に関するお問い合わせ
国立研究開発法人国立がん研究センター
中央病院 臨床研究支援部門 研究企画推進部 国際研究支援室
電話番号:03-3547-5201(内線2686)
Eメール: ncch2303_office●ml.res.ncc.go.jp
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
電話番号:03-3542-2511(代表)
Eメール:ncc-admin●ncc.go.jp
エーザイ株式会社 PR部
電話番号:03-3817-5120