日本初の乳がんプラットフォーム試験(S-FACT試験)を開始複数の新規治療を同時に評価し新薬開発を迅速化
2024年11月6日
国立研究開発法人国立がん研究センター
名古屋市立大学
日本臨床腫瘍研究グループ
発表のポイント
- S-FACT(JCOG2205)試験は日本初の乳がん領域のプラットフォーム試験であり、複数の新規薬剤を同時に迅速に評価できる医師主導治験注1です。
- 本試験を恒常的な多施設共同臨床試験グループの基盤の上で効率的に実施することにより、新規薬剤の早期承認が期待され、日本の乳がん患者さんに迅速に治療が届けられることを目指しています。
- 今回の活動を通じ、乳がん領域におけるドラッグ・ラグやドラッグ・ロスの解決に向け、貢献していきます。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)中央病院(病院長:瀬戸泰之)が、中央支援機構(データセンター/運営事務局)を担い支援する日本臨床腫瘍研究グループ(Japan Clinical Oncology Group:JCOG)では、新しい治療法の開発や検証的試験の実施を通じて、科学的証拠に基づいて患者さんに第一選択として推奨すべき治療である標準治療や診断方法等の最善の医療を確立するため、各種がん領域の専門別研究グループで全国規模の多施設共同臨床試験を実施しています。JCOGでは中央支援機構が臨床試験実施の基盤を構築し、その上で常時約100試験の研究者主導臨床試験を実施しており、それ自体が臨床試験におけるプラットフォームの役割を担っております。
この度、JCOG乳がんグループでは、周術期注2乳がんを対象とした新規薬剤開発に関する持続的なプラットフォーム試験(JCOG2205、試験略称:S-FACT試験)を開始しました。本試験は、日本初の乳がん領域のプラットフォーム試験で医師主導治験として実施され、臨床病期II期またはIII期(ステージ2~3)の乳がんにおける術前化学療法注3の有効性を評価することを目的としています。
プラットフォーム試験とは、単一の疾患に対して複数の新規治療を同時に評価するために持続的なプラットフォーム(基盤)を構築し、試験期間中に新たな治療法の追加や除外を認める仕組みをとっています。これにより、複数の新規治療の有効性を迅速に、そして効率的に評価できることになります。
また、S-FACT試験は医師主導治験として、短期間で判定が可能な手術前の治療効果を厳格に評価します。しかし、新規治療の評価には治験外で得られる手術後の長期予後の情報も重要です。そのようなデータと連結して解析することで、S-FACT試験の価値がさらに高まります。
一般的には、リアルワールドデータを取得するために別途レジストリ研究を立ち上げるなどの対応が必要ですが、S-FACT試験では、恒常的な多施設共同臨床試験グループであるJCOGの基盤を活用することで、効率的にデータ収集と解析を行うことが可能となります。
S-FACT試験では試験治療ごとに約2年の募集期間を予定しております。このプラットフォーム試験そのものと、それを支えるJCOGの基盤を活用した予後調査研究を含む、二段構えの研究体制(Platform on Platform試験)のもと、全体としては約15年にわたり、本試験を継続させることを予定しています。
本試験を通じて、乳がんにおける新規治療開発の新たなシステムが構築され、日本の患者さんに迅速に新規薬剤が提供されることが期待されます。
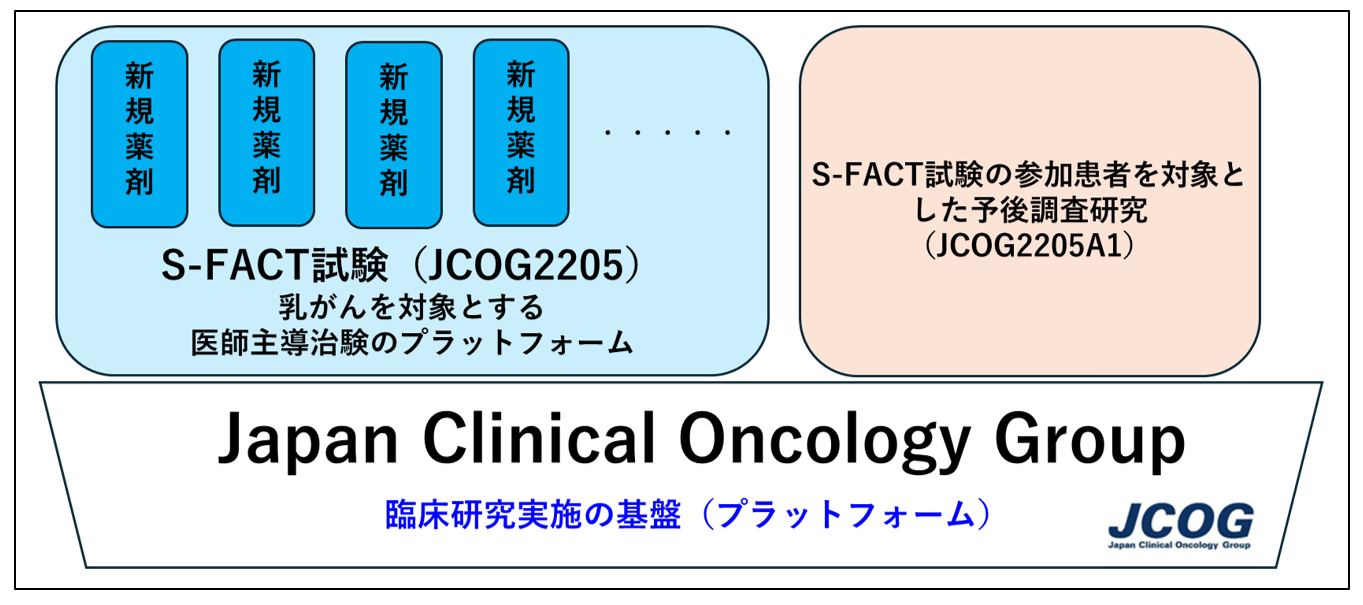
図1:JCOGの臨床研究実施の基盤で行うS-FACT試験の全体像
JCOGでは国立がん研究センター中央病院臨床研究支援部門が中心となる中央支援機構が臨床試験実施の基盤を構築し、その上で常時約100試験の研究者主導臨床試験を実施しています。JCOGには、標準化されたデータベース・Electronic Data Captureシステム・データマネジメント方法、研究者や医療機関情報の管理システム、研究の運営・管理のノウハウ、専門性を有する人材・長期の研究期間に対応できる体制が整っており、JCOG自体が臨床試験におけるプラットフォームの役割を担っています。
背景
世界における乳がんの新規薬剤の治療開発では、まず、製薬企業が主導して、有望な新規薬剤候補に対し小規模な臨床試験を実施し、その後に大規模な国際共同試験が実施されることが一般的です。しかし、日本がすべての開発品の情報をキャッチアップするのは難しく、また近年、ドラッグ・ラグ(新薬が他国で承認されてから国内で承認されるまでの遅れ)やドラッグ・ロス(新薬が他国で承認されているが国内で未承認または開発されないこと)が乳がん領域でも懸念されており、有望な新規薬剤の開発の遅滞が危ぶまれています*。また、個々の薬剤を別々の臨床試験で評価する従来の方法では、それぞれの試験に時間とリソースが分散され、迅速な治療開発が難しいという課題がありました。
JCOG乳がんグループでは、これらの状況を危惧し、有望な薬剤を遅滞なく評価し日本の乳がん患者さんに届けるために、患者さんの乳がんの特性(サブタイプ注4)に応じて、複数の試験治療を実施して、医薬品の有効性と安全性を評価することができるプラットフォーム試験の構築を急務と考えました。S-FACT試験は、この課題を解決するために設計され、複数の新規薬剤を同時に評価し、効率的な薬剤開発を可能にします。
*出典:厚生労働省 令和6年7月5日(金曜日)開催 第59回 医療上の必要性の高い未承認薬・適応外薬検討会議 よりドラッグロス解消に向けた取組について(2024年9月25日閲覧)
https://www.mhlw.go.jp/content/11121000/001273100.pdf(外部サイトにリンクします)
研究方法
S-FACT試験は、臨床病期II期またはIII期乳がんにおける術前化学療法として、科学的根拠に基づいた観点で、現在利用できる最良の治療(標準治療注5)に対する試験治療の有効性を検討することを目的とします。乳がんは患者さんのサブタイプより、異なる治療戦略をとるため、本試験も患者さんをサブタイプに分けて、それぞれ標準治療と試験治療の比較を行います。まず、トリプルネガティブ乳がんの患者さんを対象とした群(コホート)で試験を開始します。今後、新たな試験治療薬の候補があった際には、他のサブタイプコホートも順次開始していく予定です。
対象となる患者さん
(記載した以外にも対象患者さんとなるための規準があります)
- 組織の病理検査で乳がん(浸潤がん)と診断されている方
- 臨床病期II期またはIII期と診断され、かつ切除可能と診断されている方
- 非浸潤性乳がん、浸潤性乳がんいずれの既往もない方
- 年齢が18歳以上80歳以下の方
- 治験参加について患者本人より文書による同意が得られる方
注:上記の患者選択規準は概要であり、上記に該当していてもこの治験に参加できないことがありますので、ご了承ください。
募集期間
2024年6月より
- 試験治療ごとに約2年の募集期間を予定しており、プラットフォーム試験全体では、約15年持続させることを予定しています。
- S-FACT試験にご参加頂く患者さんを対象に、手術後の予後を調査する観察研究も実施いたします。いずれもJCOGの枠組みで実施いたします。
S-FACT試験の概要
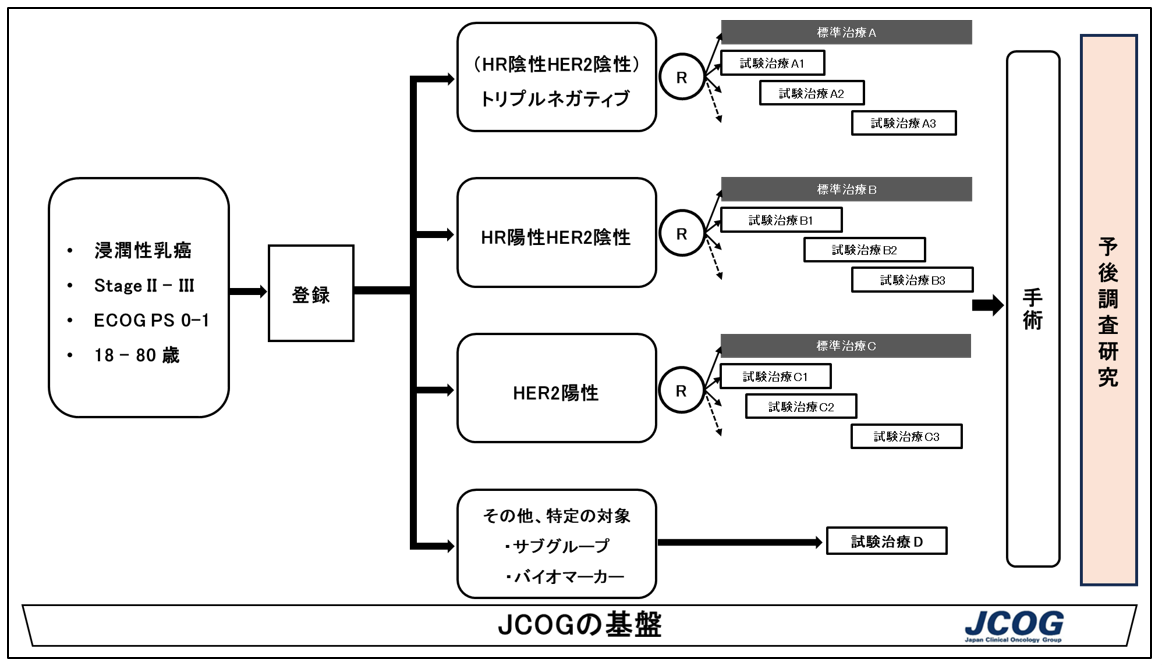
注意:現在開始している試験は、HR陰性HER2陰性のトリプルネガティブ乳がんコホートです。
評価項目
病理学的完全奏効(pCR)割合、ctDNA注6クリアランス割合、安全性
実施体制
本試験は、研究統括者:岩田 広治(名古屋市立大学)、研究代表者:米盛 勧(国立がん研究センター中央病院)とし、以下の参加施設で実施されます。
- 国立がん研究センター中央病院
- がん研有明病院
- 神奈川県立がんセンター
- 名古屋市立大学病院
- 岡山大学病院
*プラットフォーム試験の継続中に参加施設が増える可能性もあります。
本試験の詳細は、以下よりご確認いただけます。
臨床研究実施計画・研究概要公開システム https://jrct.niph.go.jp/latest-detail/jRCT2031240159(外部サイトにリンクします)
https://jrct.niph.go.jp/latest-detail/jRCT2031240160(外部サイトにリンクします)
展望
S-FACT試験により、周術期の乳がんを対象とした新規薬剤の開発が加速し、患者さんが有望な薬剤へ早期にアクセスできることが期待されます。また、患者さんの血液中のctDNAを活用した治療戦略の確立が期待され、乳がん以外の他がん種への応用も視野に入れています。本試験は、日本の乳がん患者さんに迅速かつ効果的な治療を提供するための重要なステップとなります。
研究費
- 国立研究開発法人国立がん研究センター研究開発費
研究課題名:成人固形がんに対する標準治療確立のための基盤研究(2023-J-03)
研究代表者名:大江 裕一郎
*上記の他に、各治験薬の提供者(製薬企業)から研究費を頂き、実施しております。用語解説
(注1)医師主導治験
新しい薬が承認されるためには、新薬の臨床試験(治験)が必要です。欧米で標準的な医薬品等でありながら、国内では不採算等のため導入されていない医薬品等について、製薬企業主導でなく、製薬企業の協力を得て、医師自らが治験を行うことを医師主導治験といいます。
(注2)周術期
手術前後を含めた一連の期間を指します。
(注3)術前化学療法
手術の前に行う抗がん剤治療のことを術前化学療法といいます。近年は、臨床病期II期以上の乳がんでは術前化学療法を行い、その後の手術で得られた情報に応じて、手術の後の治療方針を決定する治療が主流になっています。
(注4)サブタイプ
乳がんは、乳がん細胞がもつ性質(ホルモン受容体やHER2が陽性か陰性か)によって、4つのサブタイプに分類されます。サブタイプごとに効果が期待される薬剤が異なり、それぞれ標準治療も変わります。
(注5)標準治療
その患者さんに対し、科学的根拠に基づいた観点で現在利用できる最良の治療のことを標準治療といいます。
(注6)ctDNA
血液中には体内の細胞から遊離したDNA断片が存在します。がんも同様に、がん細胞から遊離したDNAが血液中を循環しており、これを腫瘍細胞由来血中循環遊離DNA(circulating tumor DNA:ctDNA)と呼びます。
お問い合わせ先
研究に関するお問い合わせ
JCOG2205治験調整委員会
Eメール:jcog2205ccmember●med.nagoya-cu.ac.jp
日本臨床腫瘍研究グループ(JCOG)に関するお問い合わせ
国立がん研究センター中央病院
臨床研究支援部門 研究企画推進部 多施設研究支援室
Eメール:webmaster●ml.jcog.jp
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局広報企画室
電話番号:03-3542-2511(代表)
Eメール:ncc-admin●ncc.go.jp
名古屋市立大学病院
管理部経営課
電話番号:052-858-7116
Eメール:hpkouhou●sec.nagoya-cu.ac.jp
関連ファイル
関連リンク
- 腫瘍内科
- 中央病院 臨床研究支援部門
- 日本臨床腫瘍研究グループ(JCOG) (外部サイトにリンクします)
