HER2陽性胆道がん対象の医師主導治験においてトラスツズマブ デルクステカンの有効性を確認-米国臨床腫瘍学会旗艦誌「Journal of Clinical Oncology」に論文発表-
2024年11月20日
国立研究開発法人国立がん研究センター
発表のポイント
- HER2陽性の切除不能または再発胆道がんに対する医師主導治験の結果、トラスツズマブ デルクステカンの治療効果が確認されました。
- HER2低発現の患者さんにおいても、治療効果が確認されました。
- 副作用は管理可能なものが多かったものの、間質性肺炎の発生には注意が必要と考えられました。
- 本治験の成果は米国学術雑誌「Journal of Clinical Oncology」に掲載されました。
概要
国立研究開発法人国立がん研究センター(東京都中央区、理事長:中釜斉)中央病院(病院長:瀬戸 泰之)は、HER2陽性胆道がん患者さんを対象に、抗HER2抗体薬物複合体製剤トラスツズマブ デルクステカンの医師主導治験(HERB試験)を実施しました。本治験は国立がん研究センター中央病院を含む5施設(国立がん研究センター中央病院、国立がん研究センター東病院、杏林大学医学部付属病院、北海道大学病院、神奈川県立がんセンター)による多施設共同研究として実施しました。
本治験の結果、HER2陽性の切除不能または再発胆道がん22名中8名(36.4%)で治療効果が認められ、トラスツズマブ デルクステカンの有効性が確認されました。また、HER2低発現の患者さんにおいても、8名中1名(12.5%)で治療効果が認められました。頻度の多かったグレード3以上(比較的強めに認められた)副作用は主なもので貧血53.1%、好中球減少31.3%、白血球減少31.3%で、全体として管理可能と考えられましたが、計32名のうち8名(25.0%)が間質性肺炎となり2名が死亡に至ったため、実地臨床で応用する場合は十分な注意が必要です。
本治験においてHER2陽性胆道がんに対するトラスツズマブ デルクステカンの有効性が確認されたことは、胆道がんの治療選択肢が増えるだけでなく、胆道がんにおいても希少フラクションごとや遺伝子異常に基づく治療薬開発が促進されることが期待されます。国立がん研究センターでは、治療開発の進みにくい難治性がん、希少がんを対象とした医師主導治験や臨床研究を積極的に実施しております。
本研究の成果は、科学雑誌「Journal of Clinical Oncology」(米国東部時間2024年8月5日)に掲載されました。
背景
胆道がんについて
胆道がんは国内の年間罹患数2.2万人、年間死亡数1.8万人と予後の悪い難治性がんです。胆道がんは発生部位から、肝内胆管がん、胆のうがん、肝外胆管がん、十二指腸乳頭部がんに分類されます。治療法は、切除可能な場合は手術が選択され、切除が困難な場合や切除後に再発した場合は、通常薬物療法が行われます。薬物療法としては、1次化学療法としてゲムシタビンとシスプラチンに免疫チェックポイント阻害薬やS-1を組み合わせた治療が標準的な治療とされています。まだまだ治療選択肢は限られており、胆道がんはアンメットメディカルニーズの高いがんと考えられます。
図1:胆道と周囲の臓器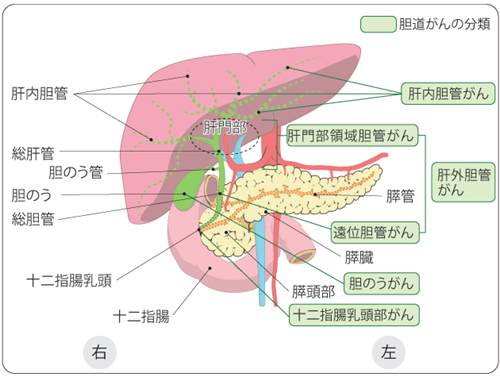
出典:国立がん研究センターがん情報サービス「胆道がんについて」がん情報
HER2について
HER2(human epithelial growth factor receptor type 2)とは、HER familyに属する細胞膜に存在するタンパク質です。HER2タンパク質は正常細胞において細胞の増殖に関与していますが、何らかの理由で、HER2タンパク質の過剰発現やHER2遺伝子の増幅が起こると、細胞の増殖が制御できなくなり、がん化に結びつくと考えられています。乳がん、胃がんなど複数のがんでHER2タンパクの過剰発現が確認され、日本でもHER2タンパク質を標的とした複数の薬剤が既に承認されており、がん治療の有力な標的分子と考えられています。胆道がんにおいては、患者さんの1-2割程度がHER2陽性(HER2タンパク質の過剰発現・HER2遺伝子の増幅が見られる状態)です。
トラスツズマブ デルクステカンについて
本治験で使用した薬剤トラスツズマブ デルクステカンは、第一三共株式会社が開発したHER2に対する抗体薬物複合体です。抗体薬物複合体とは、抗体と薬物を結合させたもので、がん細胞に発現している標的分子(HER2)に結合する抗体を介して薬物をがん細胞に直接届けることで、薬物の全身曝露を抑えつつ、がん細胞への攻撃力を高めた薬剤です。すでにHER2陽性/低発現の乳がん、HER2(ERBB2)遺伝子変異陽性の肺がん、HER2陽性の胃がんで保険適用となっています。また、最近では臓器横断的な開発も国内外で進められており、有望な成績が報告されていますが、胆道がんのみにフォーカスした研究はこの研究が初めてです。
HERB試験について
これまでの研究から、胆道がん患者でもHER2陽性が見られることや、本治験で使用した薬剤トラスツズマブ デルクステカンの他がん種での有効性も明らかとなってきました。一方で、HER2陽性の胆道がんは患者数が少なく、まとまった診療情報が存在しないことから企業主導による治療開発が進みにくい現状もあることから、今回、国立がん研究センターの産学連携全国がんゲノムスクリーニング事業であるSCRUM-JapanのMONSTAR-SCREENの基盤を活用し、国立がん研究センター中央病院 臨床研究支援部門の支援のもと、医師主導治験(HERB試験)として実施しました。
患者さんの胆道がんがHER2陽性かどうかを調べるにあたり、MONSTAR-SCREENに参加している施設において別途実施された「HER2発現胆道がんスクリーニング研究(UMIN000036697)」により確認しました。
研究概要
試験名
HER2陽性の切除不能または再発胆道がんに対するトラスツズマブ デルクステカンの医師主導治験(試験略称: NCCH1805、HERB試験)
目的
進行胆道がんに対する薬物療法の選択肢は少なく、その予後は不良です。胆道がんにおけるHER2陽性割合は1-2割程度と報告され、小規模な臨床試験ではHER2阻害薬の有効性も示唆されています。HER2に対する抗体薬物複合体であるトラスツズマブ デルクステカンを用いて、HER2発現胆道がんに対する多施設共同第II相医師主導治験(JMA-IIA00423)を実施しました。
方法
HER2発現胆道がんスクリーニング研究にてIHC及びISHでHER2の発現(HER2陽性および低発現)が確認された、ゲムシタビンを含む治療に不応・不耐の切除不能又は再発胆道がんに対し、トラスツズマブ デルクステカン 5.4mg/kgを3週毎に投与しました。主要評価項目はHER2陽性胆道がんにおける中央判定に基づく奏効割合(治療効果が得られて一定以上腫瘍が縮小した患者さんの割合)としました。
結果
計32名(HER2陽性24名、HER2低発現8名)が登録されて治療を受け、不適格を除くHER2陽性22名(胆のうがん11名、肝外胆管がん6名、肝内胆管がん3名、乳頭部がん2名)が主要評価対象でした。前治療数中央値は2(範囲1–4)でした。奏効割合は36.4%(08月22日、CR 2名、PR 6名、90% CI 19.6–56.1)で、事前設定した閾値15%を上回りました(P=0.01)。全ての適格患者における、画像中央判定による、標的病変の径和のベースラインからの最大縮小/増大割合のwaterfall plotを図1に示しました。病勢制御割合注1は81.8%(95% CI 59.7–94.8)、無増悪生存期間注2中央値は4.4か月(95% CI 2.8–8.3)、全生存期間注3は7.1か月(95% CI 4.7–14.6)でした。HER2低発現8名においても1名に奏効が認められ、陽性例ほどではないもの、一定の有効性が期待できる結果でした。
治療関連のグレード3以上の有害事象は81.3%(26/32)に発現し、主なものは貧血53.1%、好中球減少31.3%、白血球減少31.3%でした。8名(25.0%)に間質性肺炎が発現し、グレード1が3名、グレード2が1名、グレード3が2名、グレード5が2名でした(非独立判定)。
図2:画像中央判定による標的病変の径和のベースラインからの最大縮小/増大割合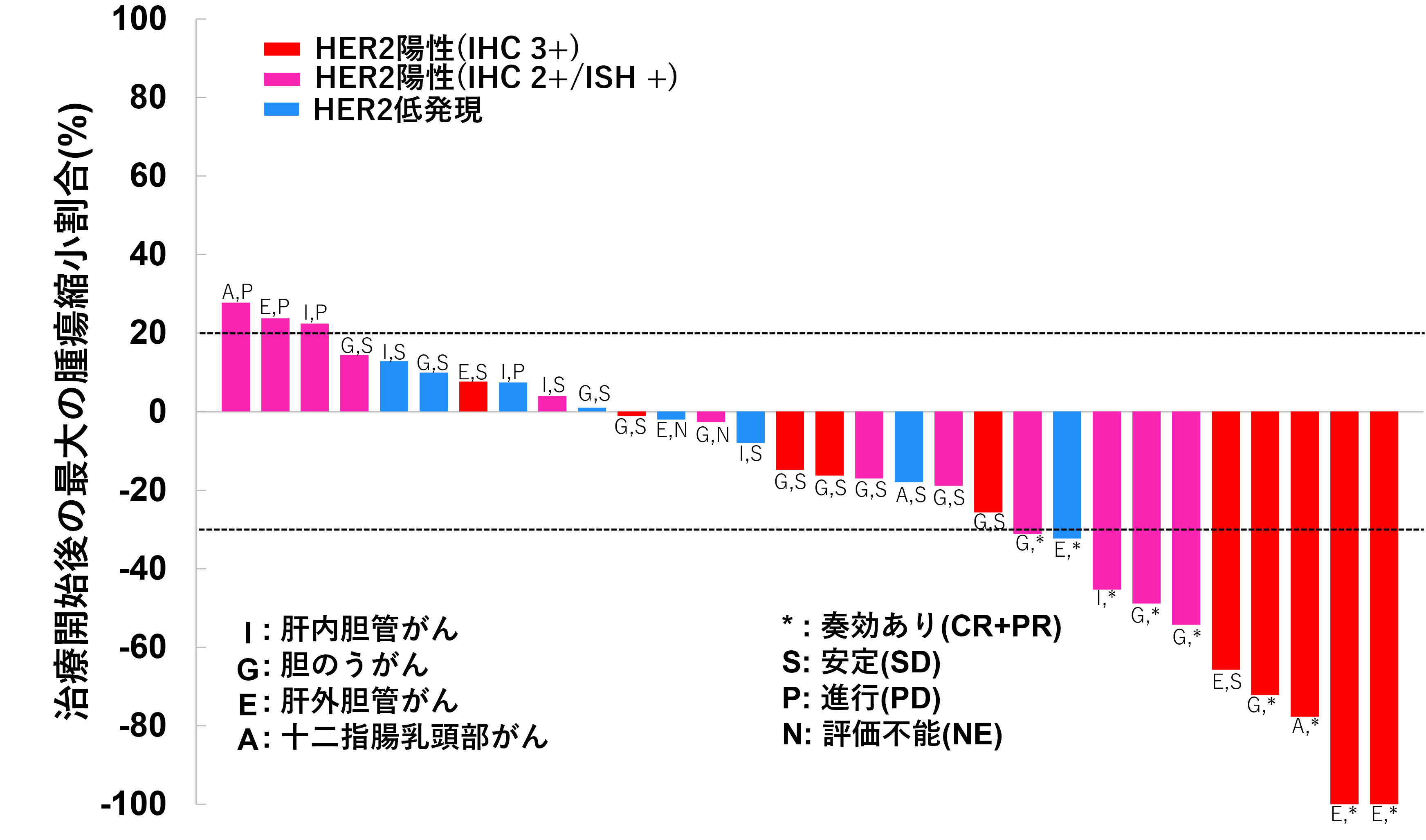
結論
トラスツズマブ デルクステカンはHER2発現胆道がんに対し有効であることが示されました。有害事象は対応可能なものが多かったものの、間質性肺炎に注意が必要と考えられました。
展望
トラスツズマブ デルクステカンはすでに米国食品医薬品局(FDA)より、前治療歴があり代替の治療手段のない切除不能または転移性のHER2陽性(IHC 3+)固形がんに係る一部変更承認を取得しているため、胆道がんにも日常診療の場で今後広く用いられる可能性があります。胆道がんは腫瘍による閉塞性黄疸や胆管炎といった、他のがん種であまり見ることが無い特徴的な病態を呈することが多いため、胆道がんに限定した本薬剤の有効性、安全性の情報は今後の臨床現場の活用において大変貴重で参考になる情報です。また本治験の結果は胆道がんにおけるHER2標的治療薬の開発の礎として、今後の研究開発をさらに活発化させることが期待されます。
研究費
本治験は、国立研究開発法人日本医療研究開発機構(AMED)臨床研究・治験推進研究事業「産学連携全国がんゲノムスクリーニング(SCRUM-Japan)患者レジストリを活用したHER2陽性の切除不能または再発胆道癌に対する医師主導治験」(研究開発代表者:森実 千種)の支援を受けて実施し、研究費の一部、トラスツズマブ デルクステカンの薬剤及びHER2発現胆道がんスクリーニング研究の研究費用は第一三共株式会社から提供されました。
論文情報
雑誌名
Journal of Clinical Oncology
タイトル
Trastuzumab Deruxtecan in Human Epidermal Growth Factor Receptor 2–Expressing Biliary Tract Cancer (HERB; NCCH1805): A Multicenter, Single-Arm, Phase II Trial
著者
Akihiro Ohba, Chigusa Morizane, Yasuyuki Kawamoto, Yoshito Komatsu, Makoto Ueno, Satoshi Kobayashi, Masafumi Ikeda, Mitsuhito Sasaki, Junji Furuse, Naohiro Okano, Nobuyoshi Hiraoka, Hiroshi Yoshida, Aya Kuchiba, Ryo Sadachi, Kenichi Nakamura, Naoko Matsui, Yoshiaki Nakamura, Wataru Okamoto, Takayuki Yoshino, Takuji Okusaka
掲載日
2024年8月5日
DOI
10.1200/JCO.23.02010
URL
https://ascopubs.org/doi/10.1200/JCO.23.02010(外部サイトにリンクします)
用語解説
注1 病勢制御割合
あるがん治療をした患者さんに対して、がんの消滅や縮小に加え、腫瘍の大きさが変化していないことまで確認できた症例の割合です。治療法の評価の基準として用いられます。
注2 無増悪生存期間
試験の登録日から疾患が悪化せずに患者さんが生存している期間。
注3 全生存期間
試験の登録日から患者さんが生存している期間。
お問い合わせ先
研究に関するお問い合わせ
国立研究開発法人国立がん研究センター中央病院 肝胆膵内科
Eメール:preHERB_office●ml.res.ncc.go.jp
広報窓口
国立研究開発法人国立がん研究センター企画戦略局 広報企画室
電話番号:03-3542-2511(代表)
Eメール:ncc-admin●ncc.go.jp
