細胞外小胞の標的細胞への取り込み機構を解明~細胞外小胞動態メカニズムに基づく新たな治療戦略への貢献に期待~
岐阜大学
国立研究開発法人国立がん研究センター
科学技術振興機構(JST)
本研究のポイント
-
細胞外小胞は様々な細胞から分泌されますが、同じ細胞から分泌される場合でも、膜の硬さや構成されるタンパク質が異なるサブタイプ(亜種)が存在することを見出しました。
-
全てのサブタイプが、糖鎖結合タンパク質(ガレクチン3)を介して、クラスリン非依存性エンドサイトーシス経由で取り込まれること、一部のサブタイプの細胞外小胞は、カベオラ経由でも取り込まれることを明らかにしました。
-
細胞外小胞が標的細胞膜に結合後、直ちに接着シグナルが誘起され、標的細胞による取り込みを促進することを明らかにしました。
-
細胞外小胞動態の理解が進み、医学・薬学分野への展開が期待できます。
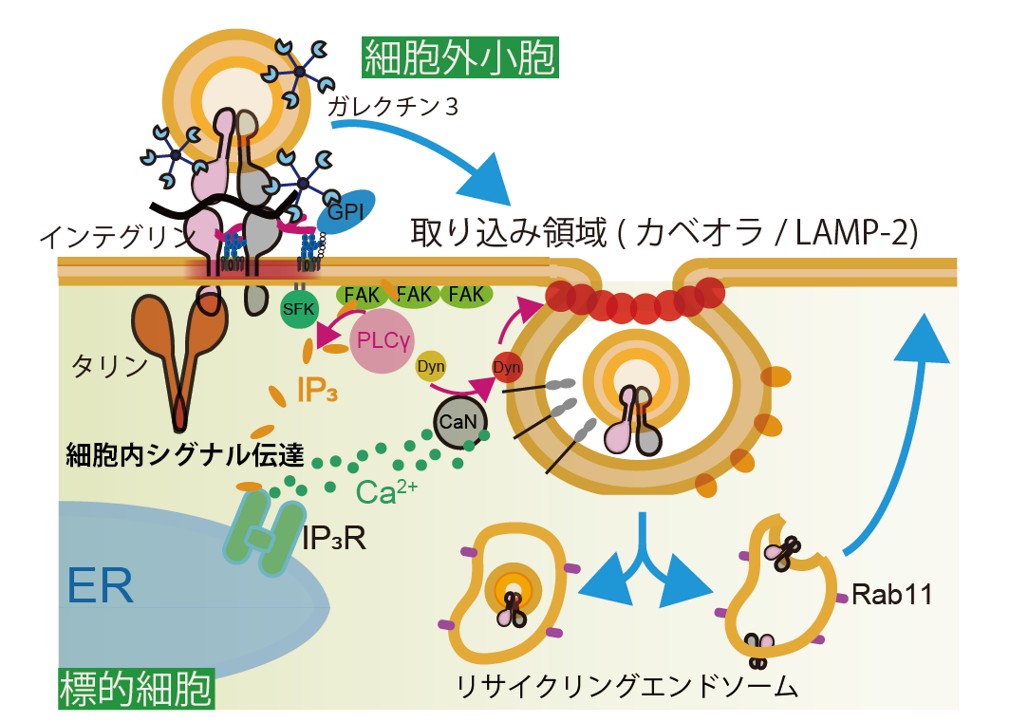
研究概要
岐阜大学糖鎖生命コア研究所教授/国立がん研究センター研究所先端バイオイメージング研究分野分野長鈴木健一、岐阜大学糖鎖生命コア研究所研究員廣澤幸一朗らの研究グループは、東北大学、東京大学との共同研究で、新しい超解像顕微鏡観察法を開発し、細胞外小胞が標的細胞に取り込まれる機構を解明しました。
近年、細胞間の情報伝達の担い手として、細胞外小胞が注目されています。しかし、標的細胞に取り込まれる機構はよく分かっていませんでした。また、細胞外小胞には様々なサブタイプがあると示唆されているため、その各々の挙動を観察する必要がありました。そこで本研究では、細胞外小胞を1粒子ずつ観察しつつ、標的細胞の取り込み関連分子も空間精度21nmで、疑似リアルタイムに超解像顕微鏡観察する手法を開発しました。この新しい顕微鏡観察法を用いることで、細胞外小胞には分子組成と膜流動性が異なるサブタイプがあり、その一部はカベオラ経由でも取り込まれること、すべてのサブタイプはその表面にある、糖鎖結合タンパク質ガレクチン3の相互作用を介してクラスリン非依存性エンドサイトーシス経由で取り込まれることを明らかにしました。また、細胞外小胞は、標的細胞膜結合後、直ちにその直下で接着タンパク質による信号伝達が誘起され、引き続き起こる標的細胞内カルシウム濃度上昇が、細胞外小胞の取り込みを促進することを明らかにしました。
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業CREST(研究領域:細胞外微粒子に起因する生命現象の解明とその制御に向けた基盤技術の創出)の一貫として行われました。本研究成果は、日本時間2025年3月12日にNature Communications誌のオンライン版で発表されました。
研究背景
近年、細胞間の情報伝達の担い手として、あるいは有用なバイオマーカーとして、細胞外小胞(注1)が非常に注目されています。細胞外小胞は、直径40-1,000nmの小胞で、ほとんどすべての細胞から分泌され、分泌細胞のDNAやmicroRNAなどの核酸や、タンパク質などの分子のみならず、ミトコンドリアなど細胞内小器官さえも含有し、標的細胞に取り込まれた後に細胞を形質転換させることが知られています。特に転移性がん細胞由来の細胞外小胞が、他臓器内の細胞に取り込まれた後で、がん細胞が転移しやすい環境が形成されるとも報告されています。しかし、細胞外小胞にはサブタイプがあることが示唆されていて、観察の難しさから、標的細胞による取り込み経路や機構については、ほとんど明らかになっていませんでした。
研究成果
本研究では、まず、分泌細胞から放出される細胞外小胞には粒子ごとにどれくらい個性があるのかを調べました。具体的にはその膜上に存在し、マーカーとして広く用いられている3種類のタンパク質(CD9、CD63、CD81)がどのような割合で含まれているのかを1粒子ずつ1分子感度で定量しました。その結果、1種類の細胞から分泌された細胞外小胞であってもマーカー分子の含有割合には偏りがあり、サブタイプ(亜型)が存在することが明らかになりました(図1A-C)。さらに膜の流動性を認識する蛍光プローブの結合量を1分子ずつカウントすることにより、サブタイプにより細胞外小胞を包んでいる膜の硬さが異なることが明らかになりました(図1D)。すなわち、CD63だけを含むものは、3種すべてのマーカーを含むもの(CD9やCD81含有細胞外小胞)よりも、膜流動性が低い(膜が硬い)ことが明らかになりました。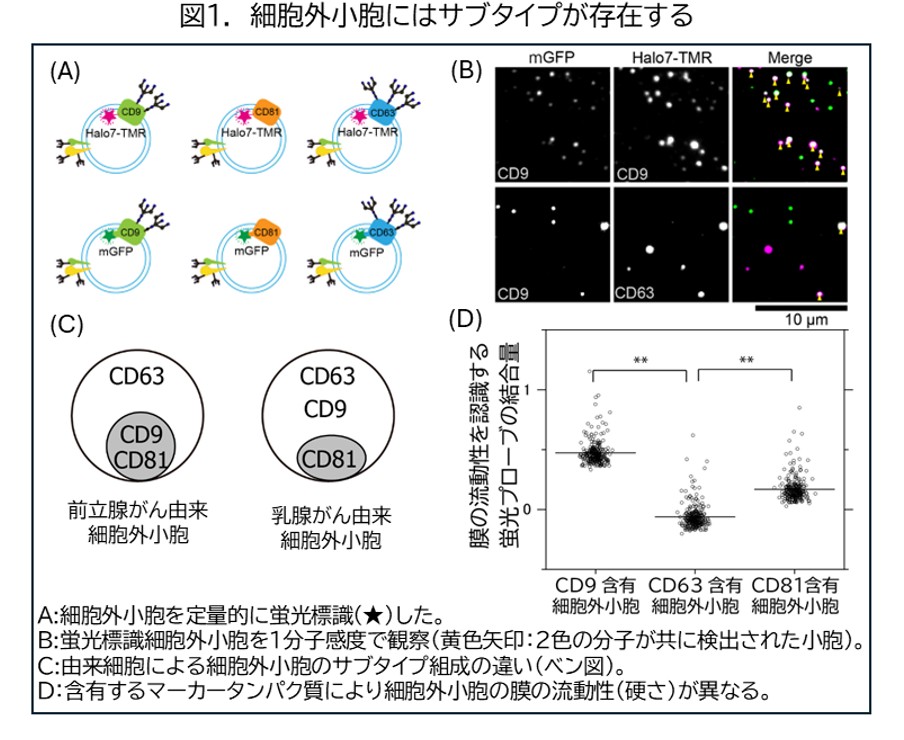
これらの結果から、単一の細胞から分泌された細胞外小胞にも個性があり、それぞれについて、取り込み経路を調べる必要があることが分かりました。
細胞は形質膜により包まれているため、細胞外の物質を細胞内へ取り込むには、クラスリン被覆ピット(注2)・カベオラ(注3)などのエンドサイトーシス(注4)制御分子の働きが必要になります。しかし、細胞外小胞やこれらのエンドサイトーシス制御分子の集合のサイズは、光学顕微鏡の分解能以下(200nm前後)であるため、1粒子レベルで細胞外小胞の取り込み過程を捉えることは難しく、これまで明らかになっていませんでした。そこで本研究では、従来、静止画の撮影に使われてきた1分子感度をもつ超解像顕微鏡法(注5)(PALM/dSTORM)を改良して、高速カメラによって数秒間で得られた大量の画像を重ね合わせていくことで、「超解像動画」を作成し、短寿命の分子の集合体を検出する手法を開発しました。この方法を用いることで、生きている標的細胞表面に結合した細胞外小胞の周りに取り込み制御分子であるカベオリン1やLAMP-2が集積し、カベオラやクラスリン非依存性エンドサイトーシス経由で細胞内に取り込まれていく様子をリアルタイムで捉えることに成功しました(図2)。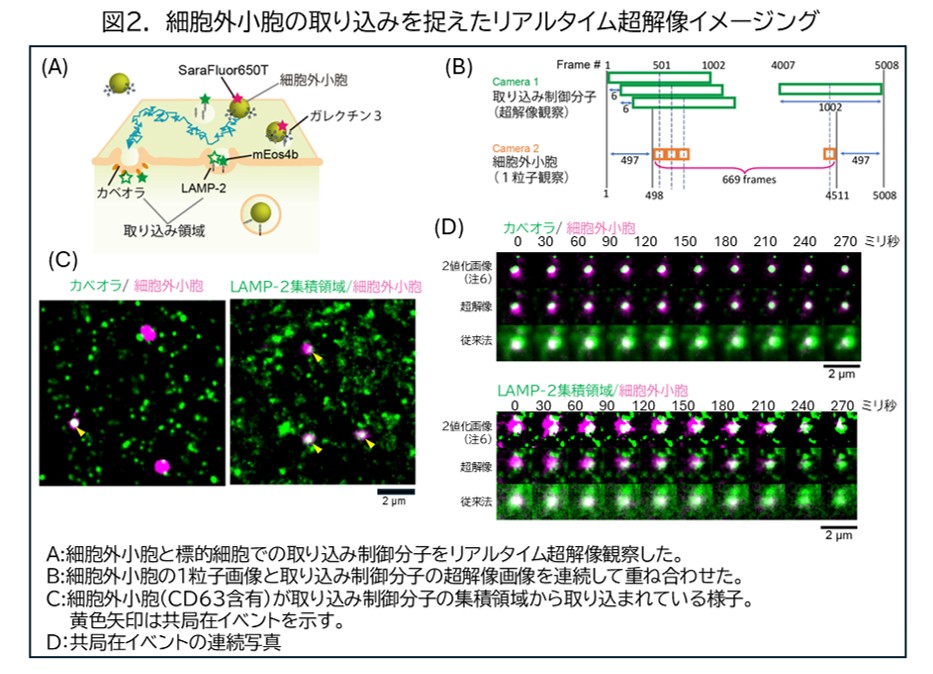
本研究により、細胞外小胞は、その含有物からいくつかのサブタイプに分かれること、一部のサブタイプの細胞外小胞はカベオラ経由で取り込まれること、しかしカベオラを経由しないサブタイプも含め全てのサブタイプは、その表面で、糖鎖結合タンパク質(注7)のガレクチン3を介してLAMP-2という糖タンパク質に結合し、クラスリン非依存性エンドサイトーシス経由で取り込まれることが明らかになりました。
さらに標的細胞の中で細胞外小胞の周囲に集合する分子を観察したところ、細胞接着に関わる分子であるインテグリンが細胞外小胞の直下の細胞膜表面で集合し、細胞内からタリンやホスホリパーゼCなどの信号伝達分子が細胞膜表面へ集まってくる様子が観察されました。また、細胞の活性化を引き起こす細胞内カルシウムイオン濃度の上昇が、細胞外小胞添加後、数分以内に発生することが分かりました(図3A)。興味深いことにこの細胞内カルシウムイオン濃度の上昇は、細胞外小胞の産生細胞と標的細胞が同種の組み合わせでは発生せず、異種の細胞の組み合わせでのみ発生しました(図3B)。分子の活性を阻害して取り込み効率を調べる実験からカルシウムイオン濃度の上昇により、標的細胞内のダイナミンなどの取り込み制御分子の活性が制御されていることが明らかになりました(図3C)。つまり、細胞外小胞の結合により引き起こされるシグナルが、その取り込み自体を促進するメカニズムが存在することが分かりました(図3D)。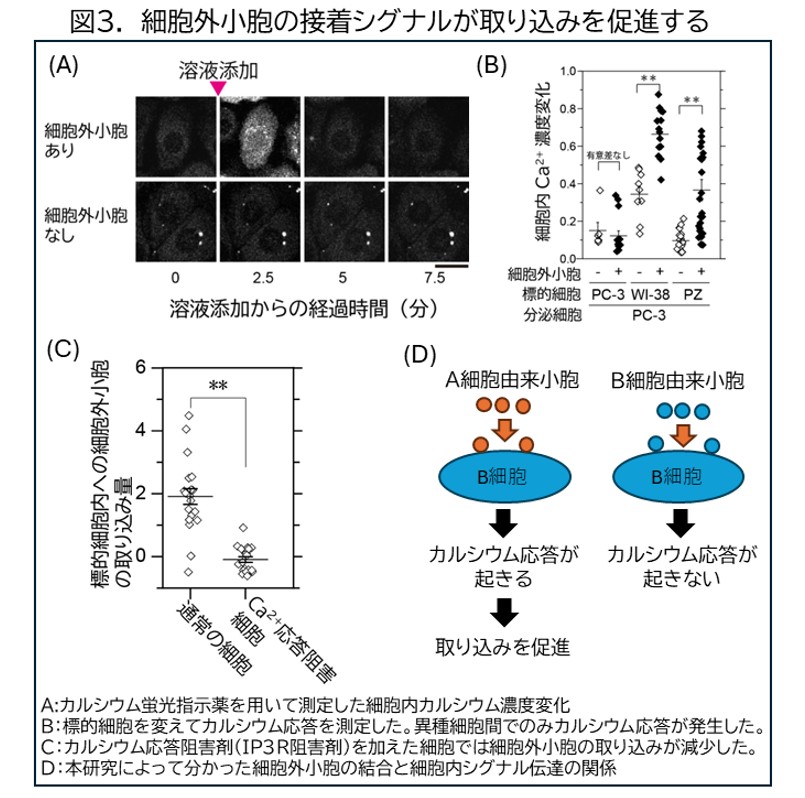
今後の展開
本研究により、細胞外小胞を介した細胞間コミュニケーションの重要ステップの一つ、標的細胞への取り込みに関わる分子機構が明らかになりました。この知見はがんの転移を防ぐ新しい治療戦略に活用できる可能性があります。また、細胞外小胞の接着自体が標的細胞を活性化し、自身の取り込みを促進させることが解明されました。さらにこの機構は細胞外小胞と標的細胞の組み合わせに依存することも明らかになりました。
細胞外小胞は、バイオマーカーとして活用されている一方で、細胞外小胞を治療用製剤として利用する試みが始まっています。細胞外小胞が標的細胞により取り込まれる機構を解明したので、治療用製剤としての細胞外小胞の研究に大きく貢献すると期待されます。
謝辞
科学技術振興機構CREST (JPMJCR18H2)、国立がん研究センター研究開発費(2023-A-03)、JSPS科研費基盤研究B (JP24K01974)、挑戦的研究(JP24K21944)、2023年度武田科学振興財団研究助成
用語解説
注1 細胞外小胞
ほとんどの細胞から分泌される直径40~1,000nmの小胞。細胞内のMultivesicular endosome(MVE)由来のもの(エクソソーム)と形質膜由来のもの(エクトソーム)がある。
注2 クラスリン被覆ピット
細胞膜から直径100-150nmのクラスリン被覆小胞の形成によって行われる細胞内取り込み機構。鉄イオンの輸送に関わるトランスフェリン受容体など多くの受容体分子がこの機構により内在化される。
注3 カベオラ
細胞膜に存在する直径50-90nmのフラスコ状の凹み、カベオリン分子の多量体によって形成される。コレステロールやスフィンゴ脂質に富み、脂質の取り込みやシグナル伝達に関与すると考えられている。
注4 エンドサイトーシス
細胞が細胞外や細胞膜上の物質を取り込む機構。細胞膜が内側に凹み、物質を包み込んで小胞を作り、細胞内に取り込む。
注5 超解像顕微鏡法
従来の光学顕微鏡では観察不可能な光の回折限界以下の分解能に到達する顕微鏡法。複数の方法が考案されているが、本研究では蛍光1分子観察技術を基礎としたPALM(光活性化局在性顕微鏡法)またはdSTORM(直接確率的光学再構築顕微鏡法)を用いた。
注6 2値化画像
画素値をあるしきい値以上と未満の2色に変換した画像。取り込み分子の超解像画像を2値化することで取り込み領域の輪郭から細胞外小胞の中心までの距離を測定し、定量的な共局在解析を行うことができる。
注7 糖鎖結合タンパク質(レクチン)
様々な糖鎖(グルコース(ブドウ糖)などの糖が鎖状につながった物質)や糖と選択的に結合するタンパク質の総称。糖鎖と結合するタンパク質であっても、抗体はレクチンに含まれない。
論文情報
雑誌名
Nature Communications
論文タイトル
Uptake of small extracellular vesicles by recipient cells is facilitated by paracrine adhesion signaling
著者
Koichiro M. Hirosawa, Yusuke Sato, Rinshi S. Kasai, Komura Naoko, Hiromune Ando, Ayuko Hoshino, Yasunari Yokota, Kenichi G.N. Suzuki*
*責任著者
岐阜大学 糖鎖生命コア研究所 (iGCORE) 教授
国立がん研究センター 研究所 先端バイオイメージング研究分野 分野長
鈴木健一
DOI
10.1038/s41467-025-57617-9
問い合わせ先
研究に関すること
岐阜大学 糖鎖生命コア研究所教授 鈴木健一 (論文責任著者)
電話:058-293-3330
E-mail: suzuki.kenichi.b7●f.gifu-u.ac.jp
報道に関すること
岐阜大学 総務部広報課 広報グループ
電話:058-293-3377
E-mail: kohositu●t.gifu-u.ac.jp
国立がん研究センター 企画戦略局 広報企画室
電話:03-3542-2511(代表)
E-mail: ncc-admin●ncc.go.jp
科学技術振興機構 広報課
電話:03-5214-8404
E-mail: jstkoho●jst.go.jp
JST事業に関するお問い合わせ
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ 沖代美保
電話:03-3512-3524
E-mail: crest●jst.go.jp
