放射線治療が誘導するがん免疫応答メカニズムを解明―1細胞解析、時空間解析による食道がん患者組織解析の成果―
2023年12月14日
国立研究開発法人国立がん研究センター
慶應義塾大学
国立大学法人東京大学
発表のポイント
- 1細胞解析、空間的トランスクリプトームという新しい手法を用いて、遺伝子・細胞レベルで放射線治療が食道がん組織に誘導するがん免疫応答を明らかにしました。
- 放射線治療により活性化する遺伝子、細胞が明らかになり、特に放射線治療中には治療に重要ながん免疫応答を抑制する細胞や遺伝子も活性化されていることが示されました。
- 本研究で見いだされた免疫細胞や遺伝子を標的にした治療法を検証していくことで、食道がんに対する有効な治療法の開発が期待できます。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)先端医療開発センター粒子線医学開発分野/東病院放射線治療科医員 影山俊一郎、レジデント 大吉秀和らの研究グループは、慶應義塾大学薬学部分子腫瘍薬学講座 柴田淳史教授、国立大学法人東京大学大学院新領域創成科学研究科メディカル情報生命専攻 鈴木穣教授らとの共同研究で、放射線治療前後の食道がん患者さんの組織を、1細胞解析注1、空間的トランスクリプトーム注2解析等を用いた時空間解析を行い、これまで不明な点が多かった放射線治療によるがん免疫応答のメカニズムを空間、細胞、遺伝子単位で明らかにしました。
本研究により、放射線治療と併用することで治療効果が期待できる標的細胞、遺伝子、併用タイミング等の重要な情報を得ることできました。特に放射線治療中に増加したPD-L1注3、IDO1、SIRPA等の免疫抑制遺伝子注4を強く発現するマクロファージ注5は重要な役割を担っていると予測され、本研究で見いだされた免疫細胞や遺伝子を標的にした治療法を検証していくことで、食道がんに対する有効な治療法の開発が期待できます。
背景
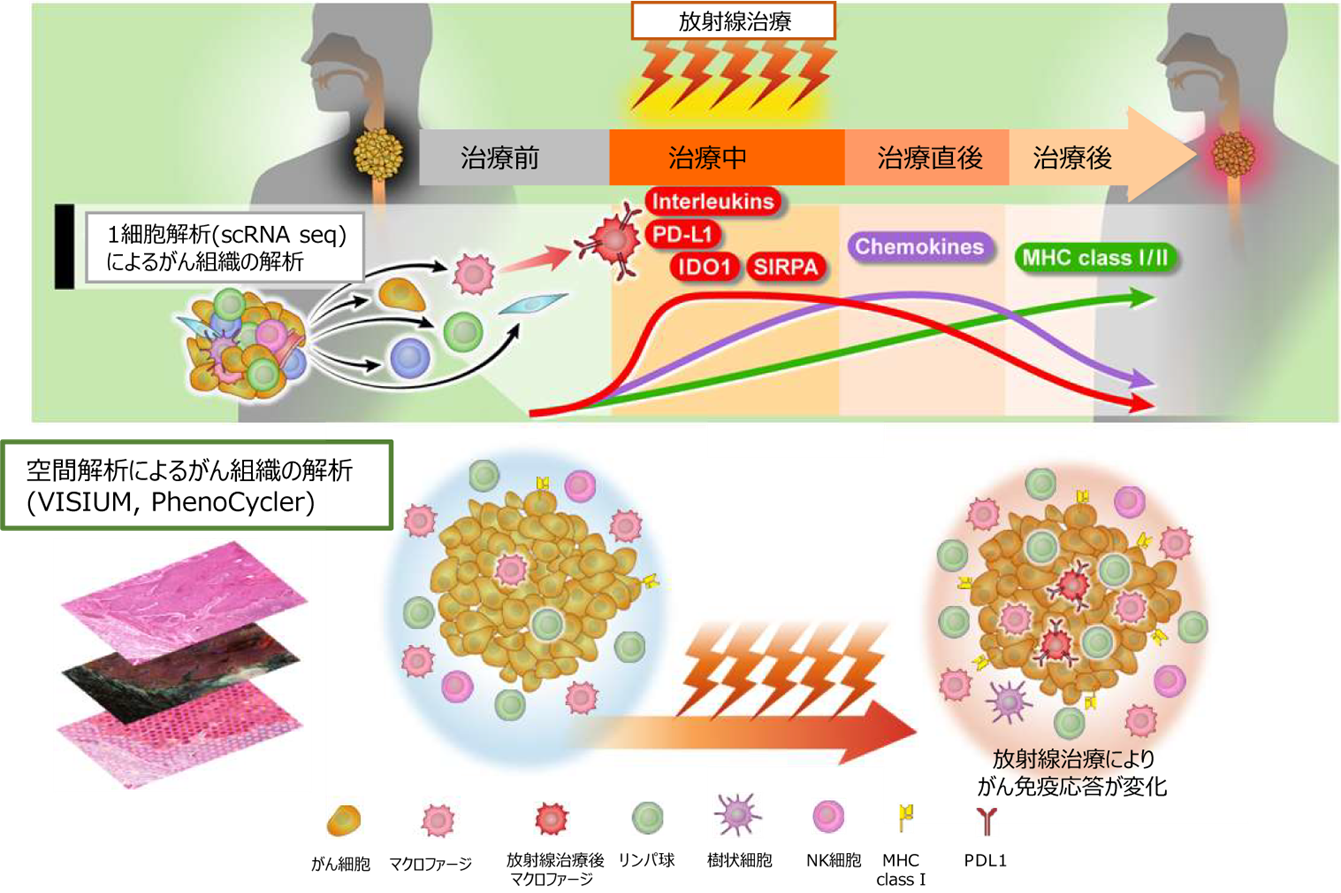
放射線治療はがん患者さんの20-50%の患者さんに適応される汎用性の高い治療法であり、近年放射線治療により活性化されるがん免疫応答が注目を集めています。特に免疫チェックポイント阻害剤と放射線治療との組み合わせは肺がんで高い効果を示し、多くのがん種でもその効果が期待されていますが、現在のところ肺がん患者さんのみに使用できる治療法です。その原因の一つに、患者さんのがん組織内で、放射線治療により誘導される免疫応答のメカニズムが未解明であることが挙げられます。
免疫応答は、細胞、遺伝子の単位で異なる働きを示し、がん組織の外の細胞、中の細胞といった空間・位置情報や、放射線治療中から治療後等の時間経過によっても大きく影響される複雑な現象であり、これまでの解析方法では詳細なメカニズムはわかっていませんでした。
今回研究チームは、新しい解析手法を用いて治療前後の患者さんのがん組織を1細胞単位で、時空間情報を含めた解析を行うことにより放射線が誘導するがん免疫応答のメカニズムを明らかにし、より治療効果の高い放射線治療を開発することを目的として研究を開始しました。
研究方法・成果
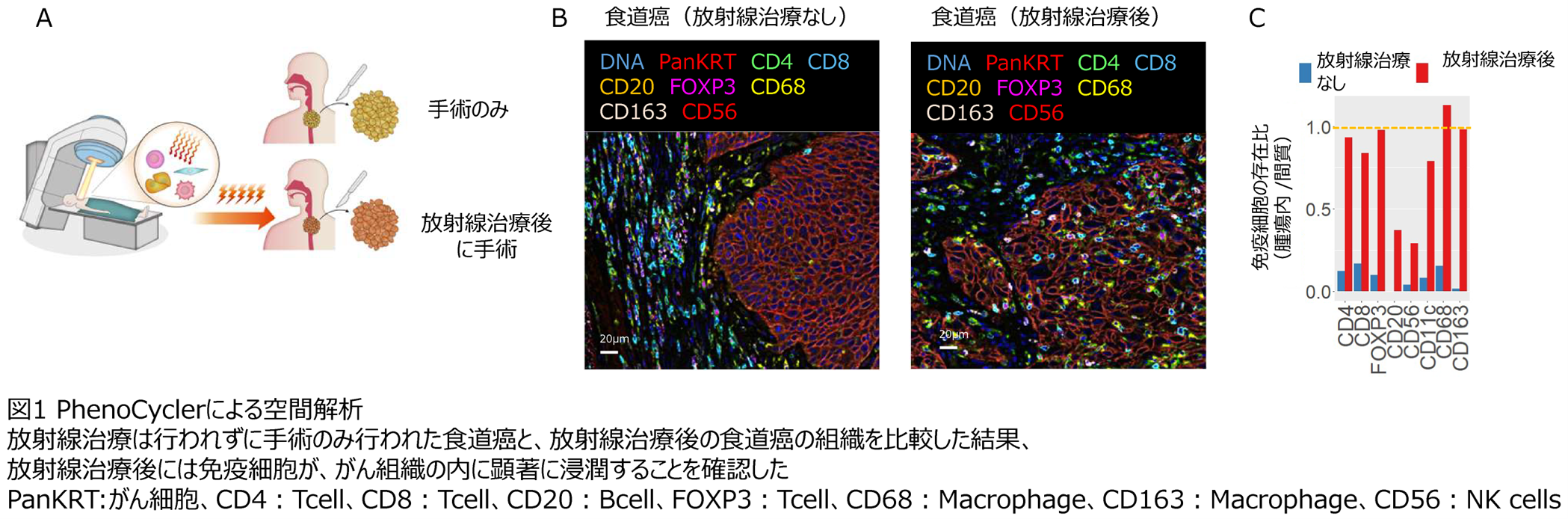
がん免疫応答は存在する免疫細胞の種類、免疫細胞・がん細胞で発現する遺伝子、免疫細胞が存在する場所等複雑なメカニズムにより成り立っています。また、放射線のような刺激の後に活性化する免疫応答は、刺激からの時間経過でも大きく変化していくことが知られています。研究チームはまず初めに、放射線治療後の空間的な変化を調べました。PhenoCycler注6(旧CODEX)という手法は最大で100程度の遺伝子に対する抗体を用いた免疫染色法で、同時に多くの免疫細胞や免疫に関連する遺伝子発現を調べることが可能です。この手法を用いて解析した結果、通常の食道がん組織の中では免疫細胞は間質と呼ばれるがん細胞が存在しない部分に大部分が局在しているのに対し、放射線治療後には免疫細胞はがん組織内に著明に浸潤していることが明らかになりました。また、中でもCD68, 163陽性のマクロファージと呼ばれる免疫細胞がより強くがん組織に引き付けられていることが明らかになりました(下図1)。
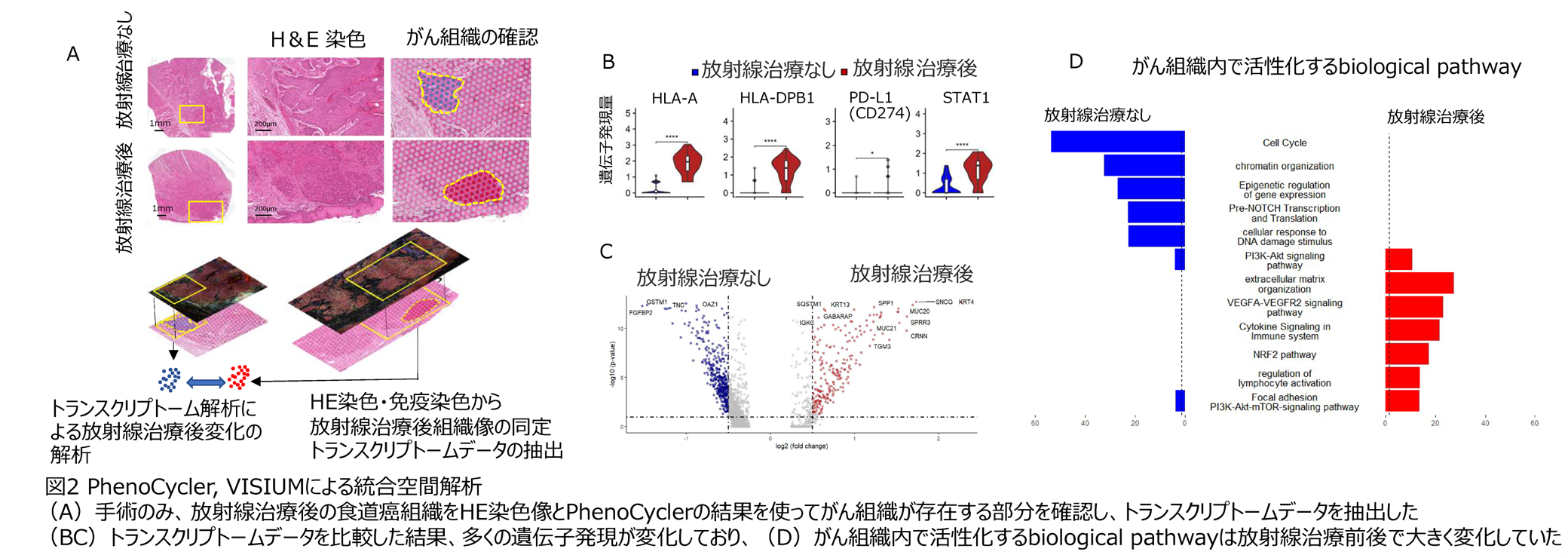
次に、図1のような手術のみ行われた食道がん、放射線治療後の食道がんそれぞれのがん組織から空間的トランスクリプトーム解析Visiumを用いてRNA発現データを抽出し、数千の遺伝子発現から放射線治療後の食道がん組織内で生じているメカニズムの考察をしました。その結果、放射線治療後にはPD-L1、MHC class I遺伝子の活性化だけではなく、VEGF、NRF2 pathwayのような特別なシグナルが生き残っていることが明らかになりました(下図2)。
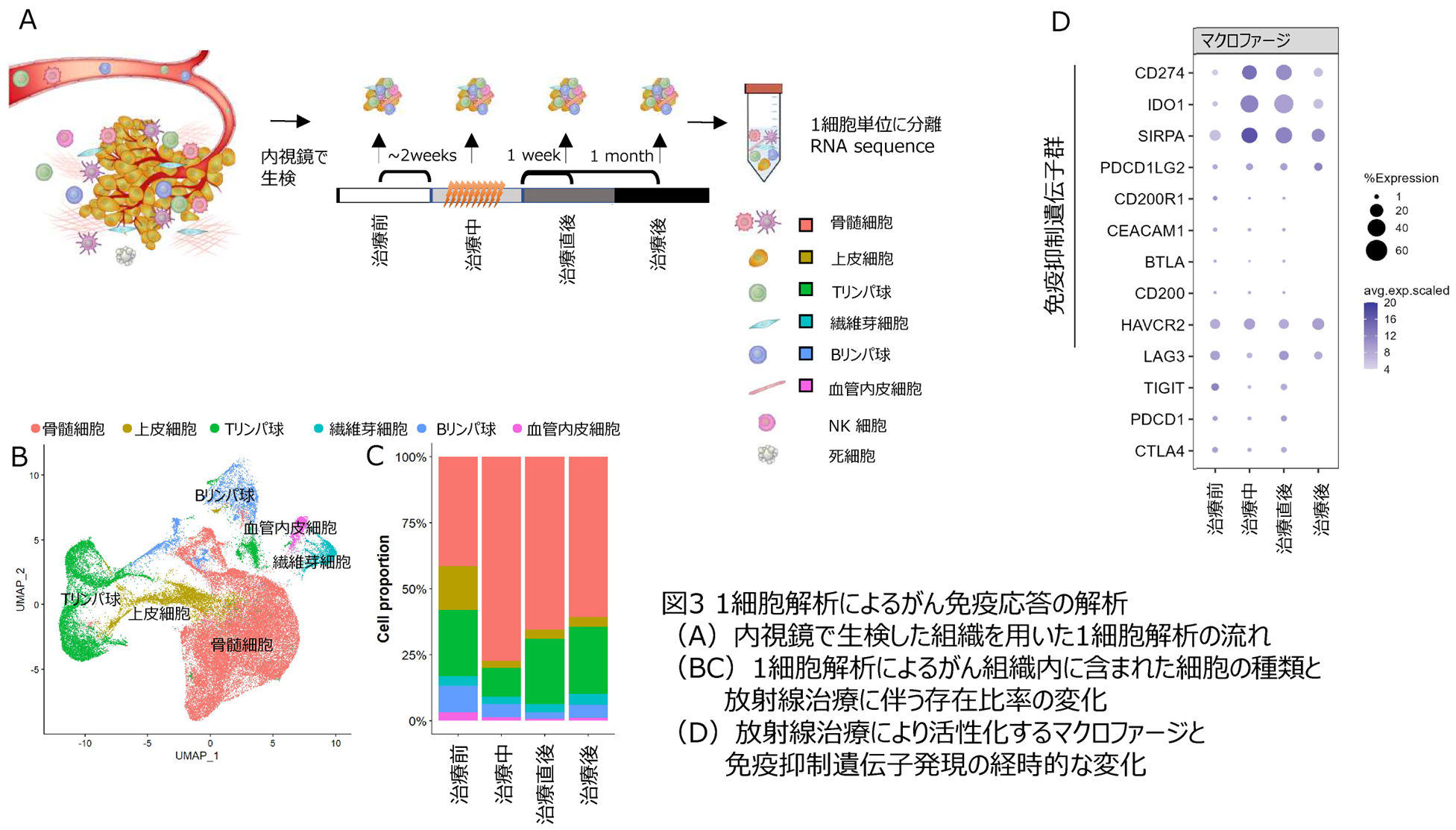
次に、放射線治療開始から治療中、治療直後、治療後1カ月の時間経過で免疫応答が大きく変化することに注目し、細胞ごとに遺伝子発現解析が可能な1細胞解析(single cell RNA sequence)を用いた解析を行いました。その結果、特に重要な発見として、放射線治療中、治療直後は骨髄細胞、マクロファージ等の一部の免疫細胞が増加し、特に免疫抑制遺伝子CD274(PD-L1)、SIRPA、IDO1が活性化していました(下図3)。
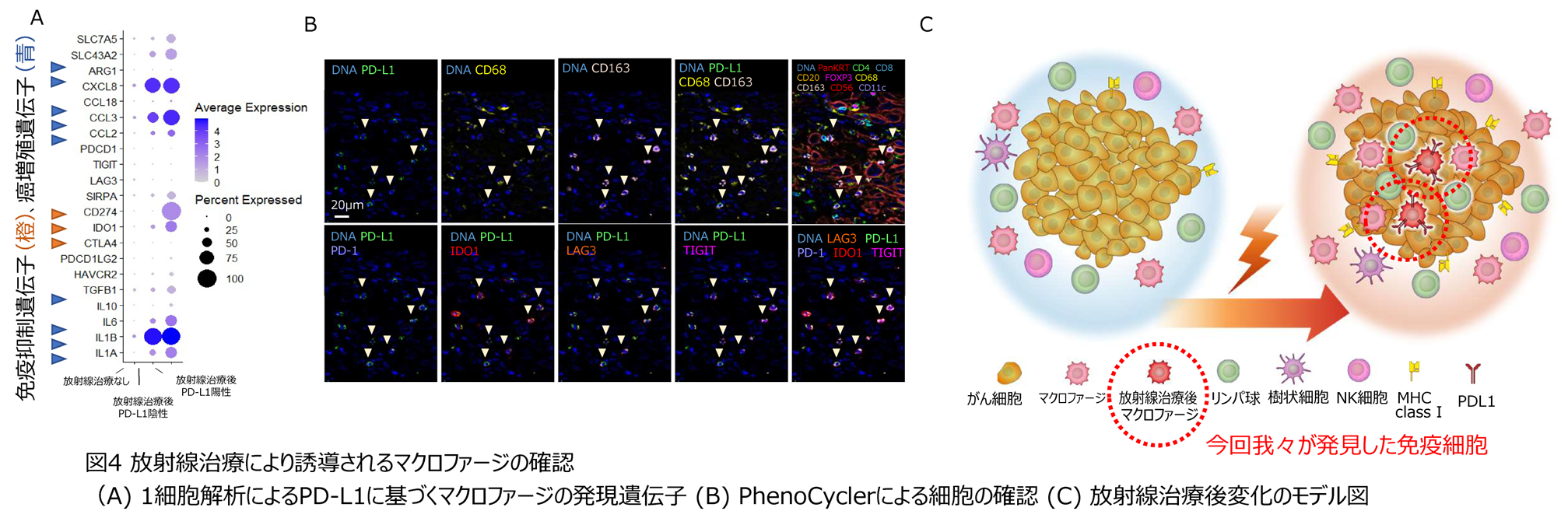
最後に、これらの放射線治療後に見られる特徴的なマクロファージについてより詳細な解析を行いました。1細胞解析により放射線治療後に生じるPD-L1(CD274)陽性細胞は非常に強い免疫抑制効果を持ち、がんの増殖に寄与していることが示されました(下図4A)。また、この細胞は放射線治療後のがん組織内に存在することが明らかとなり、放射線治療後の免疫環境の変化において重要な役割を担っていることが示唆されました(下図4BC)
展望
本研究では、1細胞解析と空間解析技術により、従来の手法では同定することが難しかった放射線治療後の患者さんのがん組織内で生じる免疫応答を、細胞・遺伝子の単位で詳細に明らかにすることができました。これは近年生み出された新規の手法とデータサイエンスを組み合わせ、患者さんの治療中、治療後のがん組織を解析することでこれまで得られなかったより多くの治療につながる有益な情報を得ることができることを示します。
また食道がんはアジアに多いがんですが、有効な抗がん剤は多くありません。今後、本研究チームが見出した細胞、遺伝子を標的にした治療法を検証していくことで、食道がんに対する有効な治療法の開発が期待できます。
発表論文
雑誌名
Science Advances
タイトル
Comprehensive single cell analysis demonstrates radiotherapy-induced infiltration of macrophages expressing immunosuppressive genes into tumour in oesophageal squamous cell carcinoma
著者
Hidekazu Oyoshi†, Junyan Du†, Shunsuke A Sakai, Riu Yamashita, Masayuki Okumura, Atsushi Motegi, Hidehiro Hojo, Masaki Nakamura, Hidenari Hirata, Hironori Sunakawa, Daisuke Kotani, Tomonori Yano, Takashi Kojima, Yuka Nakamura, Motohiro Kojima, Ayako Suzuki, Junko Zenkoh, Katsuya Tsuchihara, Tetsuo Akimoto, Atsushi Shibata*, Yutaka Suzuki* and Shun-Ichiro Kageyama*
†共同筆頭著者 *共同責任著者
DOI
10.1126/sciadv.adh9069
掲載日
2023年12月13日
URL
http://www.science.org/doi/10.1126/sciadv.adh9069(外部サイトにリンクします)
研究費
本研究は、日本学術振興会(JSPS)科学研究費助成事業基盤研究(C)放射線誘導免疫応答におけるnon-coding RNA pathwayの解析、新学術領域研究(研究領域提案型)『学術研究支援基盤形成』の先進ゲノム解析研究推進プラットフォーム(【16H06279】、【22H04925】)、日本医療研究開発機構(AMED)ムーンショット型研究開発事業【細胞運命転換を用いた若返りによるがんリスク0の世界(JP22zf0127008、JP23zf0127008)】支援を受けて行われました。
用語解説
注1 1細胞解析
組織を1細胞単位に分離し、次世代シーケンサーという機器を使い存在するRNAを同定していくことで、1細胞毎の遺伝子発現を解析する手法です。本研究では10X Genomics社のChromiumシステムを使用しました。
注2 空間的トランスクリプトーム
がん組織のように2次元、3次元構造をもつものに対して、位置情報を保持した状態でRNA発現を解析する手法です。本研究では10X Genomics社のVisiumを用いました。
注3 PD-L1 (CD274)
PD-L1(プログラムドデスリガンド1)は、がん細胞などで発現され、T細胞の活性を抑制する役割を果たす免疫チェックポイント分子です。がん細胞がPD-L1を発現することで、T細胞の攻撃を回避し、免疫逃避機構を活性化させることがあります。これを利用してPD-L1を阻害する免疫チェックポイント阻害薬ががん治療に使用されています。
注4 免疫抑制遺伝子
体の中の免疫応答は異物を排出するために働きますが、自身を傷つけないようにブレーキの役割を担う遺伝子も多数存在しています。がん組織はこれらの遺伝子の機能を利用して体の免疫から逃れていることが知られています。
注5 マクロファージ
マクロファージは免疫システムの細胞で、異物や異常な細胞を貪食し、体を守る役割を果たします。また、抗原を提示して免疫応答を誘導し、組織修復にも関与します。その名前は「大きく食べる細胞」を意味し、免疫機能において重要な存在で、がんに対する免疫の攻撃・回避いずれにも関係しています。
注6 PhenoCycler
特殊な機械とバーコーディングされた抗体を用いることで、たんぱく質発現が解析可能な免疫染色法を最大100まで同時に行うことができる手法です。類似の手法はいくつか開発されていますが、本研究ではAkoya Biosciences社のものを使用しました。
お問い合わせ先
研究に関するお問い合わせ
国立研究開発法人国立がん研究センター
先端医療開発センター 粒子線医学開発分野
影山 俊一郎
電話番号:04-7133-1111(代表)
東病院 放射線治療科
大吉 秀和
電話番号:04-7133-1111(代表)
慶應義塾大学薬学部
分子腫瘍薬学講座
柴田 淳史
電話番号:03-3434-6241(代表)
東京大学 大学院新領域創成科学研究科
メディカル情報生命専攻
鈴木 穣
電話番号:04-7136-4076(代表)
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
電話番号:03-3542-2511(代表)
Eメール:ncc-admin●ncc.go.jp
慶應義塾
広報室
電話番号:03-5427-1541
Eメール:m-pr●adst.keio.ac.jp
東京大学 大学院新領域創成科学研究科 広報室
電話番号:04-7136-5450
Eメール:press●k.u-tokyo.ac.jp
