トップページ > 研究組織一覧 > 分野・独立ユニットグループ > がん治療学研究分野 > 研究成果の概要 > ARID1A欠損がんにおけるグルタチオン代謝阻害剤を用いた合成致死治療法
ARID1A欠損がんにおけるグルタチオン代謝阻害剤を用いた合成致死治療法
研究背景と目的
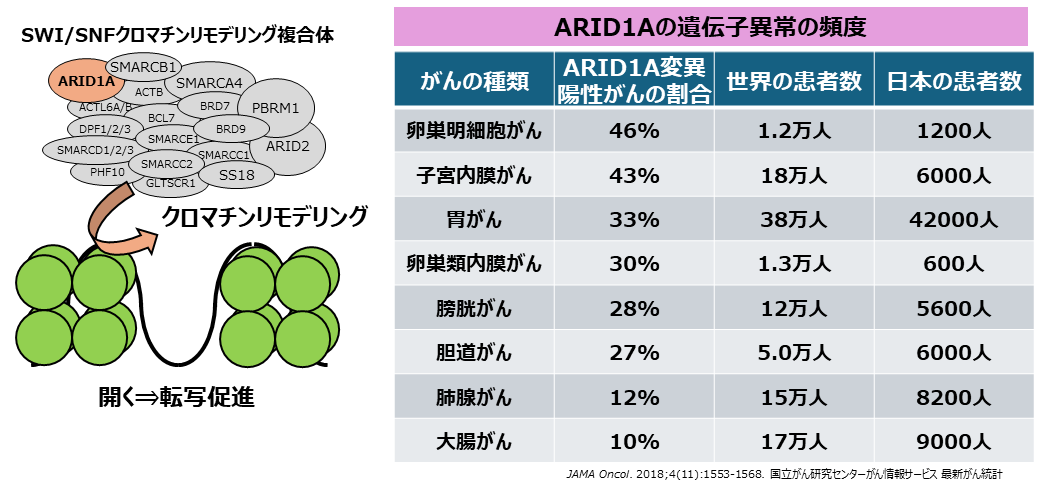
私たちは、日本人を含むアジアに多い卵巣明細胞がんや胃がんなどの難治性がんにおいて、高頻度に欠損型の遺伝子変異があるARID1A遺伝子に着目しました。ARID1Aは、SWI/SNFクロマチンリモデリング複合体を構成するサブユニットの一つです。ARID1Aが欠損しているがん種の多くは、有望な分子標的治療法がまだ確立されていません。そこで本研究では、ARID1A欠損がんに有望な治療法を確立するために、阻害剤ライブラリーを用いて、ARID1A欠損がんに特異的に感受性を示す阻害剤の探索を検討しました。
研究成果
ARID1A欠損がんに有望な阻害剤としてグルタチオン代謝阻害剤の同定
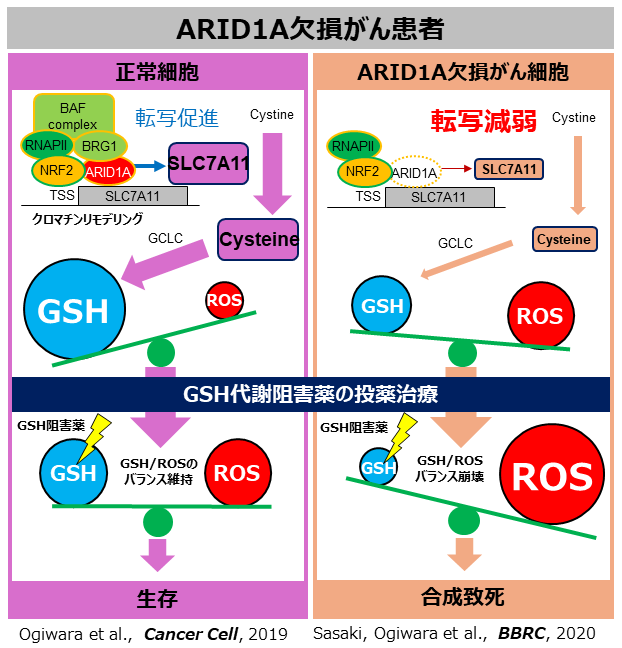
まず私たちは、ARID1A欠損細胞に対して選択的に致死性を誘導する阻害剤を探索した結果、Eprenetapopt (APR-246, PRIMA-1MET)を同定しました。Eprenetapoptは、抗酸化ストレス作用のある代謝物グルタチオン(GSH)の阻害剤でした。Eprenetapoptを処理すると、ARID1A欠損細胞で選択的に、細胞内GSH量が低下し、それとともに酸化ストレスの原因である活性酸素種(ROS)が増加することでアポトーシスが誘導されることで致死となることがわかりました。また、GSHの合成酵素GCLCの阻害薬であるブチオニンスルホキシミン(BSO)で処理したときや、GCLCをノックダウンしたときにも同様の現象が起こりました。これらの結果から、ARID1A欠損型細胞において、GSH阻害剤やGSH合成阻害剤などのGSH代謝阻害剤が有望であることが考えられました。ARID1A欠損がんにグルタチオン代謝阻害剤が有望な分子メカニズムの解明
呼吸などにより、ROSは細胞内で常に生じていますが、過剰になるとDNAなどの細胞内構造が傷つき、細胞は死んでしまいます。そのため、ROSが増えすぎないように、GSHがROSを除去しています。つまり、正常な細胞では、ROSとGSHのバランスが保たれています。なぜARID1A欠損がんでは、GSHあるいはGSH合成経路を阻害すると選択的に致死性を示すのでしょうか?GSHは、システイン、グルタミン酸、グリシンという3つのアミノ酸がつながってできた代謝物ですが、その原料となるシステイン(Cysteine)の量は、SLC7A11タンパク質によってシスチン(Cystine:Cysteine2分子がつながった代謝物)が細胞の中に運び込まれることによって維持されています。私たちは、網羅的遺伝子発現解析によって、ARID1A欠損がんではSLC7A11の発現が低下していることを発見しました。さらにクロマチン免疫沈降法によって、ARID1AはSWI/SNFクロマチンリモデリング複合体としてSLC7A11の発現を促進していることを明らかにしました。つまり、ARID1Aが欠損することで、システインの細胞内量の維持に重要なSLC7A11の発現が低下することで、細胞内システイン量が低下します。それに伴って、ARID1A欠損がんにおいて抗酸化ストレス代謝物であるGSHの細胞内量が著しく低下していました。正常細胞ではGSHは過剰に存在していることでROSの発生を抑えていますが、ARID1A欠損がんではGSHが少ないためにROSの発生を抑えることが難しい状態にあると考えられました。まさに、これがARID1A欠損がんの脆弱性の原因であったのです。したがって、ARID1A欠損がんにおいて、GSHそのものを阻害したり、GSHの合成を阻害したりすることで、ARID1A欠損がんで元々少ないGSHの細胞内量がさらに少なくなってしまいます。そして、いよいよGSHによってROSを抑えることができなくなることでROSが過剰に増加してしまい細胞死が誘導されることが考えられました。つまり、ARID1A欠損がんでは、GSHやその合成にかかわる酵素タンパク質が弱点(合成致死標的)であり、その阻害薬を用いることで、高い治療効果が期待できます。
生体モデルや臨床検体を用いた検証
卵巣明細胞がんの約50%の患者さんではARID1Aが欠損しています。卵巣明細胞がんの患者さんの臨床病理検体や患者由来細胞株を解析した結果、ARID1A欠損型のがん患者さんではSLC7A11の発現が顕著に低下していました。また、ARID1A欠損型の卵巣明細胞がん細胞株のマウス移植腫瘍モデルにおいて、GSHの阻害薬であるAPR-246を投与したり、GSH合成因子阻害剤のBSOを投与したり、GSH合成酵素GCLCを腫瘍内で抑制したりしたときに、腫瘍内のGSHが減少し、一方で、ROSが増加することでアポトーシスが誘導されることが確認され、それらの効果によって抗腫瘍効果を示すことがわかりました。
研究成果のまとめ
本研究のがん治療法の提案は、ARID1A欠損がん細胞には正常細胞にはない「代謝(メタボローム)の弱点」があるという発見に基づいています。よって、この最適化がん治療法は、正常細胞への影響が少ないため、がん細胞に選択的な効果の高い治療法となる可能性があります。また、ARID1A欠損は、卵巣がんなどの婦人科がん、胃がんなどの消化器がんを含め、特に日本をはじめとしたアジアに多く、治療法が確立されていないがんで観察されます。また、ARID1A遺伝子変異は、遺伝子パネル検査での同定も可能です。これまでに、卵巣明細胞がんにおけるARID1A欠損がんに対して、GSH阻害治療の有望性を示すことができました(Ogiwara et al., Cancer Cell, 2019)。また、日本人にも多い胃がんの25%ではARID1Aの遺伝子異常が認められます。特に、胃がんのなかでも、未分化型のびまん性胃がんは悪性度が高く標準治療薬抵抗性の難治性の胃がんです。さらに、胃がんの中でも膵臓がんに匹敵するスキルス胃がんもびまん性胃がんの4割に分類されています。私たちは、国立がん研究センターで樹立されたびまん性胃がんの患者由来細胞株を用いて、ARID1A欠損型びまん性胃がんに対してもEprenetapoptによるGSH代謝阻害剤が有望であることを見出しました(Sasaki et al., Biochem Biophys Res Commun, 2020)。
今後の展望
メタボロームを標的とした抗がん剤はまだまだ未開拓ですが、有望かつ新しい創薬領域です。GSH阻害薬やGSH合成酵素の阻害薬はすでに治験薬として検討されています。本研究において、GSHを阻害するEprenetapopt (APR-246, PRIMA-1MET)(Aprea Therapeutics社の治験薬)やGSH合成酵素を阻害するbuthionine sulfoximine(BSO)(治験薬)が、ARID1A欠損がんの治療に有望であることを示すことができました。これらの治験薬を用いてARID1A欠損がんへの臨床試験を検討し、治療法の確立を目指していきたいと考えています。一方で、この治療法を真に実現すべく製薬企業と共同研究で新しいGSH合成阻害薬の創薬開発を進めています。最終的には臨床応用を目指すことでARID1A欠損型の難治性がんの克服に貢献したいと考えています。
このようにGSH代謝阻害剤は、ARID1A欠損型の卵巣明細胞がんやびまん性胃がんなどの治療法が確立されていない難治性がんに有望であることが期待されます。さらに、GSH代謝阻害剤の有望ながん種を拡大していきたいと考えています。ARID1Aは、SWI/SNFクロマチンリモデリング複合体の構成因子ですが、ARID1A以外のSWI/SNF構成遺伝子も様々な難治性がんで高頻度に欠損型の遺伝子異常が見つかっています。これらのSWI/SNF構成遺伝子の欠損がんに対してもGSH阻害剤が有望であるかについての検討をしています。
参考文献
Ogiwara H, Takahashi K, Sasaki M, Kuroda T, Yoshida H, Watanabe R, Maruyama A, Makinoshima H, Chiwaki F, Sasaki H, Kato T, Okamoto A, Kohno T.
Targeting the Vulnerability of Glutathione Metabolism in ARID1A-Deficient Cancers.
Cancer Cell. 2019 Feb 11;35(2):177-190.e8. doi: 10.1016/j.ccell.2018.12.009.
https://www.ncbi.nlm.nih.gov/pubmed/30686770
Sasaki M, Chiwaki F, Kuroda T, Komatsu M, Matsusaki K, Kohno T, Sasaki H, Ogiwara H.
Efficacy of glutathione inhibitors for the treatment of ARID1A-deficient diffuse-type gastric cancers.
Biochem Biophys Res Commun. 2020 Feb 5;522(2):342-347. doi: 10.1016/j.bbrc.2019.11.078.
https://pubmed.ncbi.nlm.nih.gov/31761322/
がん研究センタープレスリリース
2019年1月25日
日本人に多い卵巣明細胞がんなどでみられるARID1A遺伝子変異がんを対象に
代謝(メタボローム)を標的とした新たながん治療法を発見
https://www.ncc.go.jp/jp/information/pr_release/2019/0125/index.html

