トップページ > グループ紹介 > バイオマーカー探索トランスレーショナルリサーチ分野(築地) > 主な研究内容
主な研究内容
企業やアカデミアのシーズ・薬剤を先端医療開発センター(EPOC)から導出するためのアジアに特徴的ながんの自家樹立細胞株を用いた前臨床試験
英国サンガーセンターの主ながん関連遺伝子変異情報や次世代シークエンサー解析による融合遺伝子情報(Klijn C et al, Nat Biotechnol 2015)は約1000種のがん細胞株で公開されているが、アジアに多い胃がんはそのうちの28種に過ぎない。その多くは古い時期に樹立されたもので、臨床病理情報を欠き、組織型さえ不明なものも多い。当分野では、2010年度から腹膜再発が頻発する未分化型胃がん患者の腹水から新たな細胞株の樹立を試み、2018年7月までの新規樹立株の累積数は51例89株(National Cancer Center Stomach Cancer, NSCシリーズ)となった。さらに国内外の細胞バンクより購入した既存株などを合わせると未分化型胃がん由来株として、68例110株を保有している。また、同様に膵がん25例32株、卵巣がん8例9株、脂肪肉腫2症例2株、および胆管がん、中皮腫、食道胃接合部がん、乳がん、各1症例1株の樹立に成功している。自家樹立株には、in vitroおよびin vivoのイメージングのためのルシフェラーゼ遺伝子とGFP遺伝子の導入の他、Affymetrix Genechip U133 v2、SNPアレイ、NCC Oncopanel v4などの基本オミックス情報を付加している。また、これらの樹立株を免疫不全マウスの腹腔に接種し、形成された腫瘍について、HE染色、Ki-67免疫染色、AZAN染色(間質評価)、アルシアンブルー染色(粘液形質評価)を行い、病理組織学的プロファイルの蓄積と同時に、腫瘍形成能、悪疫質の評価を進め、PDXモデルの構築も継続している。これらの情報を基に、EPOCからの治験導出を目指し、国内外の製薬会社との共同研究によって、種々の分子標的薬の前臨床試験を遂行した。そのうち、2種の薬剤は企業治験の実施へ向けた検討に入った。
胃がんの機能探索型オミックス解析
アジアに多い胃がんは、分化型がんと未分化型がんの2種に大別される。びまん性に増殖する未分化型胃がんは、分化型からの移行例もあるが典型的にはピロリ菌感染のない胃粘膜峡部から直接発生し、男女差、民族差は小さいとされている。その特徴的な再発形式が腹膜播種であること、原発巣のゲノム解析は国内外からの発表がすでにあることから、未分化型胃がん患者の原発巣ではなく腹水中のがん細胞を対象とした機能探索型オミックス解析を行っている。
1) 3層のオミックス解析(ゲノム、トランスクプトーム、エピゲノム)解析を施行した。なおエピゲノムについては、金井弥栄先生(現慶應義塾大学病理学教室)による独立の原発巣の検体の解析も本プロジェクトで行われた(Yamanoi K, et al., Carcinogenesis 36: 509-520, 2015)。
2) 従来、ゲノム・トランスクリプトーム解析で見つかるドライバー候補遺伝子変異頻度は10%以下のものが多いことや未分化型胃がん由来既存細胞株がわずか17種のみであることから、内在遺伝子変異株の入手は困難であった。当部門のプロジェクトでは解析対象試料から直接、細胞株を樹立することによって網羅的な機能解析を可能になった*(脚注)。
注:(脚注)近年、まだ原発巣に留まるが、次世代シークエンサー(NGS)での解析によって、多くのがんのゲノム網羅的な遺伝子異常リストが公開されている。しかし、そこで発見される創薬標的候補遺伝子異常をもつ細胞株を既存のバンクから探そうとしても、見つからないことが多い。その際、同種のがん細胞株に遺伝子改変を行い機能を調べる場合、その細胞に同一分子経路内の別の遺伝子に異常が内在すると、改変遺伝子の機能は打ち消される。また、仮に機能が発現したとしても、強制的なものであり、元来の患者のがんでの機能を示していることにはならない。そのため、遺伝子改変細胞によって新薬の探索、同定ができても、実際には効果が出ないことが危惧される。従って、患者由来の遺伝子異常をもつ細胞株があれば、手間な遺伝子改変ではなく、siRNAの導入のみでがん遺伝子として働きや依存性を簡単に知ることができる。当然、50から300程度見つかる変異遺伝子の網羅的機能解析も可能である。このようにNGS解析による探索研究対照試料から直接、細胞株を樹立することが極めて重要である。
3) 胃がんでは、がん遺伝子の高度遺伝子増幅(数珠繋ぎに増幅ユニットが連結、他の染色体に挿入等)が良く知られているが、未分化型胃がん原発巣で見つかるFGFR2, METの増幅頻度(各4から9%, 2から3%)は、腹膜転移後のがん細胞では各16%, 16%と高くなっていた。これと呼応するように、原発巣では報告のない、かつ10%以上の症例で高度遺伝子増幅を示す染色体領域を新たに8か所同定できた。
4) 融合遺伝子については、既報の約700種のがん細胞株のRNAseq (Nat. Biotech, 2015)で見つかっていない新規のドライバー融合遺伝子を発見し、特許を申請した。
5) Exome解析で見つかった遺伝子変異は、症例あたり50から200か所であった。変異頻度が上位42番までの遺伝子のうち30遺伝子は原発巣の研究では報告されていない。分子経路的には、FGFR2、METおよびKRAS/NRASのRTK-RAS系の活性化がほぼ相互排他的に62%で起こり、TGF-β系、最近注目のARID1Aを含むSWI/SNFクロマチン制御系およびRHOA系の不活性化がいずれも30%以上で起こっていた。これら変異の内在株も得られており、機能解析が可能である。
。
胃がん、食道がんの個別化医療を目指した本態解明および診断薬、治療薬の開発
【胃がん】未分化型胃がんの再発形式は腹膜播種が多く、治癒的切除可能進行がん(IIからIII期)の開腹時腹腔洗浄細胞診(CY)陽性患者の80%は3から4年以内に腹膜播種を起こす。さらに、5年以内に85%の患者で腹水を貯留し、この段階で予後2から3か月と診断される。I期から腹水を貯留する卵巣がんと異なり、未分化型胃がんはI期ではほぼ100%の患者でCY陰性である。IIからIII期では、末梢血、骨髄液中にがん細胞が既に存在しているにも関わらず、腹膜播種が主な死因である。すなわち、肝臓や肺への遠隔転移より、腹膜へ転移しやすい性質を持つと考えられ、CY陽性の時期から有効な治療が行われれば、予後は大きく変わる可能性がある。本年度は、共同研究によって腹膜播種関連キナーゼ遺伝子DDR2を同定した。また、診断薬としては、本年度も、腹腔洗浄液中の微量がん細胞を検出し、術後再発の予測と術前化学療法の効果を監視できる6種のマーカー遺伝子と3種の内外部コントロール遺伝子からなるミニDNAチップの改良を住友ベークライト株式会社との連携で行った。
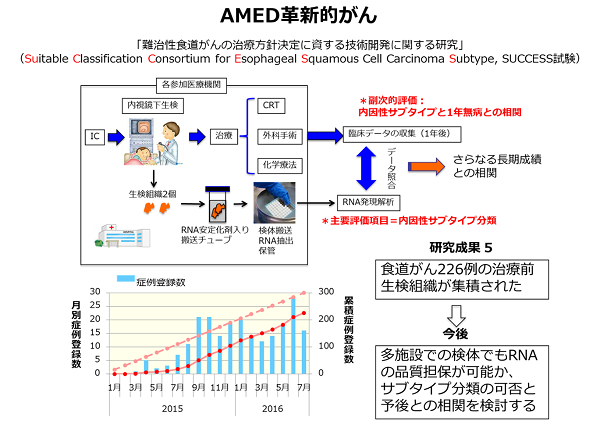
【食道がん】:食道扁平上皮がんの根治的化学放射線療法(根治的CRT)は低侵襲性な治療であるが、5年生存率が37%であるため、治療前効果予測と予後不良症例の本態解明が重要である。そこでIIからIII期の局所進行がんの治療前生検試料274症例を用いた網羅的な遺伝子発現解析を行った。治療開始時期によって107例と167例の2つのセットに分け、教師無しクラスター解析と転写因子ネットワーク解析により根治的CRTでの予後に相関したサブタイプの同定を行った結果、5つのサブタイプ(1a, 2a, 3b、5, 7)を見出し、サブタイプ1aはM1(間質型1)、2aはI(免疫活性化型)、5はM2(間質型2)および7はE(上皮型)と命名した。 各サブタイプで特異的に高発現する遺伝子から固有の分子経路を推定したところ、サブタイプM1では転写因子PRRX1による間質誘導の分子経路が、サブタイプM2では転写因子FOXE1による放射線抵抗性・薬剤抵抗性関連の分子経路が、サブタイプEでは転写因子SIM2による分化誘導の分子経路がそれぞれ活性化していることが予想された。H28年度は、予後が良いサブタイプEの分化形質やCDDP、放射線に対する感受性形質をSIM2が規定していることをin vitro およびin vivoで示した(Tamaoki M, et al., Cancer Sci. 2018)。さらにEタイプ以外の症例では、転写因子SIX1によってTGF-βの分子経路が活性化し、悪性基底細胞の自己複製を促し、分化を抑制し、放射線に抵抗性となることを示した(Nishimura T, et al., Cancer Sci. 2017)。以上のように、生物学的根拠を基にした診断薬の開発を着実に進めることができている。さらに、CRTによって細胞障害性T細胞が活性化している信号が誘導されるIサブタイプ(Tanaka Y, et al., PLoS One 2015)の患者に対する、免疫チェックポイント阻害剤の医師主導治験の準備を開始した。一方で、治療前生検による予知医療のための体外診断薬の開発については、2014から2016年度までAMED革新的がんの支援を受け、全国10施設から226例の治療前生検試料を集め(SUCCESS試験、下図)、予後良好なサブタイプEを治療前に分類するためのマイクロアレイを使用した我が国初の診断薬として、製薬会社と共同で開発を継続している(2017から2019年もAMEDの継続支援)。
胃がん、食道がんのがん幹細胞の同定と微小環境(ニッチェ)の把握・再構築
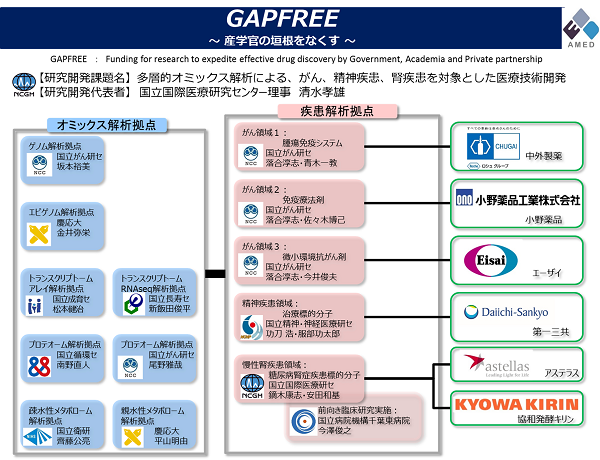
未分化型胃がんの再発形式は腹膜播種が多く、治癒的切除可能進行がん(IIからIII期)の開腹時腹腔洗浄細胞診(CY)で陽性患者の80%は3から4年以内に腹膜播種を起こし、5年以内に85%の患者で腹水を貯留し、2から3か月の余命を宣告される。卵巣がんのように、I期から腹水を貯留するがんと異なり、未分化型胃がんはI期では100%の患者でCY陰性である。IIからIII期では、抹消血、骨髄液中にがん細胞が既に存在しているにも関わらず、死因は腹膜播種である。すなわち、肝臓や肺への遠隔転移より、腹膜へ転移しやすい性質を持つと考えられる。そのため、CY陽性の時期から有効な治療が行われれば、予後は大きく変わる可能性がある。当部門では最近、腹膜播種関連がん幹細胞マーカーとしてCXCR4およびCXCR7を見つけ、がん幹細胞の分離に成功した(Fujita T, Chiwaki F, et al., PLoS One 2015)。CXCR4陽性細胞は浸潤、抗がん剤耐性、スフェロイド形成、腫瘍形成の能力が高く、マウスの腹腔内に移植すると、無数の結節を作り、腹水を貯留した。CXCR4およびCXCR7は、患者腹水から樹立された新規樹立株および既存株の70%でがん幹細胞のマーカーになると推測される。現在、残り30%の細胞株のマーカーの探索と並行して、がん幹細胞標的薬の開発を行っている(Suzuki M, Chiwaki F, et al., PLoS One 2015)。また、未分化型胃がん細胞は腹膜中皮を活性化し、中皮細胞依存的に生存することも多く、さらに結節を作ると原発巣と同様に線維芽細胞や血管内皮細胞との相互作用で生存、増殖する。このような間質との相互作用を遮断する薬の開発も行っている。さらに、AMED創薬基盤研究推進事業・産学官マッチング型研究プロジェクト(通称GAPFREE)にて、免疫系との相互作用を含めたがんの微小環境を標的とした革新的診療法の開発を行っている(下図)。
日本では食道扁平上皮がん細胞株の樹立、バンクへの寄贈が進んでおり、KYSEシリーズ39株、TEシリーズ9株、その他4株の合計52株を入手することができる。そのうち12株は107細胞を免疫不全マウスに移植しても2ヶ月以内に腫瘍形成が認められない。6ヶ月ほどで形成される小さな腫瘍を培養、移植を繰り返し、これまで、12株中8株から高腫瘍形成能を獲得した亜株を樹立してきた。これでin vivo 非臨床試験が可能な食道扁平上皮がん細胞株は、52株中48株となった。さらにこのがんで特徴的に遺伝子が増幅、高発現する受容体型チロシンキナーゼEGFRの阻害剤に対して耐性な12株の分離に成功した。一方、正常食道多重扁平上皮最下層の基底細胞マーカーであるPDPNやNGFRが食道がん幹細胞マーカーとして知られている。食道扁平上皮がん細胞の3次元培養を行うと悪性基底細胞から傍基底細胞、角化細胞への分化をPDPNの免疫染色で観察することができる。また、免疫不全マウスの皮下に移植すると組織学的に分化度を知ることができる。食道がん細胞株を悪性基底細胞の自己複製能の強い細胞株と弱い細胞株(分化した細胞分画が多い)に分け、分化誘導因子、抑制因子の探索を行い、食道扁平上皮がんの分化誘導療法の開発を行っている。
コアファシリティー業務としてのマイクロアレイ解析支援および自家樹立細胞株の提供
センター内の研究者からのAffymetrix Genechip U133 v2による網羅的遺伝子発現の解析の依頼について、主成分分析、クラスター解析、遺伝子選抜等の支援をした。AMED革新的がんでは、全国10施設から局所進行食道がん患者226例の治療前生検試料を集め、その全例のアレイデータを得た。また、大阪国際がんセンターとの共同研究では、早期食道がん患者104例の治療前生検のアレイデータを得た。また国内のアカデミア、センター内の研究者からの自家樹立株等の使用依頼は増えており、共同研究の扱いで提供している。また、国内製薬会社には、MTAの締結のもと、有償で提供している。
