日本人でのゲノム解析から創製された新薬が難治性がんである胆道がんの治療薬として承認~大規模ゲノム解析から患者さんに治療薬を届ける実例~
国立研究開発法人国立がん研究センター
国立研究開発法人日本医療研究開発機構(AMED)
発表のポイント
- 胆道がんは5年生存率が20%以下と予後不良な難治性がんであり、また年間罹患者が2万人とまれなため臨床研究の実施が難しく、アンメットメディカルニーズの極めて高いがんであり、新たな治療法の開発が強く望まれています。
- 国立がん研究センター研究所では2015年に日本人胆道がんを対象とした大規模シークエンス解析から治療標的となりうるFGFR2融合遺伝子を同定しました。更にそれを標的とした胆道がんの治療薬としてエーザイ株式会社が創製したFGFRキナーゼ阻害剤 タスルグラチニブ の臨床試験の実施については、国立がん研究センター中央病院、東病院と連携することで迅速に進めることができました。
- タスルグラチニブは国際共同第II相試験(E7090-J000-201 試験)によってその有効性が示され、2024年9月に「がん化学療法後に増悪したFGFR2融合遺伝子陽性の治癒切除不能な胆道癌」の効能・効果で新薬として承認されました。
- 日本人症例のゲノム解析を起点とした治療薬の承認により、今後難治性で希少である胆道がんの個別化医療・予後改善が進むことが期待されます。
概要
国立研究開発法人国立がん研究センター(東京都中央区、理事長:中釜斉)研究所(所長:間野博行) がんゲノミクス研究分野分野長 柴田龍弘は、大規模な日本人症例のゲノム解析により難治性がんである胆道がんの治療標的としてFGFR2融合遺伝子注1を2015年に同定しました*1。さらにエーザイ株式会社(エーザイ)が創製したFGFR2融合遺伝子を標的とするFGFRキナーゼ阻害剤 タスルグラチニブの臨床試験の実施については、国立がん研究センター中央病院、東病院と連携することで臨床開発を進めました。国際共同第II相試験によってその有効性(客観的奏効率:30%、臨床的有効率:51%)が示された結果により、エーザイが日本において承認申請を行い、2024年9月24日に「がん化学療法後に増悪したFGFR2融合遺伝子陽性の治癒切除不能な胆道癌」の効能・効果で新薬として承認されました。国立がん研究センター研究所は、FGFR2融合遺伝子が胆道がんの治療標的となることを同定(2015年)し、さらに国立がん研究センター中央病院と連携し診断法(FISH法)の開発につながる研究成果を収めることで、同薬剤の開発に貢献しました。同薬剤の承認により今後、難治性がんである胆道がんに対する治療薬の選択肢が増え、またゲノム診断による個別化医療と予後改善が進むことが期待されます。
本研究成果*1*2*3は、基礎領域の研究成果を確実に医療現場に届けるため、 非臨床領域の後半から臨床領域を中心として、がん医療の実用化をめざした研究を推進する国立研究開発法人日本医療研究開発機構 (AMED)「革新的がん医療実用化研究事業」の支援により実施され、エーザイによる包括的なゲノム解析による胆道がんの治療標的同定を起点としたFGFR阻害剤の臨床開発の円滑な進行に貢献しました。
*1Nakamura H. et al., Genomic spectra of biliary tract cancer, Nat Genet, 2015.
*2Jusakul A. et al., Whole-Genome and Epigenomic Landscapes of Etiologically Distinct Subtypes of Cholangiocarcinoma, Cancer Discov. 2017.
*3Maruki Y. et al., Molecular detection and clinicopathological characteristics of advanced/recurrent biliary tract carcinomas harboring the FGFR2 rearrangements: a prospective observational study (PRELUDE Study), J Gastroenterol. 2020
背景
胆道がんは日本を始めアジアでの発症が多く、日本における5年生存率は20%以下と予後不良な難治性がんです。国内の年間罹患者が2.2万人とまれなため臨床研究の実施が難しく、アンメットメディカルニーズ注2の極めて高いがんであり、新たな治療法の開発が強く望まれています。
国立がん研究センター研究所がんゲノミクス研究分野では、日本人胆道がんを対象とした大規模ゲノムシークエンス解析から5種類のFGFR2融合遺伝子を同定し、さらにFGFR2融合遺伝子が胆道がんにおける重要ながんドライバー遺伝子注3であることを2015年に報告しています*1。また、国立がん研究センター中央病院の臨床グループと連携し、多施設共同研究組織を立ち上げ、FGFR融合遺伝子の診断法を確立し、423名の進行もしくは再発症例の日本人胆道がん患者さんのうち7.4% (20/272)においてFGFR2遺伝子再構成注4を検出しました*3。
タスルグラチニブは、エーザイ株式会社筑波研究所で創製された経口投与可能なFGFRキナーゼ阻害剤で、FGFR 遺伝子異常を有するがん患者さんに対する有効性が期待されていた*4ことから、国立がん研究センターが同定した5種類のFGFR2融合遺伝子に対する阻害効果を確認したところ有効であることが示されたため、エーザイ株式会社並びに国立がん研究センターはタスルグラチニブの胆道がん用途に関する特許を共同出願しました(PCT/JP2016/059162)。
*4 Miyano SW. et al., E7090, a Novel Selective Inhibitor of Fibroblast Growth Factor Receptors, Displays Potent Antitumor Activity and Prolongs Survival in Preclinical Models, Mol Cancer Ther, 2016.
展望
現在、胆道がんでのゲノム異常を標的とした臨床開発はめざましい勢いで進められています。タスルグラチニブの承認によって、FGFR2融合遺伝子を有する胆道がんに対する有効な治療薬がさらに増え、こうしたゲノム診断に基づく個別化医療・予後改善が一段と進むことが期待されます。特にタスルグラチニブは従来のFGFR阻害剤とは異なる遺伝子診断法としてFISH法を用いていることから、遺伝子パネル検査では見落とされるような染色体構造異常を持った症例にも適応できる可能性があります。
また、がんの基礎研究を出発点に、製薬企業等との活発な共同研究による創薬開発は国立がん研究センター研究所においても活発に進められており、今後こうした成果がさらに生まれてくることが期待されます。
研究助成
本研究は、国立研究開発法人日本医療研究開発機構の革新的がん医療実用化研究事業「国際共同研究に資する大規模日本人がんゲノム・オミックス・臨床データ統合解析とゲノム医療推進に向けた知識基盤構築」により実施されました。
用語解説
注1 融合遺伝子
がん細胞における染色体の転座、挿入、逆位などの組換えの結果、複数の遺伝子が連結されて生じる新たな遺伝子のこと。
注2 アンメットメディカルニーズ
いまだに治療法が見つかっていない疾患に対する医療ニーズのこと。
注3 がんドライバー遺伝子
異常を起こすことによってがんの発生や進展に寄与する遺伝子を総称してがんドライバー遺伝子と呼ぶ。がん細胞の増殖や転移を促進する「がん遺伝子」とそれらを抑制する「がん抑制遺伝子」がある。がんドライバー遺伝子を標的とした診断(パネル遺伝子診断)や治療(分子標的薬治療)が現在ゲノム医療として進められている。
注4 FGFR2遺伝子再構成
FGFR2遺伝子において、染色体の断裂や再結合といった染色体レベルでの大きな構造異常が起きていること。
参考(国立がん研究センターでの研究)
シークエンス解析による線維芽細胞増殖因子受容体2(FGFR2)融合遺伝子の発見
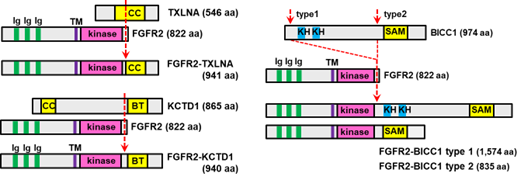
日本人胆道がんを対象とした大規模ゲノムシークエンス解析から新規パートナーを含め5種類のFGFR2融合遺伝子を2015年に同定しました*1(右図)。
これらは全てFGFR2遺伝子のエクソン17から異なる融合遺伝子パートナーにインフレームで融合していました。全ての融合パートナーには二量体あるいは多量体形成に関わる機能ドメインが含まれており、リガンド非依存的にFGFR2が二量体を形成してFGFR2キナーゼ活性が恒常的に活性化していると考えられました。
* 2015年1月29日プレスリリース
胃がん、胆道がんプロジェクト日本で始動
https://www.ncc.go.jp/jp/information/pr_release/2015/0129/index.html
* 2015 年8 月11 日プレスリリース
胆道がんにおける大規模ゲノム解読
https://www.ncc.go.jp/jp/information/pr_release/2015/0811/index.html
さらに国際共同研究によってFGFR2融合遺伝子は、他のアジア諸国の胆道がんにおいても共通して見られることを報告しました*2。
* 2017 年8 月3日プレスリリース 胆道がんで世界横断的・最大の分子統合解析実施 ゲノム・分子異常解明が大きく前進、ゲノム医療促進を期待
https://www.ncc.go.jp/jp/information/pr_release/2017/0803/index.html
FISH法による診断法の開発と多施設共同研究によるスクリーニング
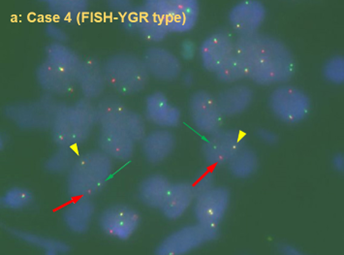
FGFR2融合遺伝子陽性胆道がんの臨床病理学的特徴並びに日本における頻度を明らかにし、コンパニオン診断薬を検証する目的で、多施設共同研究組織(PRELUDE)を立ち上げ、FGFR2融合遺伝子陽性胆道がんの前向きスクリーニング研究を行いました。生検や外科手術のホルマリン固定標本を用いたFISH法を確立し(右図)、同時にターゲットRNAシークエンスによるFGFR2遺伝子再構成の検証も行いました。20施設より445名の進行もしくは再発症例の日本人胆道がん患者さんを登録し、423例においてFISH解析を行いました。FISH解析の成功率は生検検体で97.5% (273/280)、外科手術検体で100% (152/152)であり、23例をFGFR2遺伝子再構成陽性(FISH陽性細胞率15-94%)と判別しました。本研究から新たに肝門部胆管がんの3.6%(3/83)でFGFR2遺伝子再構成が認められました。FGFR2遺伝子再構成は、日本人肝内胆管がんの7.4% (20/272)に見られ、65歳未満やHBV/HCV陽性症例に有意に多いことが明らかとなりました*3。
国内製薬企業によるFGFR選択的低分子阻害剤タスルグラチニブの開発
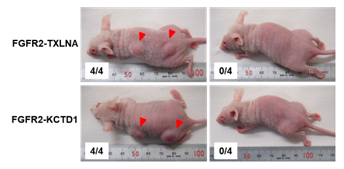
タスルグラチニブ はエーザイ株式会社筑波研究所で創製された経口投与可能なFGFRキナーゼ阻害剤です。FGFR は1~4 の4 種類が知られており、タスルグラチニブ はこのうちFGFR1、2、3 を選択的に阻害します。非臨床薬理試験においてFGFR 遺伝子異常(転座による遺伝子融合・点変異・増幅等)によってFGFR1、2、3 が恒常的に活性化されている種々のヒトがん細胞株に対して優れた抗腫瘍効果を示したことから、特にFGFR 遺伝子異常を有するがん患者さんに対して有効性を示すことが期待されています*4。非臨床研究において、上記胆道がんで同定した5種類のFGFR2融合遺伝子(FGFR2-AHCYL1,FGFR2-BICC1(type1,type2),FGFR2-TXLNA,FGFR2-KCTD1)を安定発現させたNIH3T3細胞を樹立して、FGFRキナーゼ活性に対する低分子阻害剤の効果を調べた結果、タスルグラチニブによってFGFR2並びにMAPKのリン酸化は顕著に抑制され、NIH3T3細胞の足場非依存的増殖が阻害されることを確認されました*5。こうした成果を元に、エーザイ株式会社並びに国立がん研究センターはタスルグラチニブの胆道がん用途に関する特許を共同出願しました(特許第6503450号、US2019/0111043 A1)。
*5 Kawano S. et al., Antitumor Activity of Tasurgratinib as an Orally Available FGFR1-3 Inhibitor in Cholangiocarcinoma Models With FGFR2-fusion, Anticancer Res, 2024
エーザイによる胆道がんを対象としたタスルグラチニブ臨床試験
国内第I相試験 (E7090-J081-101 試験、NCT02275910)は、First in Human試験として2014年10月よりPart1(用量漸増パート)が実施され、タスルグラチニブの推奨用量を1日1回140 mg と設定しました(Koyama T, Cancer Sci, 2020)。Part2(拡張パート)において、FGFR2 融合遺伝子を有する胆管がん患者さん(6例)とFGFR2遺伝子が増幅またはFGFR2タンパクが高発現した胃がん患者さん(10例)を対象に、Part1で決定した推奨用量に従いタスルグラチニブ(1日1回140mg)の投与を行いました。試験の結果、タスルグラチニブ 140 mg の投与の忍容性及び安全性が確認され、胆道がん患者さんの5例(83.3%)で部分奏効(PR)が認められ、残りの1例も病勢安定(SD)でした。胆道がん患者さんでの奏効率は83.3%、疾患コントロール率(DCR)は100%、無増悪生存期間中央値8.26ヵ月(95%信頼区間:3.84-16.66)、全生存期間中央値は未到達(NE)(95%信頼区間:6.37-NE)でした。安全性プロファイルは管理可能で、Part2において投与期間中に多く認められた副作用は、高リン酸塩血症、手掌・足底発赤知覚不全症候(PPE)、爪囲炎で、グレード3以上の治療関連副作用は2人(13%)に認められました。
本結果をもとに、ゲムシタビン併用化学療法後のFGFR2 融合遺伝子を有する切除不能進行又は転移性の胆管がんに対するタスルグラチニブの有効性及び安全性を確認することを目的とした国際共同第II相試験(E7090-J000-201 試験、NCT04238715)が行われ、客観的奏効率(ORR)は30%(90%CI 20.7-41.0; 95%CI 19.2-43.0)、DCRは79%(95%CI 67.3-88.5)、臨床的有効率 (CBR)は51%(95%CI 37.9-63.6)でした。無増悪生存期間中央値/生存期間中央値(mPFS/OS)は5.4ヵ月(95% CI 3.7-5.6)/13.1ヵ月(95% CI 10.8-17.4)でした。
本薬剤開発にあたり、胆道がんにおける治療標的同定並びにその機能解析といった基礎研究並びにFGFR阻害剤を用いた薬効試験の一部については、国立研究開発法人日本医療研究開発機構による支援で行われました。
お問い合わせ先
研究に関する問い合わせ
国立研究開発法人国立がん研究センター 研究所
がんゲノミクス分野 分野長 柴田龍弘
電話番号:03-3542-2511(代表)
Eメール:tshibat●ncc.go.jp
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
電話番号:03-3542-2511(代表)
Eメール:ncc-admin●ncc.go.jp
AMED事業に関する問い合わせ先
日本医療研究開発機構(AMED)
革新的がん医療実用化研究事業
Eメール:kakushingan●amed.go.jp
