トップページ > 研究組織一覧 > 分野・独立ユニットグループ > がん治療学研究分野 > 研究成果の概要 > がん細胞の「バックアップ」を断つ:パラログ相互依存性を利用した普遍的な合成致死戦略
がん細胞の「バックアップ」を断つ:パラログ相互依存性を利用した普遍的な合成致死戦略
1. 概念:生命の冗長性(Redundancy)を逆手に取る
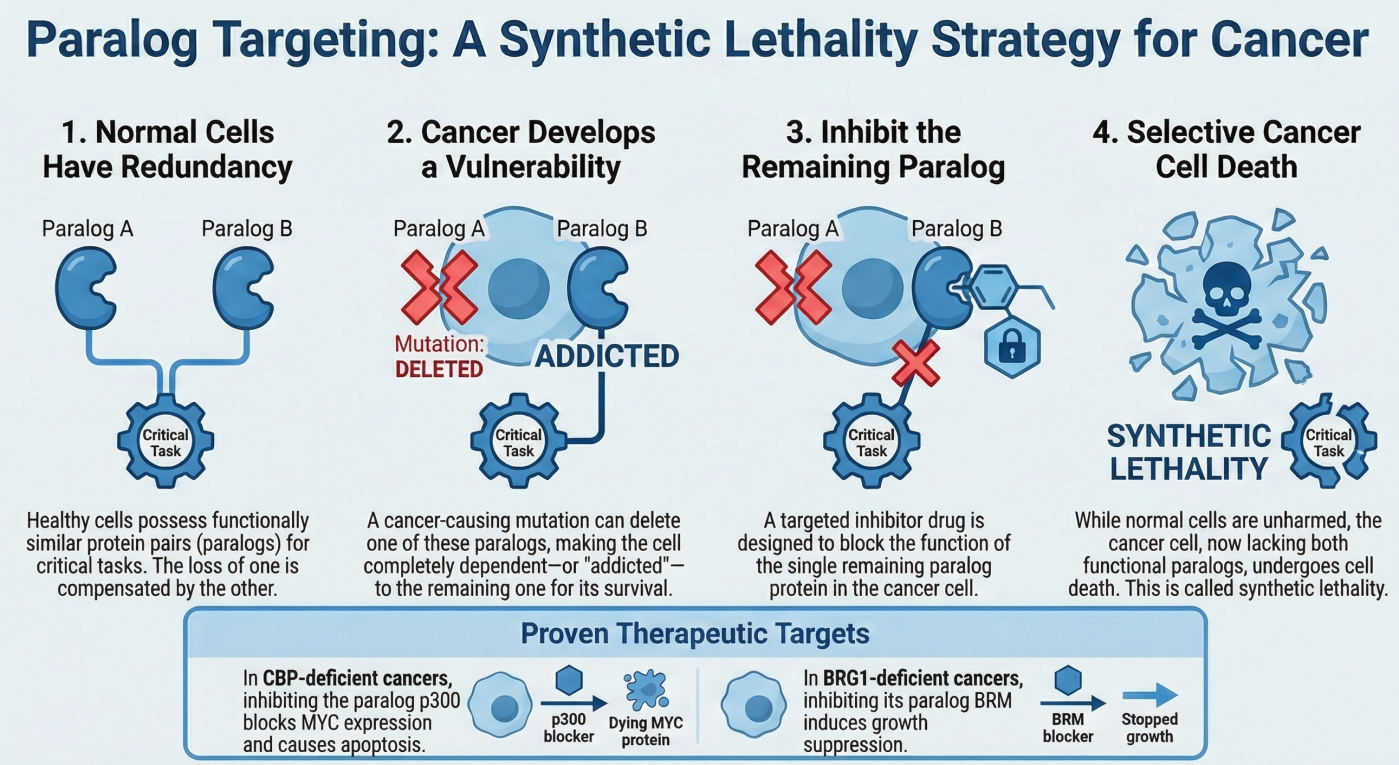
ヒトの細胞には、機能や構造が酷似した「パラログ(類似遺伝子)」が存在し、一方が機能を失っても、もう一方がその役割を補完(バックアップ)することで生存を維持しています。 私たちは、がん細胞において特定の遺伝子が欠損している場合、そのパラログ遺伝子に過度に依存するようになる(Addiction)現象に着目しました。
- 正常細胞: パラログAとBの両方が機能しており、片方を阻害しても生存可能。
- がん細胞: がん抑制遺伝子Aが変異・欠損しているため、生存をパラログBに100%依存している。
- 治療戦略: パラログBを阻害することで、がん細胞のバックアップ機構を完全に破壊し、選択的に死滅させる(合成致死)。
この戦略は、従来の「がん遺伝子(Oncogene)」を標的とする分子標的薬とは異なり、これまで治療標的とすることが難しかった「がん抑制遺伝子の欠損(Loss of function)」を標的とできる画期的なアプローチです。
2. 実証研究1:BRG1欠損肺がんに対する「BRM」標的化
【背景】
非小細胞肺がん(NSCLC)の約10%では、SWI/SNF複合体の触媒サブユニットであるBRG1 (SMARCA4) の欠損が見られます。これらのがんは、EGFR変異やALK融合などの治療標的を持たないことが多く、新しい治療法が切望されています 。
【研究成果】
私たちは、BRG1のパラログであるBRM (SMARCA2) に着目しました。
- 合成致死の証明: BRG1欠損肺がん細胞において、BRMの発現を抑制すると、細胞老化(Senescence)が誘導され、増殖が停止することを明らかにしました 。
- in vivoでの効果: マウス移植モデルにおいて、BRMの発現抑制はBRG1欠損腫瘍の増殖を有意に抑制しました 。
- 正常細胞への影響: BRG1を持つ正常細胞では、BRMを抑制してもBRG1が機能を補完するため、影響は軽微でした。
この成果は、「BRMのATPase活性を阻害する薬剤」が、難治性肺がんの治療薬になる可能性を世界で初めて示したものです (Cancer Research. 2013)。
3. 実証研究2:CBP欠損がんに対する「p300」標的化
【背景】
ヒストンアセチル化酵素であるCBP (CREBBP) は、肺がん、リンパ腫、膀胱がんなど多岐にわたるがんで変異が見られます。CBPには、構造が酷似したパラログであるp300 (EP300) が存在します 。
【研究成果】
私たちは、CBP欠損がん細胞が、生存のためにp300の機能に強く依存(Addiction)していることを発見しました。
- MYCの制御: CBPとp300は、がん遺伝子MYCの転写開始領域のヒストンをアセチル化し、その発現を維持しています。CBP欠損がんでは、この役割をp300が単独で担っています 。
- 合成致死メカニズム: p300を阻害すると、MYCの発現が維持できなくなり、がん細胞はアポトーシス(細胞死)を起こして死滅しました 。
- 薬効評価: p300阻害剤(C646など)は、CBP欠損肺がんおよび血液がん細胞に対して、選択的に高い殺細胞効果を示しました 。
この研究は、エピゲノム制御因子のパラログ阻害が、MYCという「創薬が難しい(Undruggable)」標的を間接的に制御する手段としても有効であることを示しました (Cancer Discovery. 2016)。
4. 結論:ユニバーサルな創薬プラットフォームへ
私たちの研究により、「BRG1-BRM」「CBP-p300」という2つのパラログペアにおける合成致死性が証明されました。 ヒトのクロマチン制御因子の多くはパラログを持っており、がん細胞ではその片方が頻繁に変異しています(ARID1A/ARID1Bなど)。
本研究室では、この「パラログ合成致死」を普遍的な創薬プラットフォームと位置づけ、様々ながん種における新たな脆弱性の探索と、それを標的とした治療薬開発を推進しています。

