再生医療法に基づく再生医療で生じる有害事象の報告状況を調査―報告件数の少なさは何を意味するのか?
2023年11月20日
国立研究開発法人国立がん研究センター
静岡社会健康医学大学院大学
京都大学iPS細胞研究所
京都大学 高等研究院 ヒト生物学高等研究拠点
発表のポイント
- 再生医療法の現在までの施行状況及び同法の改正の方向性を検討するため、同法で義務づけられる有害事象(疾病等)発生の報告状況を調査し、同法の目的である再生医療の安全性確保が果たされているか検討しました。
- その結果、再生医療法に基づく自由診療において、有害事象の発生が適切に報告・検討されていない可能性が示唆されました。
- 本論文が報告した内容を受けて、再生医療法改正の議論に社会的な関心が向けられ、再生医療法の改正や現行制度の運用の見直しがより適切なものになること、また、患者さんの再生医療に対する理解や治療選択の参考になることを願います。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)生命倫理部 部長 一家綱邦と静岡社会健康医学大学院大学 講師 八田太一を中心とする、京都大学との研究チームは、「再生医療等の安全性の確保等に関する法律(以下、再生医療法)」に基づき、再生医療の実施者が義務づけられる有害事象(疾病等)の発生の報告の現状について調査しました。
その結果、再生医療法に基づいて専ら自由診療で行われる再生医療の治療計画においては、およそ10万回の細胞投与に対して報告件数が10回未満であったことが分かりました。それに対して、国が承認した再生医療等製品を使用した治療においては、およそ3~4回の使用に対して1回の報告があることが分かりました。また、過去の報道に基づき、再生医療を受けた患者の有害事象発生についての訴えが、実施者に受け入れられず、その計画を審査した委員会に報告されていないケースがあることも推測されました。以上のことから、「再生医療の安全性を確保すること」を目的とする法律に基づく自由診療において、有害事象の発生が適切に報告・検討されていない可能性が示唆されました。
本研究論文は、学術誌「Stem Cell Reports」に2023年11月16日付(日本時間11月17日1時)で掲載されました。
背景
再生医療法は、わが国の再生医療を国民が迅速かつ安全に受けられるようにするために、2013年に制定されました。再生医療法に基づき、再生医療を「治療(現状の圧倒的多数は自由診療)」または「臨床研究」として実施する場合には、医療機関は厚生労働大臣の認定を受けた委員会に再生医療の提供計画を提出して審査を受けます。
そして、医療に「絶対の安全性」はないからこそ、治療実施者は治療を実施した結果を把握し、検証することが求められます。そのための仕組みとして再生医療法は、有害事象(疾病等)の発生を認定再生医療等委員会に報告して審査を受けることを、再生医療実施者の義務としました*1。
これまでに我々の研究チームは、自由診療で実施される再生医療、それを規制する再生医療法に関する様々な問題・課題・疑義を複数の論文(注)で発表してきました。それらに続く本論文では、「再生医療の安全性を確保することを目的とする法律は、本当に安全性を確保しているのだろうか?」という法律の重要なポイントを検証するために行った調査の結果を示しています。
(注)「複数の論文」については以下参照
- 2022年9月2日 治療として提供される再生医療、安全性・有効性に疑問 ―再生医療法に構造的課題か―(外部サイトにアクセスします)
- 2023年2月28日 自由診療で行われる再生医療の審査に関する課題を調査 今後の制度改正に期待
研究結果
厚生労働省は毎年1回、日本で実施される全ての計画から報告された有害事象(疾病等)の件数を公表しています。また、我々は、認定再生医療等委員会に公開義務のある委員会議事録(2019年度、2020年度分)を全て調べて、委員会で審議された疾病等報告の件数を数えました。それらの件数を、厚生労働省が毎年1回公開する「定期報告のとりまとめの概要」で公表されている「(細胞の)投与件数」と対比させました(表1参照)。
表1. 再生医療法に基づく再生医療の投与件数と有害事象の発生報告数

a. 厚生労働省の公開する情報に基づく。
b. 各委員会の議事録を確認して集計した。
c. 委員会議事録からは、研究又は治療のいずれの計画における有害事象の発生なのか不明な報告が1件あった。
その結果、治療計画における投与件数が研究計画における投与件数よりも桁違いに多いのにもかかわらず、有害事象(疾病等)の報告件数は治療計画の方が少ないことが明らかになりました。治療計画において、2019年度、2020年度ともに、およそ10万回の細胞投与に対して報告件数が10回未満に留まることの意味を検討するために、わが国のもう1つの「再生医療の治療」と言える再生医療等製品の使用回数(投与件数)と有害事象の報告件数を調査しました。
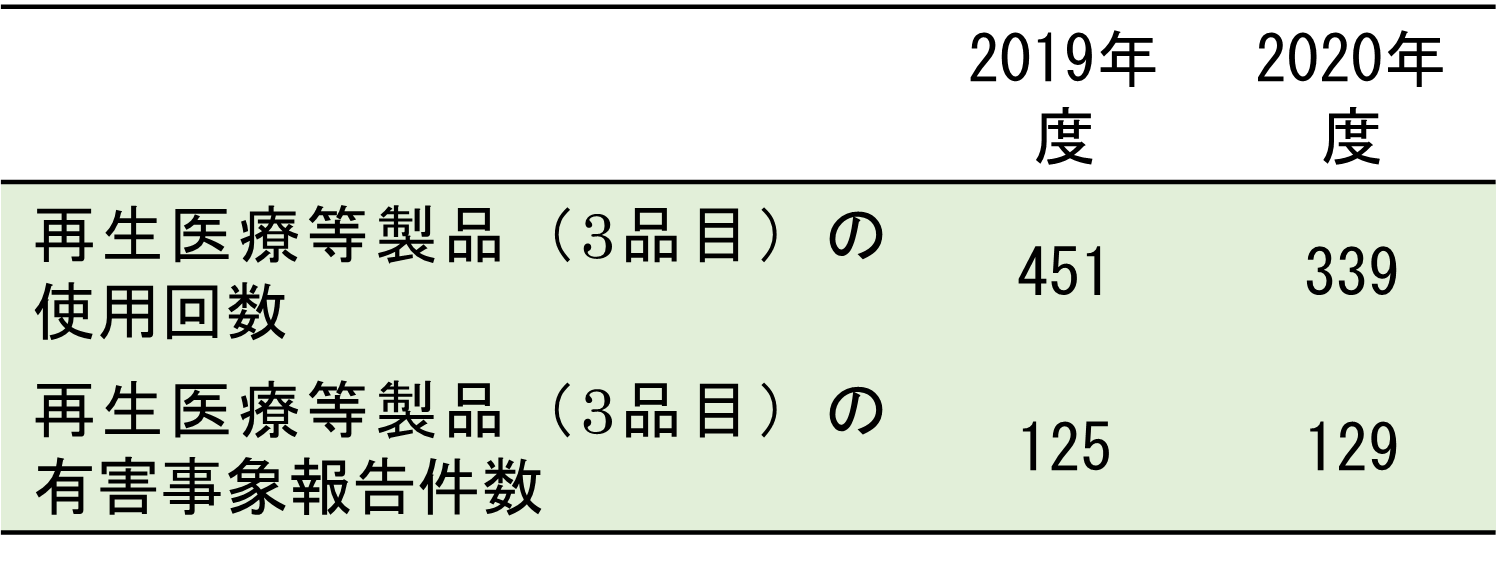
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(薬機法)に基づいて、国が品質、安全性と有効性を認めたものに限って「再生医療等製品」としての製造・販売を承認します。再生医療等製品の使用回数については、NDBオープンデータを使って推計しました。ただし、我々の調査対象とした製品は、最も正確な使用回数が推計できるジェイス、ジャック、テムセルHS注の3つに限定されました。
薬機法は、再生医療等製品の副作用・不具合等によるものと疑われる有害事象の発生について、当該製品の販売業者に厚生労働省に報告する義務を課します*2。医薬品医療機器総合機構(PMDA)は、薬機法が施行された2014年11月25日以降、全ての再生医療等製品の使用に基づく「不具合等が疑われる症例報告」を公表しています。我々は、その中から上記3製品について「患者等の健康被害状況」に記載がある症例報告を抽出しました。3製品の使用回数と有害事象の報告件数は表2の通りです。つまり、再生医療等製品の使用においては、およそ3~4回の投与に対して1回の報告があることが分かりました。また、重篤なものから軽微なものまで様々な有害事象の発生が報告されていました。
表2.薬機法に基づく再生医療等製品の使用回数と有害事象の報告数
わが国では2つの法制度に分かれて行われる「再生医療の治療」において、有害事象の報告頻度が大きく異なることは*3、再生医療法に基づく治療は必ずしも第三者性が担保されていない認定再生医療等委員会で審査されただけで実施されているのに対して、再生医療等製品は臨床試験の結果を国が慎重に検討して承認したものであることを踏まえると、重大な結果であると考えられます。
この結果からは、再生医療法に基づいて実施されている治療計画では、有害事象(疾病等)の報告制度が適切に機能しているのか、疑義が生じます。この疑義を裏付けるようなケース、すなわち、再生医療を受けた患者の有害事象発生についての訴えが、実施者に受け入れられず、その計画を審査した委員会に報告されていないケースがあることも、過去のメディア報道と我々の調査から推測されました。
さらに、2つの法制度における有害事象報告の頻度の違いは、両法制度に携わる関係者の「医療における安全性の確保」に対する意識の違いの表れであるとも考えられます。有害事象の報告制度が適切に機能していないとしたら、「安全性を確保する」という再生医療法の目的が達成されているか否かを検証することはできないとも考えられます。
奇しくも、最近、国際細胞・遺伝子治療学会(International Society for Cell & Gene Therapy)によって、各国が有害事象の報告制度を見直し、その報告データを活用すること、そのような取組みの前提として患者からの報告制度を設けることが提案されました。再生医療法の改正においては、こうした提案を真摯に検討することが望ましいと考えます。
展望
本論文が報告した内容を受けて、現在進められている再生医療法の改正の議論に社会的な関心が向けられ、結果的に再生医療法の改正や現行制度の運用の見直しがより適切なものになること、また、患者さんの再生医療に対する理解や治療選択の参考になることを願います。
本論文の著者は、日本学術振興会科学研究費助成事業・基盤研究B「科学的エビデンスの不明な医療への社会的対応についての学際的研究班」のメンバーでもあります。再生医療以外にも、がん治療や難治性疾患等の分野で行われる「科学的エビデンスの不明な医療」に関する調査・研究を進めてまいります。
補足説明・補注
*1.再生医療法第17条及び18条、同法施行規則第35条及び36条に基づくと、報告対象は再生医療等の提供に起因するものと疑われる疾病や障害等であり、具体的には、(1)死亡、(2)死亡につながるおそれのある症例、(3)治療のために医療機関への入院又は入院期間の延長が必要とされる症例、(4)障害、(5)障害につながるおそれのある症例、(6)重篤である症例、(7)後世代における先天性の疾病又は異常である。さらに、(1)~(7)以外の疾病や感染症の発生があった場合には、認定再生医療等委員会にのみ報告される。
*2.薬機法第68条の10第1項、同法施行規則第228条の20第4項に基づくと、報告対象となる有害事象は、基本的には次の6種類と考えられる。(1)死亡、(2)障害、(3)死亡又は障害につながるおそれのある症例、(4)治療のために病院又は診療所への入院又は入院期間の延長が必要とされる症例、(5)死亡又は上掲の症例に準じて重篤である症例、(6)後世代における先天性の疾病又は異常である。さらに、再生医療等製品の不具合によって(1)~(6)が発生する恐れがあるものも報告対象となる。
*3.上記*1と*2のとおり、両法制度下の報告対象に大きな差異はないと考えられる。
発表論文
雑誌名
Stem Cell Reports
タイトル
Does the Act on the Safety of Regenerative Medicine in Japan ensure "Safety"? : Implications of low adverse event reporting
著者
Tsunakuni Ikka*; Taichi Hatta*; Yoko Saito ; Misao Fujita (*がCorresponding Author)
掲載日
2023年11月16日付(日本時間11月17日午前1時)オンライン・プレ・リリース
DOI
10.1016/j.stemcr.2023.10.012
URL
https://www.cell.com/stem-cell-reports/fulltext/S2213-6711(23)00414-9(外部サイトにリンクします)
研究費
- 日本学術振興会科学研究費助成事業・基盤研究B「科学的エビデンスの不明な医療への社会的対応についての学際的研究」
- 日本学術振興会科学研究費助成事業・若手研究B「医学研究に対する法的・倫理的規制を考える研究」
- 日本学術振興会科学研究費助成事業・基盤研究C「ヒト細胞を用いた治療及び基礎研究の規制策定議論に資する実態調査」
問い合わせ先
研究に関する問い合わせ
国立がん研究センター
研究支援センター 生命倫理部
一家 綱邦
電話番号:03-3542-2511(代表)
Eメール:medical-evidence●ml.res.ncc.go.jp
静岡社会健康医学大学院大学
講師
八田 太一
電話番号:054-295-5401 (教務課)
京都大学iPS細胞研究所(CiRA) 上廣倫理研究部門
京都大学高等研究院 ヒト生物学高等研究拠点
藤田 みさお
電話番号:075-366-7005(CiRA国際広報室)
広報窓口
国立がん研究センター
企画戦略局 広報企画室
電話番号:03-3542-2511(代表) FAX:03-3542-2545
Eメール:ncc-admin●ncc.go.jp
静岡社会健康医学大学院大学
教務課
電話番号:054-295-5401 FAX:054-248-3520
Eメール:info●s-sph.ac.jp
京都大学iPS細胞研究所
国際広報室
電話番号:075-366-7005
Eメール:media●cira.kyoto-u.ac.jp
京都大学 高等研究院 ヒト生物学高等研究拠点
リサーチアクセラレーションユニット
電話番号:075-753-9805
Eメール:ashbi-pr●mail2.adm.kyoto-u.ac.jp
