肺腺がんの進展に伴い変化するがん微小環境とは?―空間オミクス解析技術によるがん組織局所の分子イベントの解明―
筑波大学
国立研究開発法人国立がん研究センター
発表のポイント
- 空間オミクス解析技術により、肺腺がん患者のがん細胞の特徴が大きく変化する際、周囲に存在する免疫細胞の特徴も変化していることが明らかになりました。
- 肺腺がんが周囲の環境との相互作用を通じて進行していく様子が明らかになりました。
- がん細胞と免疫細胞の相互作用をより正確に理解することで、さまざまなステージにおけるがん治療につながると期待されます。
概要
東京大学大学院新領域創成科学研究科の鈴木絢子准教授および鈴木穣教授らのグループは、筑波大学および国立がん研究センターとの共同研究において、空間オミクス解析(注1)技術を駆使して、肺腺がんが周囲の環境とのやり取りを通じて進行していく様子を評価しました。
がん細胞とその周囲の環境との相互作用は、がんの進行において重要な要素だと考えられています。しかしながら、がん細胞と周囲の環境との相互作用など、がんの進行中に変化を引き起こす事象について、分かっていない部分は多くあります。
今回、研究グループは肺腺がんが進行する際の周囲の環境との相互作用を詳細に解析しました。複数の空間オミクス技術を組み合わせることで、肺腺がんが進行する際の周囲の環境との相互作用を評価しました。その結果、がん細胞が特徴を変える際に、周りの免疫細胞との関係性にも変化が生じることがわかりました。この研究により、肺腺がんが周囲の環境とのやり取りを通じて進行していく様子が明らかになりました。
今後、がん細胞と免疫細胞の相互作用をより正確に理解することで、さまざまなステージにおけるがん治療につながると期待されます。
本成果は、「Nature Communications」に2024年12月6日に掲載されました。
発表内容
がん細胞は、腫瘍浸潤性リンパ球やがん関連線維芽細胞などのさまざまな細胞によって構成されるがん微小環境(注2)においてストレスにさらされ続けています。がん細胞はがん微小環境で生き延びるために遺伝子発現プログラムを変化させ適応を行います。がん細胞とその周囲の環境の相互作用ががんの進展に大きく関係していると考えられていますが、がんの進展に伴う、分子イベント(注3)、特にがん細胞と周囲の細胞の相互作用に関して、明らかになっていない部分が多くあります。
近年、空間オミクス解析技術の発展に伴い、組織切片上のRNAやタンパク質発現を解析することが可能となりました。本研究では、30症例の肺腺がん(22症例の早期非浸潤がん(注4)と8症例の進行浸潤がん)について最新の空間オミクス技術を用いた解析を行い、がん細胞や周囲の間質細胞、腫瘍浸潤免疫細胞の遺伝子発現パターンについてその特徴を解析しました。
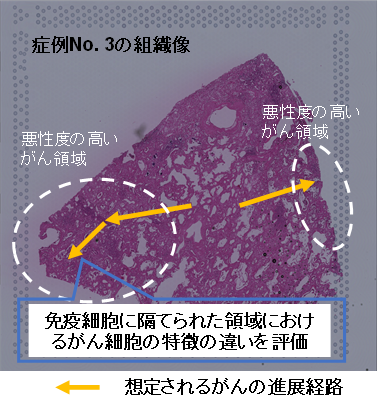
まず、空間オミクス解析技術のひとつである空間的遺伝子発現解析Visium(注5)を用いて、浸潤がん組織切片の上の数千カ所に対して、網羅的な遺伝子発現解析を行いました。EGFR変異(注6)陽性症例を代表例として、免疫細胞に隔てられて存在するがん領域の違いを詳しく解析しました(図1)。
Visiumを使用して網羅的な空間的遺伝子発現解析を行いました。図には、浸潤がんの代表例として症例No. 3の組織像を示しています。解析の結果、点線で囲まれた領域において増殖・浸潤関連遺伝子の発現が見られたため、矢印の方向にがんが進展していると推定されました。特に左側では、免疫細胞が豊富な領域に隔てられるように存在し、相互に異なるがん微小環境を有する領域が見出されました(詳細は図2)。
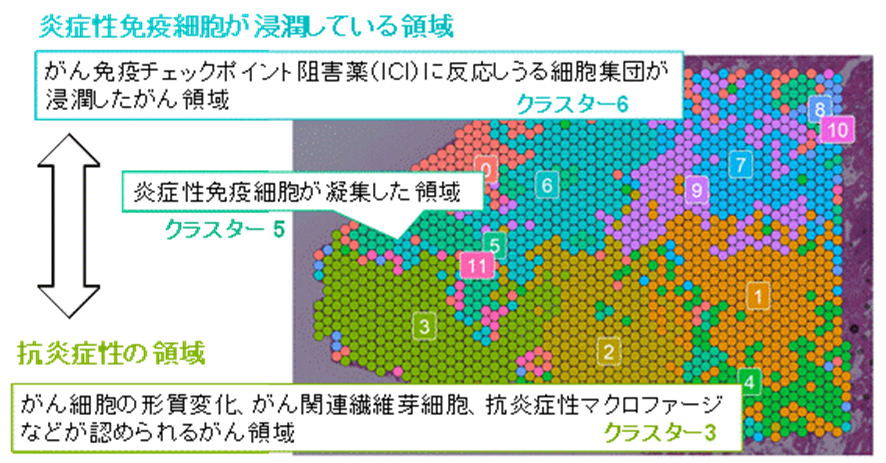
その結果、がん細胞や周囲のがん微小環境状態は領域ごとに多様な特徴を有していることが認められました。特に、増殖や浸潤に関わる遺伝子が高発現しているより悪性度の高い領域では、炎症性免疫細胞の浸潤が限定的であることから、がん免疫療法に対する有効性もこの領域では限定的であると考えられました(図2)。なお、こうした傾向は、複数の症例で同様に確認されました。このように、がん組織におけるがん微小環境の状態は多様であり、局所の領域の分子イベントを計測することは重要であることが示されたと考えています。
図1に示した左側の領域を詳細に解析しました。クラスタリング解析の結果、免疫細胞が豊富な領域(クラスター5)に隔てられるように存在する、2つの領域(クラスター6とクラスター3)が見出されました。クラスター6は免疫細胞が浸潤しており、免疫を標的とした治療に効果を示しうる領域でしたが、クラスター3は抗炎症性・免疫抑制性のがん微小環境を形成しており、免疫療法の有効性が低い可能性が示唆されます。
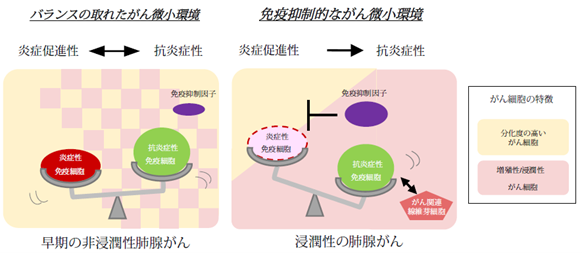
続いて、より空間解像度の高い、単一細胞レベルでの空間的遺伝子発現解析Xenium(注7)を行い、悪性度の高い腫瘍領域におけるがん細胞と免疫細胞の関係性を、より詳細に評価しました。別の浸潤がん症例を解析した結果を図3に示しています。分化度の高いがん細胞領域とより悪性度の高い粘液成分を持つがん細胞領域の境界には、炎症性免疫細胞が存在していることが確認されました。しかし、悪性度の高いがん細胞は周囲の細胞と連動しながら、免疫抑制物質を産生することで、炎症性免疫細胞の攻撃から自身を守る局所環境を作り出していることが推察されました。(図3右)。浸潤がんでは、より悪性度の高い領域において免疫抑制的ながん微小環境が形成され、炎症性免疫細胞の浸潤・機能が抑制されていました。空間オミクス技術は、こうしたがん進展メカニズムの理解・制御にとって重要な領域の抽出に役立つことが明らかとなりました。
Xeniumを使用して1細胞レベルでの空間的遺伝子発現解析を行いました。図には、症例No.2の解析結果を示しています。(左図)組織切片に含まれる472,420個の細胞を、遺伝子発現情報によってクラスタリング解析した結果。(右図)高分化ながん領域と増殖シグナルの強い粘液性のがん領域の境界部分(左図の黄色枠)にフォーカスした結果。がんを攻撃しうるT細胞は存在しますが、境界領域にとどまり、粘液性のがん領域の内部にまで十分に浸潤できていないことが示唆されました。IDO1やCCL22などの免疫抑制因子の存在によって、粘液性のがん領域では免疫抑制性のがん微小環境が形成されていることが示唆されました。
さらに、より早期の肺腺がん症例と比較することで、肺腺がんの進展とがん微小環境の関係性を明らかにすることを試みました。上皮内腺がんや微小浸潤がんといった予後良好である早期の非浸潤性肺腺がん症例22例に対して空間的遺伝子解析を行い、浸潤がん8例のデータと比較しました。特に、増殖や浸潤関連マーカー遺伝子の発現が高く悪性度の高い領域に着目したところ、早期がんでは進行浸潤がんとは異なり、炎症性免疫細胞がまだ多く浸潤していることがわかりました。
本研究により、肺腺がんが周囲の環境とのやり取りを通じて進行していく様子が明らかになりました。本研究を通して、炎症性免疫細胞ががん進展の初期段階では有効なバリアとして働くものの、悪性度の高いがん細胞は自身の特徴を変化させることにより、免疫細胞からの生存方法を見出していることが示唆されました。今後、がん細胞と免疫細胞の相互作用をより正確に理解することで、さまざまなステージにおけるがん治療につながると期待されます。
発表者・研究者等情報
東京大学大学院新領域創成科学研究科
高野 佑真 博士後期課程
兼:中外製薬株式会社 研究員
鈴木 絢子 准教授
鈴木 穣 教授
筑波大学
野口 雅之 名誉教授
兼:湘南鎌倉総合病院 病理部長
国立がん研究センター
研究所ゲノム生物学研究分野
河野 隆志 分野長
先端医療開発センター トランスレーショナルインフォマティクス分野
土原 一哉 分野長
先端医療開発センター 病理・臨床検査トランスレーショナルリサーチ分野
石井 源一郎 分野長
東病院 呼吸器外科
坪井 正博 科長
など、計22名
論文情報
雑誌名: Nature Communications
題 名: Spatially resolved gene expression profiling of tumor microenvironment reveals key steps of lung adenocarcinoma development
著者名: Yuma Takano, Jun Suzuki, Kotaro Nomura, Gento Fujii, Junko Zenkoh, Hitomi Kawai, Yuta Kuze, Yukie Kashima, Satoi Nagasawa, Yuka Nakamura, Motohiro Kojima, Katsuya Tsuchihara, Masahide Seki, Akinori Kanai, Daisuke Matsubara, Takashi Kohno, Masayuki Noguchi, Akihiro Nakaya, Masahiro Tsuboi, Genichiro Ishii, Yutaka Suzuki*, Ayako Suzuki* (*責任著者)
DOI: 10.1038/s41467-024-54671-7
URL: https://doi.org/10.1038/s41467-024-54671-7(外部サイトにリンクします)
研究助成
本研究開発は、日本学術振興会(JSPS)科学研究費助成事業 学術変革領域研究(学術研究支援基盤形成)「先進ゲノム解析研究推進プラットフォーム」(課題番号:22H04925(PAGS))、および、日本医療研究開発機構(AMED)次世代がん医療加速化研究事業「ロングリード技術による肺がんゲノム・エピゲノム不均一性と微小環境ストレスの関係性解明に関する研究開発」(課題番号:23ama221522)の支援によって実施されました。
用語解説
(注1) 空間オミクス解析
組織切片の上で、遺伝子発現解析などの網羅的な分子の状態を解析する新しい手法。細胞の形や位置情報と、遺伝子発現情報を統合して解析することができます。本研究では、組織切片上で遺伝子発現解析を実施できるVisiumおよびXeniumを使用して解析をしています。
(注2) がん微小環境
がん細胞と周囲の免疫細胞や線維芽細胞などにより、構成される組織局所の環境。この環境は、がん細胞の増殖・浸潤をサポートしたり、逆にがん細胞の進展を抑えたりする二面性を持っています。がん微小環境は、がんの悪性化や治療抵抗性に対して重要な役割を担っているといわれています。
(注3) 分子イベント
ここでは、がんの進行過程で起こる細胞内外の分子レベルの変化や相互作用のことを指しています。遺伝子発現の変化、細胞内シグナリングや細胞間の相互作用などが含まれます。
(注4) 浸潤がん
がん細胞が周囲の正常な組織に広がるがん。
(注5) Visium
直径55マイクロメートル(およそ5~10個の細胞が含まれる範囲)の測定スポットが数千カ所設定されており、それぞれのスポットで空間情報を保持したまま網羅的な遺伝子発現を解析することができます。
(注6) EGFR変異
EGFRという遺伝子に入った変異。日本人肺腺がん患者の約半数で見られ、直接的にがんの発生や進展に関与するドライバー遺伝子として知られています。
(注7) Xenium
1細胞レベルで遺伝子発現状態を評価することができる先進的な解析技術。組織の切片上に存在する個々の細胞において、数百の遺伝子の発現を同時に解析することができます。
問合せ先
研究に関する問合せ
東京大学大学院新領域創成科学研究科 メディカル情報生命専攻
准教授 鈴木 絢子(すずき あやこ)
Tel:04-7136-4076 E-mail:asuzuki●edu.k.u-tokyo.ac.jp
報道に関する問合せ
東京大学大学院新領域創成科学研究科 広報室
Tel:04-7136-5450 E-mail:press●k.u-tokyo.ac.jp
筑波大学 広報局
Tel:029-853-2040 E-mail:kohositu●un.tsukuba.ac.jp
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室(柏キャンパス)
Tel:04-7133-1111(代表) E-mail:ncc-admin●ncc.go.jp