血液を用いたがんゲノム解析(Liquid biopsy)の新手法を開発血液から膵臓がんで治療標的となり得る遺伝子異常を検出
2015年12月16日
国立研究開発法人国立がん研究センター
本研究成果のポイント
- 新たな次世代シーケンス技術の基盤を構築
血液を用いたがんゲノム解析(Liquid biopsy)について、高精度かつ網羅的にゲノム異常を検出できる新たな手法を開発 - 膵臓がんにおいて遺伝子異常に基づいた個別化治療の実現を示唆
同手法を用い進行膵臓がん患者さんの血液からゲノム解析を行った結果、約30%に治療標的となり得る遺伝子異常を検出
国立研究開発法人国立がん研究センター(理事長:堀田知光、東京都中央区、略称:国がん)は、これまで生検や手術で採取した組織等を用いて行っていた網羅的なゲノム異常の解析を、血液でも高精度に行える新たな手法を開発し、さらに血液からも進行膵臓がんの約30%に治療標的となり得る遺伝子異常を検出しました。
本研究で用いた解析方法は、膵臓がんに限らずあらゆる固形がんで可能であり、また、生検が困難な患者さんや、薬剤耐性獲得変異など経時的な複数回の検査が必要な場合にも有用と考えられ、通常の組織生検よりも患者負担が少ない網羅的ゲノム解析手法として臨床応用が期待されます。また、これまで分子標的薬の開発が進んでいない膵臓がんにおいても、がんの遺伝子異常に基づいた個別化治療が有効である可能性が示唆され、今後さらに検出感度を向上させることで、治療標的の探索だけでなく、難治がんの早期診断への応用も期待されます。
本研究成果は、同研究所(所長:中釜斉)がんゲノミクス研究分野 柴田龍弘分野長と谷内田真一ユニット長の研究グループが、国立がん研究センター研究開発費「高速シーケンス解析技術を応用した血中・体液中の遊離核酸によるがんの高感度分子診断法の基盤確立」や公益財団法人武田科学振興財団などの支援を受けて行ったもので、英科学誌ネイチャー(Nature)系オンライン科学誌「サイエンティフィック・リポーツ(Scientific Reports)」に12月16日付けで掲載されました。
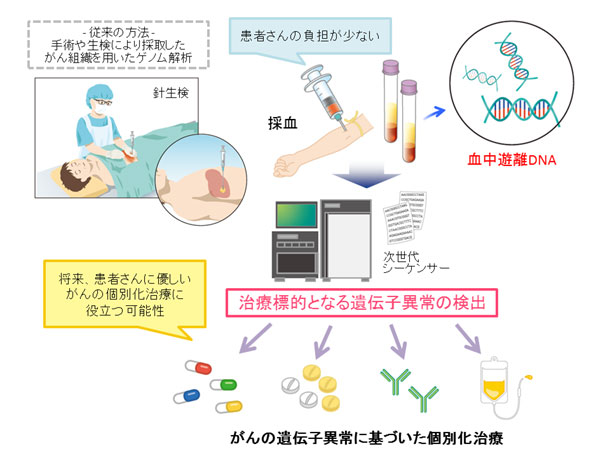
がんにおける治療標的遺伝子異常の探索(Clinical sequenciナノグラム)の現状
現在、がんにおける治療標的遺伝子異常の探索には、主に外科的に切除した手術材料や内視鏡的もしくは超音波下に採取した組織が用いられていますが、がんの占居部位や病状悪化等で生検が困難な場合があります。また、治療中、がん細胞に新たな遺伝子変異が生じ、薬剤に対する耐性を獲得することが知られており、複数回の生検検査が必要となることもあります。
がん組織に直接、針を刺し組織を採取する組織生検は、患者さんの負担が大きく、また、出血などの合併症の危険性も伴います。そのため、患者さんの負担が少なく、複数回の検査も可能な血液や体液(尿など)を用いた網羅的ながんゲノム解析は、新しいがん分子診断法として期待されていました。しかし、血液検体から得られる遊離DNA(cell-free DNA、以下cfDNA)は少量で、さらにそのうちがん由来のcfDNAは極めて微量であるため、網羅的なゲノム解析を高精度に行うことはこれまでほとんど実現していませんでした。
膵臓がんの現状
膵臓がんは、罹患数と死亡数ともに約3万例とほぼ等しく、5年相対生存率が7%(全国がん罹患モニタリング集計 2003年から2005年生存率報告)と極めて低い難治がんです。これは、初期症状が少なく早期発見が困難であることや、有効とされる抗がん剤が少ないことが原因として挙げられます。肺がんなどで行なわれているがんのゲノム異常に基づいた分子標的薬による治療もほとんど行われていませんが、一部の患者さんでは治療標的となり得る様々な遺伝子異常が認められることも明らかになってきていました。
本研究概要
本研究は、新たに開発した前処理法を次世代シークエンサー(注1)1による解析前に用いることにより、少量(10ナノグラム)のcfDNAからも、イルミナ社の高精度な次世代シークエンサーを用いて網羅的なゲノム解析を行うことが可能であることを報告したものとなります。
本研究では、組織生検等により膵臓がんと診断された患者さんの血液を用い、膵臓がんに高頻度に異常がみられる遺伝子と、治療標的となり得る遺伝子を含めた膵臓がんのゲノム異常を、低侵襲な検査法である血液(約5ミリリットル)から検出する方法について検討を行いました。
高精度かつ網羅的にゲノム異常を検出できる新たな手法を開発
現在世界的に広く使用されている、アジレント社のターゲット濃縮キットと高精度なイルミナ社の次世代シークエンサーを用いたターゲットシークエンス解析の手法では、最低200ナノグラムのDNAが必要とされています。しかし血漿中に含まれるcfDNAは少量であり、また高度に断片化されていることから、この手法を用いて高精度な解析を行なうことは極めて困難でした。
本研究では、既存のキットを組み合わせた新たな前処理法を開発し、シークエンスデータの情報解析についても工夫を行なうことで、これまでの1/20である10ナノグラム程度のcfDNAからもイルミナ社の次世代シークエンサーによるターゲットシークエンス解析を行なうことのできる独自の手法を開発しました。
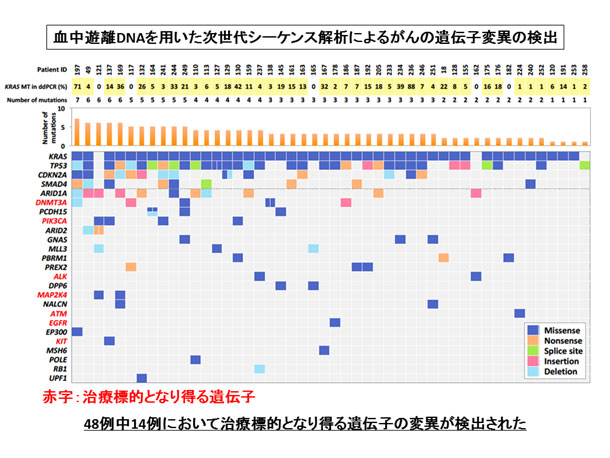
48例中14例(約30%)において治療標的となり得る遺伝子の変異を検出
膵臓がんでは、これまでに手術検体を用いた大規模ながんゲノム解析研究によりKRAS、CDKN2A、TP53、SMAD4/DPC4の4つの遺伝子異常が高頻度に認められることが明らかとなっています。KRAS遺伝子の突然変異は発がん過程の最初に生じるゲノム異常であり、膵臓がん患者さんの95%以上がKRAS変異を有していることが知られています。デジタルPCR(注2)でKRAS変異が検出された症例では血液中にがん由来のcfDNAが存在すると考えられることから、そのような症例を中心とした48例を対象に、膵臓がんに高頻度に変異が見られる遺伝子と、治療標的となり得る遺伝子の計60遺伝子について、イルミナ社の次世代シークエンサーを用いてターゲットシークエンス解析を行いました。
本研究で用いた方法では、10ナノグラム以下のごく少量のcfDNAからも高精度な網羅的なシークエンス解析が可能であり、全ての症例で1つ以上のがんの体細胞変異(注3)が検出され、さらに治療標的となり得るPIK3CA、EGFR、ATM遺伝子などの変異も14例(約30%)の症例で認められました。
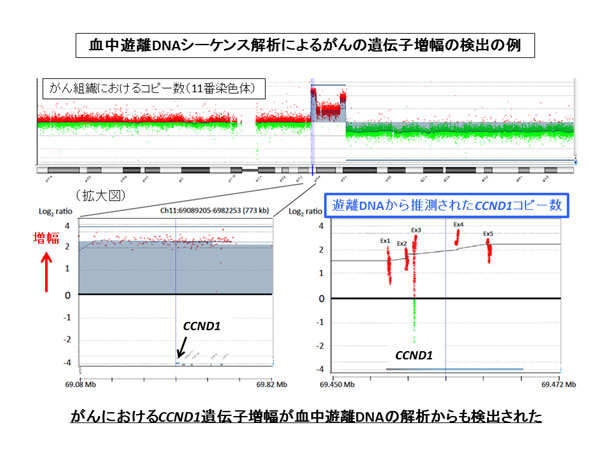
がんにおけるCCND1遺伝子などの増幅が血中遊離DNAの解析からも検出
また、シークエンス解析データから遺伝子増幅の推測を行う独自のアルゴリズムを開発しました。がんにおいては、分子治療標的となるがん遺伝子の増幅が広く知られています。本研究において進行膵臓がん患者さんでも、他のがんで遺伝子増幅が知られ治療標的となり得るERBB2(HER2)やCCND1遺伝子の増幅が検出されました。
以下の図は、血中のcfDNAから検出したCCND1の増幅(右下)が、同様に手術検体からも検出されていることを示しています(左下)(赤色は増幅を意味しています)。
本研究に使用した血液検体について
国立がん研究センターでは、中央病院(東京都中央区)・東病院(千葉県柏市)を受診された患者さんを対象に、検査に使用した血液や組織、手術などで摘出された組織の診療後の残りと、それらに付随する診療情報、診療後の経過情報の提供・研究への利用をお願いしています。ご提供いただいたこれらの試料と情報は、バイオバンクに整理、保管し、がん等の医学研究に使わせていただいております。
本研究においても、膵臓がん患者さんの血液検体を使用させていただきました。今後、この解析結果をもとに、新たな膵臓がん治療・診断法の開発に取り組んでまいります。この場をお借りし、バイオバンクにご賛同・ご協力くださった患者さまとご家族に深く御礼を申し上げます。
発表論文
- 雑誌名:Scientific Reports
- タイトル:Clinical utility of circulating tumor DNA for molecular assessment in pancreatic cancer
- 著者:Erina Takai,Yasushi Totoki,Hiromi Nakamura,Chigusa Morizane,Satoshi Nara,Natsuko Hama,Masami Suzuki,Eisaku Furukawa,Mamoru Kato,Hideyuki Hayashi,Takashi Kohno,Hideki Ueno,Kazuaki Shimada, Takuji Okusaka,Hitoshi Nakagama,Tatsuhiro Shibata(注),Shinichi Yachida(注)(注:責任著者)
- Doi:10.1038/srep18425
- Clinical utility of circulating tumor DNA for molecular assessment in pancreatic cancer(外部サイトにリンクします)
用語解説
- 注1 次世代シークエンサー:
米国NIHが主導した1000ドルゲノムプロジェクトによって開発された新しいシークエンス技術の総称であり、独自の技術によって大量シークエンスを可能にした技術が複数実用化されている。従来のサンガーシークエンス法と比べて、超大量のDNAシーケンス反応を並列して行う技術である。 - 注2 デジタルPCR:
サンプルとなるDNAを1分子ずつの区画に分けてPCR増幅を行なうことで、目的の配列の絶対量を定量することができる技術。各区画における目的の配列の有無を検出することから、「デジタル」PCRと呼ばれる。リアルタイムPCRなど従来の技術では検出することのできないような、サンプル中に極めて低頻度に存在する配列も高感度に検出することが可能である。 - 注3 がんの体細胞変異:
生まれつきの変異(塩基配列の異常)、つまり生殖細胞変異とは異なり、後天的にがん細胞でのみ出現する遺伝子変異である。体細胞変異を蓄積することでがんは進化を遂げ、悪性度を増す。
プレスリリース:
- 血液から膵臓がんで治療標的となり得る遺伝子異常を検出
関連ファイルをご覧ください。
報道関係のお問い合わせ先
- 国立研究開発法人 国立がん研究センター
郵便番号:104-0045 東京都中央区築地5-1-1
研究所 がんゲノミクス研究分野 ユニット長 谷内田 真一(やちだ しんいち)
電話番号:03-3542-2511(代表)
Eメール:syachidan●ncc.go.jp(●を@に置き換えください) - 企画戦略局 広報企画室
電話番号:03-3542-2511(代表)
ファクス番号:03-3542-2545
Eメール:ncc-admin●ncc.go.jp(●を@に置き換えください)
