次世代のがん治療薬 ADCの精巧な設計を可能に抗体薬物複合体(ADC)のがん組織中の薬物放出・分布を可視化した画期的な方法を確立
2016年5月9日
国立研究開発法人国立がん研究センター
国立研究開発法人理化学研究所
株式会社島津製作所
本研究成果のポイント
- 抗体薬物複合体(Antibody-drug conjugate: ADC)(注1)は、抗体に抗がん剤などの薬を付加したもの。抗体が特定の分子をもつがん細胞に結合する性質を利用して、薬を直接がん細胞まで運び、そこで薬を放出することで、抗腫瘍効果を発揮する。
- 質量顕微鏡を用いて、がん組織中における、ADCからの薬物の放出を直接みることに成功。
- 付加薬物を放射性同位元素で標識(ラベル)することなく、かつがん組織内での薬の放出と分布を観察できる方法の確立は、ADCの薬剤デザインを行う上で、画期的といえる。
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区、略称:国がん)は、質量顕微鏡を用いて、抗体薬物複合体(ADC)のがん組織中の薬物放出・分布を可視化した、世界初の評価方法を確立しました。ADCは、免疫チェックポイント阻害剤に並ぶ次世代のがん治療薬として、米国を中心に精力的な研究開発が行われており、今後のがん薬物治療の主流になると期待されています。
本研究成果は、同先端医療開発センター(センター長:落合淳志)新薬開発分野(分野長:松村保広)と国立研究開発法人理化学研究所、株式会社島津製作所の研究グループが共同で行ったもので、英科学誌ネイチャー(Nature)系オンライン科学誌「サイエンティフィック・リポーツ(Scientific Reports)」に4月21日付けで掲載されました。
背景
ADCは、抗体によってがん細胞に標的を絞り、抗体に付加した薬物をがん細胞内に直接届けることで、がん細胞を攻撃し、かつ正常な細胞への影響を避けるという目的で設計された、新しいタイプのがん治療薬です(図1)。海外、特に米国ではすでに50種類以上のADCの臨床開発が進められており、将来、多くのADCが日本にも導入されることが予想されます。
さらに、トラスツズマブで効果が得られなくなったHER2陽性進行・再発乳がんに対し、トラスツズマブに抗がん剤を付加したADC(T-DM1、トラスツズマブ エムタンシン。日本では2013年に承認)の有効性が明らかになったことから、抗体薬の耐性の問題を克服する新たな治療手段としても、大きな期待が寄せられています。
しかしその一方で、ADCが抗腫瘍効果を発揮するための必須条件である、「ADCががん細胞に到達する」「がん細胞中で薬を放出する」という2点を正確に評価する方法がなく、ADCの創薬デザインにおいては至適な設計がなされていなかった可能性があります。
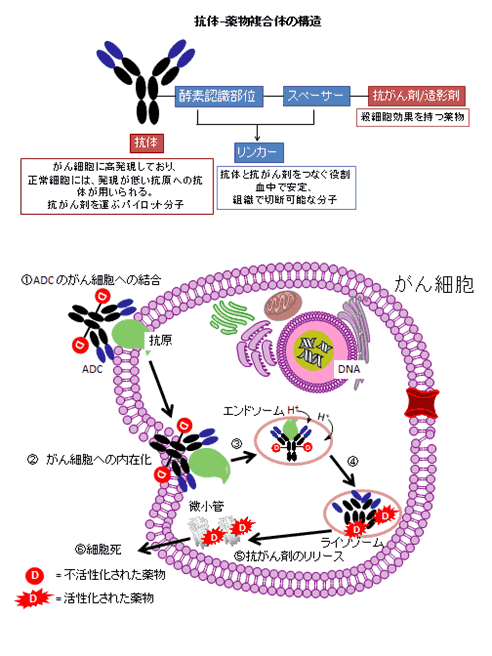
図1:ADCの仕組み
- ADCが抗原に結合する。
- ADCと抗原が細胞内に取り込まれる。
- ADCがエンドソーム、ライソゾームにより分解され、薬物が放出される。
- 細胞がダメージを受ける。
研究成果の概要
本研究グループが確立した手法では、質量顕微鏡により、ADCから放出された薬剤を明確に同定することができます。また、放出された薬がどこに、どの程度分布しているかを定性的、かつ半定量的に分析することが可能です(図2)。さらに、薬を放射性同位元素でラベルすることなく評価できるため、従来の方法に比べて正確ながん細胞への薬剤の分布がわかるだけでなく、コストや簡便性の点でも優れています。
また、がんと血液凝固の関係は古くから知られています。新薬開発分野では、血管外に漏れ出した血液の凝固反応が、がん細胞の表面、あるいは腫瘍血管および周囲の組織因子(Tissue factor:TF)の発現によって起こることに着目し、その組織因子に対する抗体を樹立しました。さらに、その抗体に、理化学研究所で作製したリンカーでMMAEという薬を付加したADC(抗TF抗体-MMAE複合体)を作製しました。このADCを担がんマウスに静脈注射し、質量顕微鏡(注2)を用いてADCががん組織に運ばれ、MMAEががん組織中のがん細胞のかたまりのところで特異的に放出されていることを確認しました(図3)。
これまでADCの体内動態をみるには、付加した薬を放射性同位元素で標識(ラベル)する必要がありましたが、この方法ではコストが高く、時間もかかります。また、薬を放出する前と、放出された後の状態を見分けることができず、ADCが本当にがん細胞に到達しているのか、さらにそこで薬が放出されているのかまでは評価できませんでした。
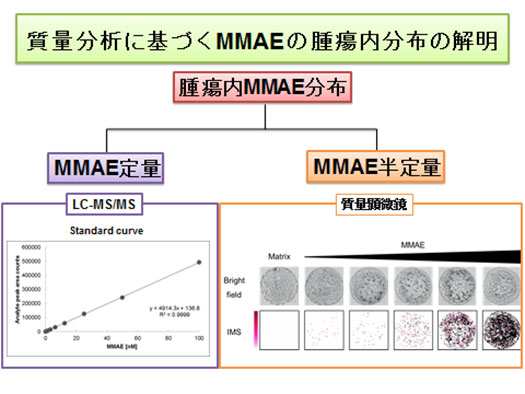
図2:質量分析に基づくMMAEの腫瘍内分布の解明
薬剤MMAEを質量顕微鏡用スライドグラス上に塗布し、質量顕微鏡で解析した。用量依存的にドットが増えていることがわかる。
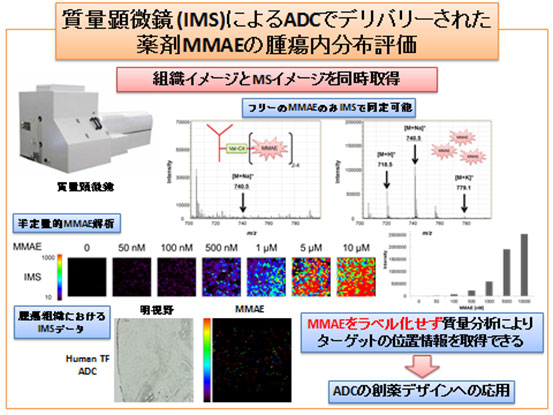
図3:質量顕微鏡によるADCでデリバリーされた薬剤MMAEの腫瘍内分布評価
薬剤MMAEはADCに結合している状態では質量顕微鏡により検出されないが、ADCからリリースされてフリーの状態になって、初めて検出される。
今後の展望
ADCの研究開発は、今後さらに活発化することが予測されます。本研究で確立した腫瘍内薬剤分布の評価方法は、ADCががん組織に到達し、付加薬物ががん細胞まで送達される至適な条件を導き出すにあたって、きわめて簡便かつ正確な方法といえます。今後、ADCの精巧な設計のためには欠かせない手法のひとつとして期待されます。
発表論文
- 雑誌名:Scientific Reports
- タイトル:Imaging mass spectrometry for the precise design of antibody-drug conjugates
- 著者:Yuki Fujiwara, Masaru Furuta, Shino Manabe, Yoshikatsu Koga, Masahiro Yasunaga, Yasuhiro Matsumura
- URL:http://www.nature.com/articles/srep24954(外部サイトにリンクします)
- DOI:10.1038/srep24954
研究費
国立がん研究センターがん研究開発費 26-A-14「ナノテクノロジーを応用したがん新薬開発基盤研究」
用語解説
- 注1 抗体薬物複合体(Antibody-drug conjugate: ADC)製剤
抗体に抗がん剤などの薬を付加したもの。抗体が特定の分子をもつがん細胞に結合する性質を利用して、薬をがん細胞まで運び、そこで薬を放出することで、抗腫瘍効果を発揮する。 - 注2 質量顕微鏡
科学技術振興機構「先端計測分析技術・機器開発プログラム」の支援のもと、株式会社島津製作所で開発された、光学顕微鏡と質量分析計を融合した分子イメージング装置。従来の質量分析法では、生体組織を破砕・分離してから目的分子を測定するため、分子が生体試料のどの部位に分布しているか評価することはできなかったが、質量顕微鏡では、見ているものや、見ている場所に含まれている分子をそのまま質量分析することが可能。また、これまでの質量分析イメージング装置では、通常100-200μmであった解像度が、質量顕微鏡では最小5μmでの細胞レベルを判別できる高解像度イメージングを可能とするため、これまで判別できなかった細胞内薬物分布を解析する手法としても期待されている。
プレスリリース
- 抗体薬物複合体(ADC)のがん組織中の薬物放出・分布を可視化した画期的な方法を確立
関連ファイルをご覧ください。
問い合わせ先
国立研究開発法人 国立がん研究センター
郵便番号:277-8577 千葉県柏市柏の葉6-5-1
先端医療開発センター 新薬開発分野 松村保広
電話番号:04-7133-1111(代表)
Eメール:yhmatsum●east.ncc.go.jp(●を@に置き換えください)
企画戦略局 広報企画室(柏キャンパス)
電話番号:04-7133-1111(代表)、04-7134-6945(直通)
Eメール:ncc-admin●ncc.go.jp(●を@に置き換えください)
国立研究開発法人理化学研究所
広報室 報道担当
電話番号:048-467-9272
Eメール:ex-press●riken.jp(●を@に置き換えください)
株式会社島津製作所
広報室
電話番号:075-823-1110
Eメール:press●group.shimadzu.co.jp(●を@に置き換えください)
