AIで早期胃がんの範囲診断が可能に-内視鏡専門医の診断精度に迫る-
2023年6月6日
理化学研究所
国立がん研究センター
理化学研究所(理研)光量子工学研究センター画像情報処理研究チームの竹本智子研究員、横田秀夫チームリーダー(情報統合本部先端データサイエンスプロジェクト副プロジェクトリーダー)、国立がん研究センター東病院消化管内視鏡科の矢野友規科長、堀圭介医員(研究当時)らの共同研究チームは、内視鏡専門医の診断精度に迫る早期胃がんの自動範囲診断AIを確立しました。
本研究成果によって、今後世界中で増加が予想される消化器内視鏡検診において、医師の診断を補助し、熟練度の差による見逃しなどの誤診や装置性能の違いによる施設間の診断格差などを減らせると期待できます。
早期の胃がんは形態変化に乏しく胃炎などの炎症との区別が難しいため、内視鏡検査では専門医でも発見が難しい場合があります。また、発見だけでなく、がんの浸潤範囲を正しく判断することは、その後の治療精度に大きく関わりますが、早期胃がんは病変境界が不明瞭で、医師でも範囲診断が難しい場合もあります。
今回、共同研究チームはディープラーニング[1]を活用した早期胃がんの自動検出に関する先行研究を発展させ、早期胃がんの領域予測を可能にするAIを開発し、臨床現場の1年分の連続症例を用いて検証しました。その結果、137症例中130症例(94.9%)において早期胃がんの発見に成功しました。また、AIが決定した病変範囲と6名の専門医による範囲診断を比較した予備調査では、AIは感度に優れ、真の病変領域との領域一致率は専門医とほぼ同等の結果を獲得しました。
本研究は、科学雑誌『Journal of Gastroenterology』オンライン版(5月31日付)に掲載されました。
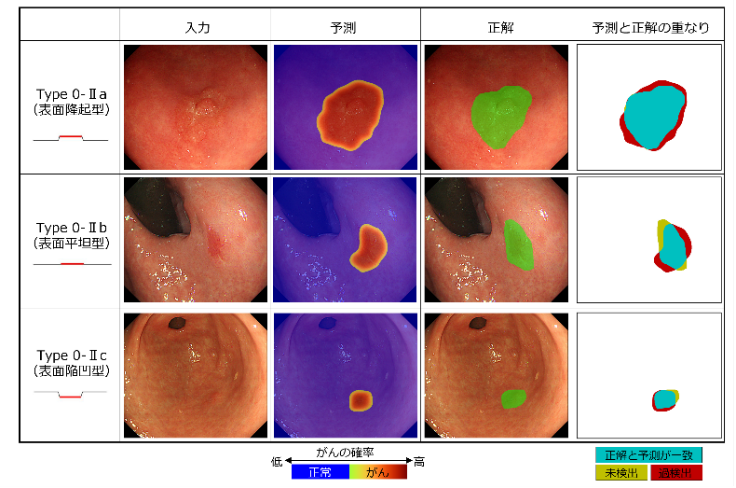 内視鏡検査画像に対する専門医の範囲診断とAIによる領域予測の比較
内視鏡検査画像に対する専門医の範囲診断とAIによる領域予測の比較
背景
胃がんは最も死亡率が高いがんの一つであり、全世界で1年当たりの新規発症者は約100万人、死者は約80万人報告されています注1)。近年、内視鏡検査による検診が日本でも導入されつつあり、胃がんの早期発見は死亡率を低減させることが報告されています。一方で、早期の胃がんは隆起や陥凹(かんおう)などの形態的特徴が乏しく、胃炎などの炎症による変化との判別が難しいことから、内視鏡検査での見逃しが問題になることがあります。また、検査装置や医師の技量の違いによる病変発見率の差が問題となっており、診断能の均霑化[2](きんてんか)や増え続ける検査ニーズに対する医師の負担軽減のため、コンピュータを活用した診断支援技術が求められていました。
そこで、内視鏡検査に機械学習を導入した医師の診断支援の取り組みが始まっています。大腸内視鏡を対象とした診断支援AIについて多くの研究成果が世界的に報告され、日本でも医薬品医療機器等法に基づく承認を取得し、実用化が始まったものもあります。しかし、特に早期の胃がんでは、大腸内視鏡の診断支援AIほどの成果は得られていませんでした。一般に、AIの学習には大量の学習用データが必要となりますが、早期胃がんは消化器内視鏡の専門医であっても発見が難しく、学習用データの作成に多くの時間がかかるという問題があったからです。
この問題に対し、共同研究グループは先行研究において、少数のデータで病変特徴を効率的に学習できるAIを提案し、早期胃がんのおおよその領域を自動検出することに成功しました注2)。一方で、実際の臨床現場では、早期の胃がんの標準治療となりつつある内視鏡的切除術に向け、切除すべき範囲を正確に同定する必要があることから、おおよその領域検出では将来の実用化には不十分でした。
注1) Bray F, Ferlay J, et al., Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin., 68(6): 394-424, 2018.
注2) 2018年7月21日プレスリリース「AIで早期胃がん領域の高精度検出に成功」 https://www.riken.jp/press/2018/20180721_2/(外部サイトにリンクします)
研究手法と成果
共同研究チームは早期胃がんの範囲診断に向け、画像の1画素単位で病変の存在確率を予測できるAIを構築しました。このAIでは、先行研究での小規模なデータを効率的に学習できる機能を維持し、消化器内視鏡の専門医が病変領域を正確にアノテーション[3]した「がん画像」150枚、がんが含まれない「正常画像」150枚の計300枚を基にした学習を実現しています。これらの画像は、国立がん研究センター東病院で約1年間に収集された連続68症例から、無作為に抽出されたものです。データ拡張[4]などによって約113万枚に増やした上で、早期胃がんの表面性状や色調などの細かな画像特徴を、ディープラーニングの一つである畳み込みニューラルネットワーク(CNN)[5]で学習できるようにしています。
学習済みのCNNでは、新たな入力画像に対して病変の存在確率を1画素単位で予測します。本研究では、予測したい画像を複数に分割してからCNNに入力し、複数回の予測結果を重ね合わせて予測の高精度化を図っています。具体的には、範囲診断したい内視鏡画像を約1,600個のブロックに分割し、ブロックごとでの病変の存在確率を予測します(図1)。予測結果を重み付け関数[6]に従って重ね合わせることよって、各画素の予測は最大で約1,600回となり、予測精度が大幅に向上しました。ブロック分割数と予測精度は比例する一方で、分割数と予測時間は反比例することから、将来の検診や日常診療などにおいては、予測性能とリアルタイム性のどちらを重視するかなど、目的によってブロック数を決定した上で、予測することが可能です。
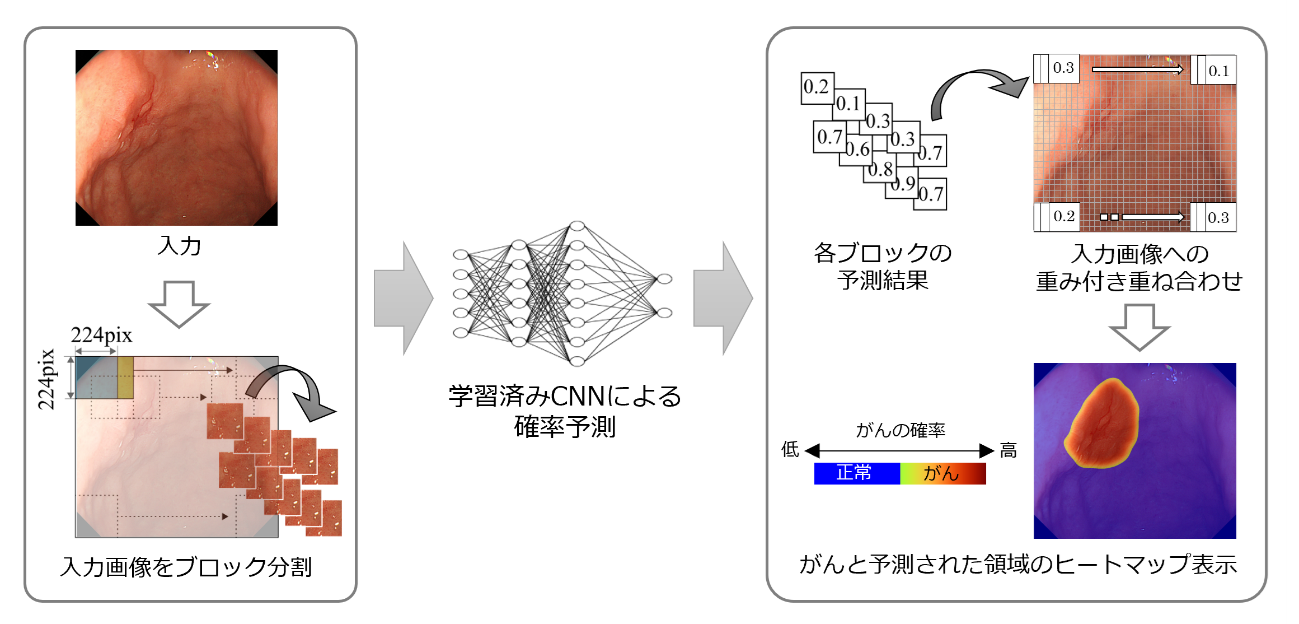 図1 早期胃がんの領域予測のフロー
図1 早期胃がんの領域予測のフロー
学習済みの畳み込みニューラルネットワーク(CNN)を用いて、入力画像(内視鏡検査画像)に存在する早期胃がんの領域予測を実現するフローを示す。入力画像を可変数のブロックに分割し、CNNによってブロックごとの病変の存在確率を予測する。存在確率を重み付け関数に従って元の入力画像に当てはめることで、1画素ごとの存在確率が求められる。ヒートマップは、存在確率が50%以上の画素を病変領域としてレインボーカラーで表示したもの。
構築したAIを、学習用データとは別の約1年間に収集された連続137症例(がん画像462枚、正常画像396枚)を使って評価したところ、がん画像387枚(83.8%)、正常画像307枚(77.5%)で早期胃がんの有無を正しく判定したことが分かりました。陽性的中率[7]は81.3%、陰性的中率[7]は80.4%でした。症例ベースでは、130例(94.9%)で病変の有無を正しく判定しました。また、専門医が内視鏡検査後の病理診断を参照して作成した正確な範囲診断と、AIによる予測領域とを比較したところ、IoU[8]と呼ばれる正解領域と予測領域の一致度について、その評価指標の一種であるmIoU[8]で66.5%を獲得しました。図2は予測結果の一例を示しています。
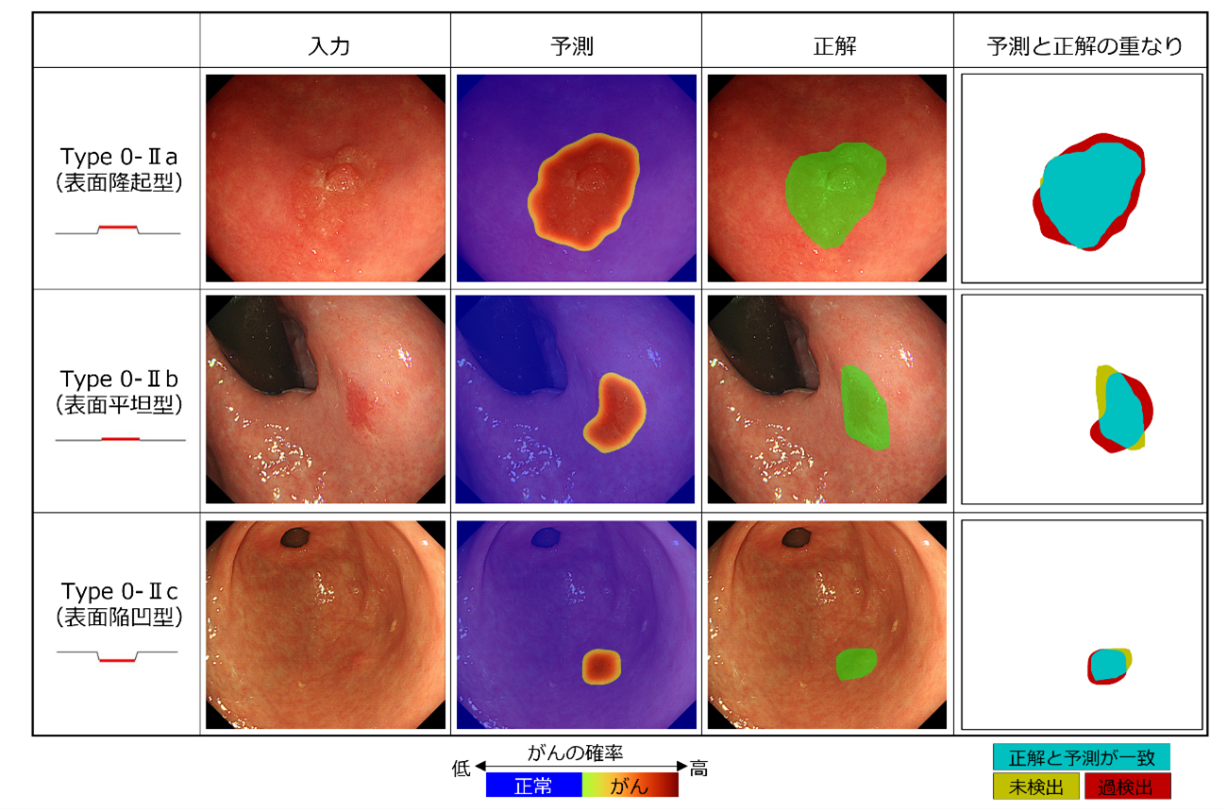 図2 内視鏡検査画像に対する専門医の範囲診断とAIによる領域予測の比較
図2 内視鏡検査画像に対する専門医の範囲診断とAIによる領域予測の比較
AIによる領域予測結果と専門医が作成した正解領域との重なりを示す。ここでは、早期胃がんの肉眼型分類のうち、表面隆起型(Type 0-IIa)、表面平坦型(Type 0-IIb)、表面陥凹型(Type 0-IIc)の3タイプについて、代表的な結果例を示した。
また予備調査として、AIが画像中で胃がんの存在を正しく判定したがん画像387枚のうち、無作為に抽出した38枚に対し、6名の消化器内視鏡専門医とAIによる病変の検出能、および範囲診断を比較しました。なお、日常診療では医師は拡大内視鏡やNBI内視鏡を併用することが多いですが、今回の比較では専門医は通常白色光を用いた非拡大内視鏡からの画像のみを用いています。その結果、AIは感度に優れ、mIoUは専門医とほぼ同等の精度を獲得しました(表)。早期胃がん領域の予測に関して、AIが専門医の範囲診断に迫る性能を獲得したのは本研究が初めてです。
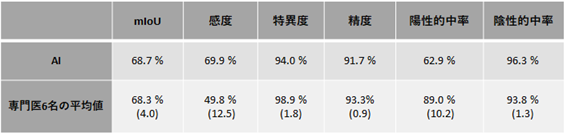 表 専門医の範囲診断とAIの領域予測の比較
表 専門医の範囲診断とAIの領域予測の比較
AIは専門医に比べて感度に優れ、mloUはほぼ同等であった。感度とは陽性のものを正しく陽性と判断する割合、特異度とは陰性のものを正しく陰性と判断する割合のことである。なお括弧内は標準偏差を示す。
今後の期待
本研究では、少量の学習用データで効率的に早期の胃がん病変を学習できるAIを開発し、内視鏡検査画像内の病変の有無だけでなく、専門医の範囲診断と同等の精度で病変の領域予測ができるようになりました。学習用データが少なくて済むことは、AIを他施設や他装置の画像に適用するための再学習が容易であるというメリットがあります。加えて、例えば希少がんなどのように、学習用データの収集が困難である対象にも適用できる可能性があります。
また本研究では、早期胃がんの領域予測に関して内視鏡専門医による範囲診断と同等の性能を示すことが出来ました。このことは将来、世界中で増加が予想される検診や日常診療への内視鏡画像診断の導入に際して、医師の負担を軽減し、熟練度や装置性能の違いによる診断能の差を軽減するなど、診断技術の均霑化の強力なツールとなるものと期待できます。
論文情報
タイトル
Computer-aided demarcation of early gastric cancer: a pilot comparative study with endoscopists
著者名
Satoko Takemoto, Keisuke Hori, Yoshimasa Sakai, Masaomi Nishimura, Keiichiro Nakajo, Atsushi Inaba, Maasa Sasabe, Naoki Aoyama, Takashi Watanabe, Nobuhisa Minakata, Hiroaki Ikematsu, Hideo Yokota, Tomonori Yano
雑誌
Journal of Gastroenterology
DOI
補足説明
[1] ディープラーニング
機械学習の計算手法の一つで、多層(狭義には4層以上)のニューラルネットワークのこと。画像や動画、テキスト、音声などの分類・識別問題に用いられている。ニューラルネットワークとは、脳機能に見られるいくつかのネットワークを計算機上のシミュレーションで表現することを目指した数学モデルである。
[2] 均霑化
ここでは、がんに対する標準的な専門医療を、多くの患者が医師や施設の違いなく受けられるよう、医療技術などの格差の是正を図ることを指す。
[3] アノテーション
ディープラーニングなどの機械学習の際に、人間による判断を正解情報として利用する場合があり、例えば画像診断であれば単なる数値集合である画像に何らかの意味情報を付与する必要がある。この作業をアノテーションと呼ぶ。ここでは、検査画像に対し、医師が病変領域を正確にラベル付けする作業のことを意味する。
[4] データ拡張
学習用データに変換を加えて、データ量を増やすこと。特に大量の学習データが必要なCNNなどで学習の性能向上に役立つ。変換には、拡大縮小、反転、回転シフト、色変換などがある。
[5] 畳み込みニューラルネットワーク(CNN)
画像の分類や識別で高い性能を発揮するディープラーニングの一つ。あらかじめ与えられていた画像データから画像の特徴量を直接抽出し、ネットワークを学習する。CNNはConvolutional neural networkの略。
[6] 重み付け関数
ここでは、ブロックごとに予測された病変の存在確率を元の画像に重ね合わせる際、予測値に掛け合わせる重みを画素ごとに決める関数のこと。ブロックの中央に近い画素には大きな重みを、遠い画素には小さい重みとなるようあらかじめ定義し、ブロックごとの存在確率と各画素の重みを掛け合わせた値が各画素の予測値となる。各画素は複数のブロックにまたがるため、実際には複数回の予測値の平均値を最終的な予測値とした。
[7] 陽性的中率、陰性的中率
陽性的中率とは、例えば検査で陽性(今回のケースでは、胃がん)となった場合に、真に陽性(がん)が存在する割合のこと。陰性的中率とは、検査で陰性(ここでは、胃がんではない)となった場合に、真に陰性(正常または胃がんではない)である割合のこと。
[8] IoU、mIoU
IoUは、正解領域(例えば、人がラベル付けした領域)と予測領域の重なり具合を示す指標の一つ。重なりが大きいほど大きな値となる。mIoU(mean IoU)はクラスごとに領域の重なり(IoU)を計算した平均値。ここでは「がん」と「正解」のそれぞれのクラスについて、正解領域との重なりを計算した平均値を示している。IoUはIntersection over Unionの略。
共同研究チーム
理化学研究所 光量子工学研究センター 画像情報処理研究チーム
研究員 竹本智子(タケモト・サトコ)
チームリーダー 横田秀夫(ヨコタ・ヒデオ)
(情報統合本部 先端データサイエンスプロジェクト 副プロジェクトリーダー)
テクニカルスタッフII(研究当時) 坂井良匡 (サカイ・ヨシマサ)
テクニカルスタッフI 西村将臣(ニシムラ・マサオミ)
国立がん研究センター東病院 消化管内視鏡科
科長 矢野友規(ヤノ・トモノリ)
医長 池松弘朗(イケマツ・ヒロアキ)
医員(研究当時) 堀圭介(ホリ・ケイスケ)
医員 中條恵一郎(ナカジョウ・ケイイチロウ)
医員 稲場 淳 (イナバ・アツシ)
レジデント(研究当時) 笹部真亜沙(ササベ・マアサ)
レジデント(研究当時) 青山直樹(アオヤマ・ナオキ)
がん専門修練医 渡邊崇(ワタナベ・タカシ)
がん専門修練医 南方信久(ミナカタ・ノブヒサ)
研究支援
本研究の一部は、日本学術振興会(JSPS)科学研究費助成事業基盤研究(C)「早期胃がんの機能的特徴を活用したAI内視鏡画像診断(21K12742、研究代表者:竹本智子)」および国立がん研究センター研究開発費「新しい内視鏡・AI機器等を用いたがんに対する革新的医療を創出するための産学連携開発プラットフォーム構築に関する研究(2020-A-10、研究代表者:矢野友規)」による助成を受けて実施されました。
発表者・機関窓口
発表者 *研究内容については発表者にお問い合わせください。
理化学研究所 光量子工学研究センター 画像情報処理研究チーム
研究員 竹本智子(タケモト・サトコ)
チームリーダー 横田秀夫(ヨコタ・ヒデオ)
(情報統合本部 先端データサイエンスプロジェクト 副プロジェクトリーダー)
国立がん研究センター東病院 消化管内視鏡科
科長 矢野友規(ヤノ・トモノリ)
医員(研究当時) 堀圭介(ホリ・ケイスケ)
機関窓口
理化学研究所 広報室 報道担当
Tel: 050-3495-0247
Email: ex-press●ml.riken.jp
国立がん研究センター 企画戦略局 広報企画室(柏キャンパス)
Tel: 04-7133-1111(代表)
Email: ncc-admin●ncc.go.jp
