トップページ > 研究組織一覧 > 分野・独立ユニットグループ > がん治療学研究分野 > 研究成果の概要 (Research Highlights)
研究成果の概要 (Research Highlights)
1. イントロダクション【Introduction】
遺伝子欠損の「裏」をかく。独自の合成致死戦略による創薬ターゲットの同定
がん治療学研究分野では、独自に構築した「パラログ同時阻害法」および「大規模細胞株データベース」を駆使し、がん細胞の脆弱性を突く新しい治療標的を次々と同定しています。これまでの主要な研究成果をご紹介します。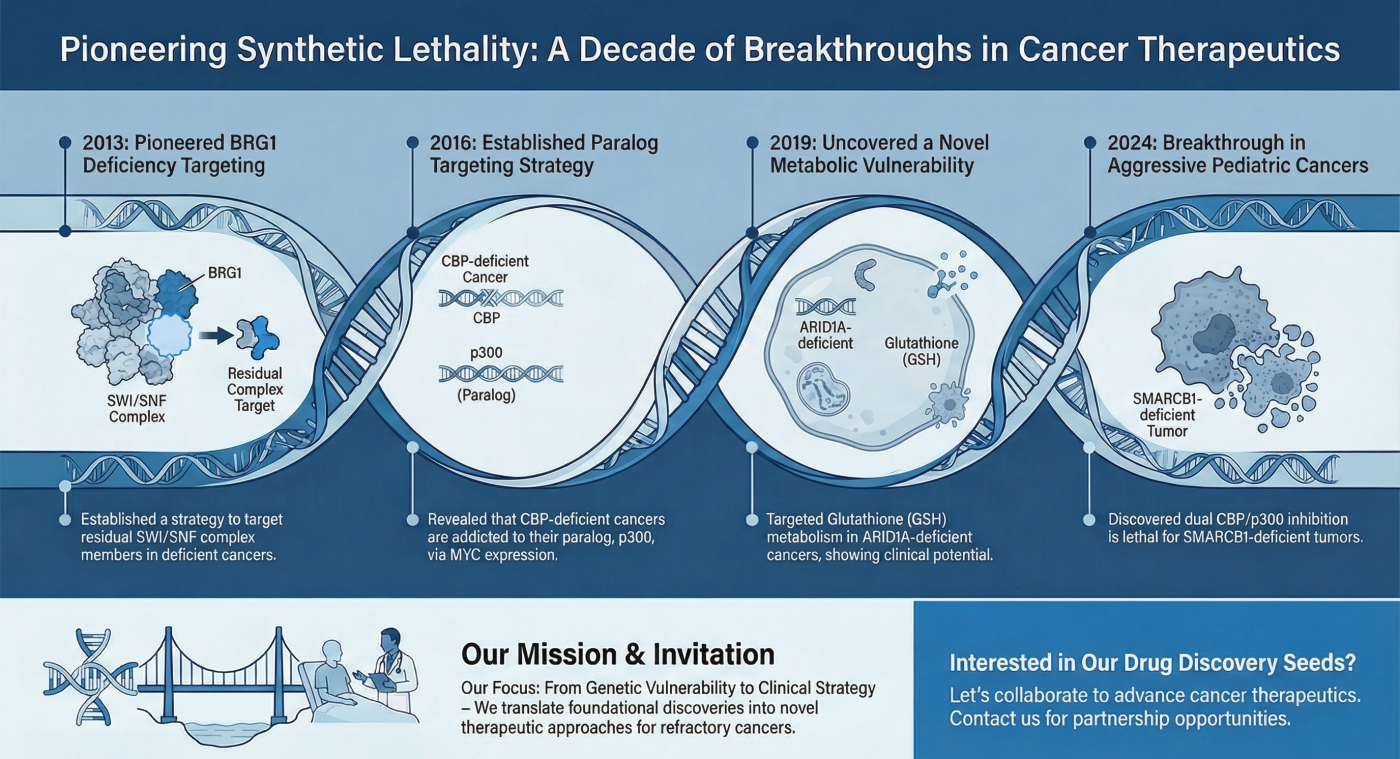
2. 研究の基盤となる独自戦略【Core Concept】
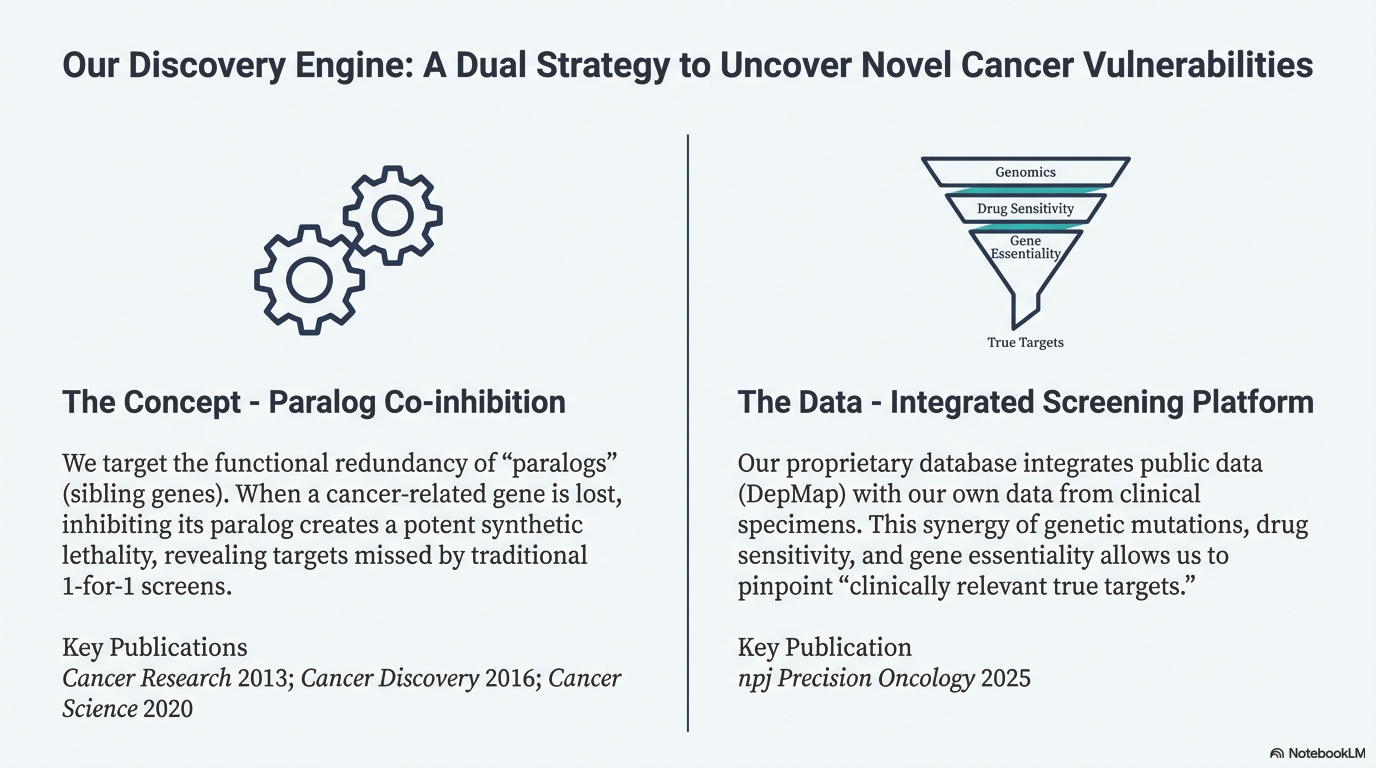
次世代型合成致死戦略:パラログ同時阻害法の確立
- 概要: ヒト遺伝子の多くには、機能が類似した「パラログ(兄弟遺伝子)」が存在し、互いに機能を補完し合っています。私たちは、がん細胞で特定の遺伝子が欠損している場合、そのパラログを阻害することで致死的なダメージを与えられること(合成致死)に着目しました。 従来の「1対1」の探索では見つからなかった標的を、「パラログペアの同時阻害」という新しい概念で攻略します。この概念の実証として、SMARCA4欠損がんにおけるSMARCA2の標的化などを報告しています。
- 関連論文: Cancer Research. 2013; Cancer Discovery. 2016, Cancer Science. 2020
がん細胞株データベースの構築と標的探索
- 概要: 希少がんや難治性がんを含む多数の細胞株について、遺伝子変異データと薬剤感受性・遺伝子必須性データを統合した独自のデータベースを構築しています。 DepMapなどの公共データベースと、当研究所独自の臨床検体由来データを組み合わせることで、「臨床に即した真の治療標的」を抽出するスクリーニング基盤を確立しました。
- 関連論文: npj Precision Oncology. 2025
3. 最新の主力プロジェクト【Latest Highlight】
SMARCB1欠損がん(肉腫)に対するCBP/p300同時阻害

- ターゲット: ラブドイド腫瘍、類上皮肉腫(SMARCB1欠損)
- 発見のポイント: ヒストンアセチル化酵素である「CBP」と「p300」はパラログ関係にあります。SMARCB1欠損がんにおいては、CBPとp300の両方を阻害することで初めて強力な合成致死が誘導されることを発見しました。 これは、「パラログ同時阻害」の概念が難治性希少がんの治療に直結することを示した重要な成果です。
- 臨床への展望: 現在、製薬企業と共同でCBP/p300二重阻害剤の開発を進めています。
- 掲載論文: Nature Communications 2024
4. 代謝脆弱性の攻略【Major Achievement】
ARID1A欠損がんにおけるグルタチオン代謝の脆弱性(GCLC阻害)

- ターゲット: 卵巣明細胞がん、胃がん(ARID1A欠損)
- 発見のポイント: ARID1A欠損がんは、抗酸化物質であるグルタチオン(GSH)の代謝レベルが低く、酸化ストレスに対して脆弱であることを見出しました。 GSH合成の律速酵素である「GCLC」を阻害することで、がん細胞内の活性酸素(ROS)を爆発的に増加させ、特異的に死滅させることに成功しました。
- 創薬の可能性: 代謝酵素を標的とした新しい合成致死治療薬(GCLC阻害剤)としての開発が期待されます。
- 掲載論文: Cancer Cell 2019
[詳細なデータ・メカニズムを見る >]
5. 既存薬の最適化・再配置【Clinical Insight】
核酸代謝阻害剤(ゲムシタビン)の感受性予測
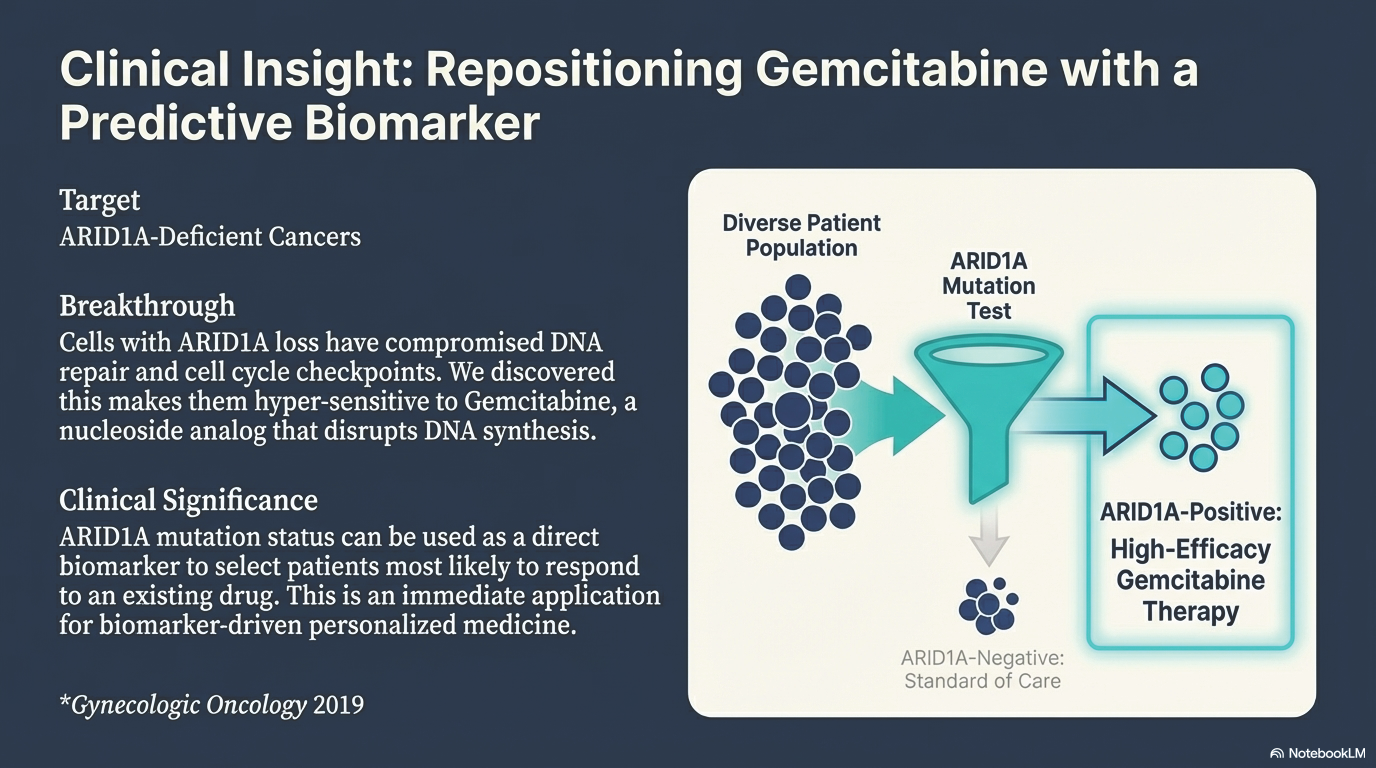
- ターゲット: ARID1A欠損がん
- 発見のポイント: ARID1A欠損がん細胞は、DNA修復能や細胞周期チェックポイントに異常をきたしており、核酸代謝阻害剤であるゲムシタビンに対して高い感受性を示すことを明らかにしました。
- 臨床的意義: すでに臨床で使用されている薬剤(ゲムシタビン)が、ARID1A変異を持つ患者さんに対して特に有効である可能性を示唆しており、バイオマーカーに基づいた個別化医療への即時応用が期待できる成果です。
- 掲載論文: Gynecologic Oncology 2019
[詳細なデータ・メカニズムを見る >]

