トップページ > 診療科・共通部門 > 内科系 > 肝胆膵内科 > 神経内分泌腫瘍
神経内分泌腫瘍
目次
神経内分泌腫瘍(しんけいないぶんぴつしゅよう)について
体内には「神経内分泌細胞」と呼ばれる細胞が存在し、様々なホルモンを分泌して生体のバランスを保っています。例えば血糖値のコントロールに重要なホルモンであるインスリンは、膵臓に存在するβベータ細胞と呼ばれる神経内分泌細胞から分泌され、血糖値を下げる働きを担っています。
神経内分泌腫瘍とは、この神経内分泌系の細胞が似た形への変化(分化)を示す腫瘍で、膵臓のほか、胃や小腸などの消化管や肺などの様々な臓器に発生します。これまで神経内分泌腫瘍は発生臓器ごとに分けて検討されることが多かったのですが、臓器が異なっても様々な特徴を共有することから、近年は神経内分泌腫瘍と総称されています。
神経内分泌腫瘍は一般的に他の悪性腫瘍に比べてゆっくりと進行することが多く、以前は「カルチノイド(がんもどき)」などと呼ばれていました。しかし、実際には腫瘍の分化度(腫瘍の分化の成熟の度合い)や増殖能(腫瘍細胞が分裂し増殖する能力)によって悪性度に幅があり、進行の速さが異なることが分かってきています1。
さらに近年では、神経内分泌腫瘍のなかでも分化度が高く増殖能が比較的低い腫瘍を「NET(ネット:Neuroendocrine tumor)」、分化度が低く増殖能が高い腫瘍を「NEC(ネック:Neuroendocrine carcinoma)」と呼ぶようになり、両者は遺伝子のパターンも病態も異なる疾患であることが明らかになってきました2,3。
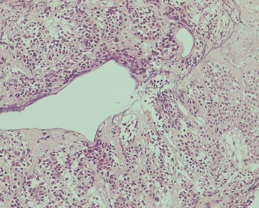
図NETの病理組織像(ヘマトキシリン・エオジン染色)
腫瘍細胞が、リボンのようなパターンで配列したり、小さな巣を形成するように集まって(これを胞巣と言います)、増殖しています。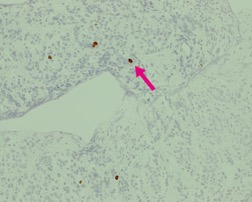
図NETの腫瘍増殖能(Ki-67染色)
腫瘍細胞の増殖能を示すマーカーであるKi-67の染色では、わずかに陽性の細胞(↓)が認められます(全体の1%)。
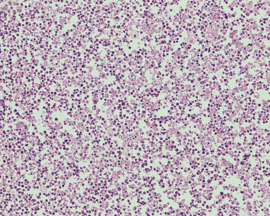
図NECの病理組織像(ヘマトキシリン・エオジン染色)
濃い核をもつ腫瘍細胞が、壊死物質のなかに散らばるように存在しています。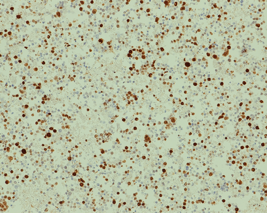
図 NECの腫瘍増殖能(Ki-67染色)
腫瘍細胞の増殖能を示すマーカーであるKi-67の染色では、陽性の細胞が多数認められます(全体の50%以上)
病気の原因
発生臓器は膵臓や消化管のほか、肺や甲状腺など多岐にわたりますが、好発部位には民族間で差が見られています。4,5アメリカ白人では肺が最も多いのに対して、北欧では小腸、アジア人やアフリカ系アメリカ人、アメリカ先住民では直腸が最も多いことが知られています。
神経内分泌腫瘍の頻度は比較的稀です。新たに診断される患者数(罹患者数)はアメリカの報告では神経内分泌腫瘍全体で100,000人あたり年間6.98人1、日本では膵・消化管原発の神経内分泌腫瘍で年間2.69人と推定されていますが6、いずれも年々増加傾向にあります1,7。
神経内分泌腫瘍は30-60歳という幅広い年齢層に発生し、性別による違いはないと考えられています。またNETの一部は遺伝性疾患との関連が指摘されており、副甲状腺や下垂体などにも腫瘍を合併しやすい多発性内分泌腫瘍症1型や、脳や脊髄、目の網膜、副腎髄質や腎臓などにも腫瘍を合併しやすいvon Hippel-Lindau(フォン・ヒッペル・リンドウ)病などの疾患に好発することが知られています。
症状
神経内分泌腫瘍は時として様々なホルモンを作り出すことがあり、これによる症状の有無により、「機能性NET」と「非機能性NET」に分類されます。
ホルモン症状のない非機能性NETの場合は特徴的な症状は少なく、腹痛や腹部膨満感といった症状が多くみられます。一方、機能性NETの場合、産生されるホルモンによって下記のような症状がみられます。
表機能性NETによる臨床症状
| 腫瘍のタイプ | ホルモン | 臨床症状 |
|---|---|---|
| カルチノイド | セロトニン プロスタグランジン ヒスタミン ブラジキニンなど |
皮膚の紅潮、下痢、むくみ、喘息、心不全など |
| インスリノーマ | インスリン | 低血糖症状(冷や汗、動悸、意識障害など)など |
| ガストリノーマ | ガストリン | 胃・十二指腸潰瘍、慢性下痢、腹痛、胸焼け、体重減少など |
| グルカゴノーマ | グルカゴン | 皮膚の発赤を伴った発疹(壊死性遊走性紅斑と呼ばれます)、体重減少、高血糖など |
| ソマトスタチノーマ | ソマトスタチン | 腹痛、体重減少、高血糖、胆石症、脂肪便、下痢など |
| VIP(血管作動性腸管ペプチド)オーマ | VIP | 下痢、低カリウム血症(脱力や不整脈など)、胃酸分泌の低下など |
検査・診断
神経内分泌腫瘍の大きさや広がり(転移)を診断したり、治療経過を確認するために、血液検査や造影CT検査、造影MRI検査などを行います。NETは一般に血流が豊富な腫瘍であることから、これらの検査で造影剤を投与すると輝くように強く造影されるのが特徴です。一方、NECは多彩な所見を示し、腫瘍内部が壊死をきたすために造影されないことも多く、他のがんとの区別が難しいことも多くあります。
図 NETの画像の特徴(造影CT検査)
膵臓に強く造影される、直径5cmほどの腫瘍が認められます。
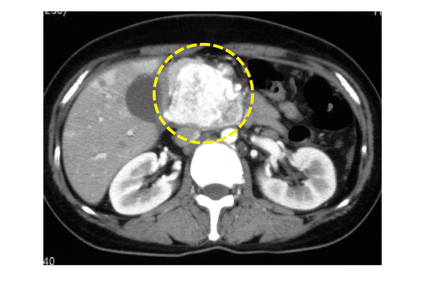
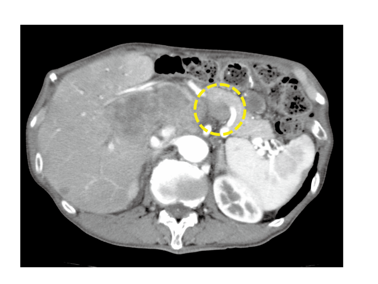
図 NECの画像の特徴(造影CT検査)
膵臓に造影の弱い腫瘍を認め、肝臓などにも転移が確認できます。
- 超音波内視鏡下穿刺吸引法(ちょうおんぱないしきょうかせんしきゅういんほう)や経皮的肝生検といった、内視鏡や超音波を用いた検査によって病変から腫瘍組織を採取し、神経内分泌腫瘍の診断や分類を行います。
- 神経内分泌腫瘍の広がりや、後述するソマトスタチンアナログの効果が期待できるかを調べるために、NETに特異的に出現しているソマトスタチン受容体の発現を調べるソマトスタチン受容体シンチグラフィーを行うことがあります。
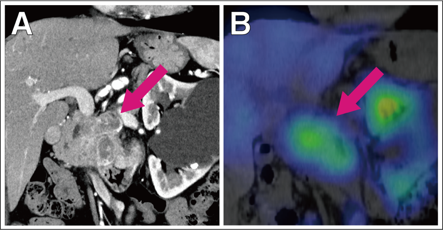
図NETの画像の特徴(ソマトスタチン受容体シンチグラフィー)
造影CT検査で膵臓に腫瘍を認め(A)、ソマトスタチン受容体シンチグラフィーでは腫瘍に集積が認められています(B)。腫瘍にソマトスタチン受容体が発現していると考えられたことから、ソマトスタチンアナログによる薬物療法が開始されました。
病期(ステージ)
4に記載した検査を行い、神経内分泌腫瘍の確定診断、がんの進行度の分類である病期(ステージ)や切除可能性の診断を行います。これらの検査結果に加え、症状、体の状態、年齢などを総合的に判断して、患者さん一人一人の治療方法を決定していきます。
病期(ステージ:Stage)
神経内分泌腫瘍の病期の分類には、TNM悪性腫瘍分類(UICC)が用いられています。
- T因子はがんの大きさ、周囲への広がり
- N因子はリンパ節転移の有無
- M因子は遠隔転移、領域リンパ節を超えるリンパ節転移の有無
これらの因子の組み合わせでステージを分類しています。当科で診療する神経内分泌腫瘍のなかでも、特に頻度の高い膵臓および消化管(胃、小腸、大腸および直腸)の分類を以下に示します。
膵臓
T因子
| T0 | 原発ははっきりしない |
|---|---|
| T1 | 病変は膵臓内に留まり、長径は2cm以下 |
| T2 | 病変は膵臓内に留まるが、長径は2~4cm以下 |
| T3 | 病変は膵臓内に留まるが長径は4cmを超える、あるいは十二指腸や胆管に浸潤する |
| T4 | 病変は膵臓の臓側腹膜(漿膜)を貫通するか、他の臓器に浸潤する |
N因子
| N0 | リンパ節転移なし |
|---|---|
| N1 | リンパ節転移あり |
M因子
| M0 | 遠隔転移や、領域リンパ節を超えるリンパ節への転移なし |
|---|---|
| M1 | 遠隔転移や、領域リンパ節を超えるリンパ節への転移あり |
ステージ
| ステージI | T1 | N0 | M0 |
|---|---|---|---|
| ステージII | T2あるいはT3 | N0 | M0 |
| ステージIII | T4 | N0 | M0 |
| あらゆるT | N1 | M0 | |
| ステージIV | あらゆるT | あらゆるN | M1 |
胃
T因子
| T0 | 原発ははっきりしない |
|---|---|
| T1 | 病変は胃の粘膜固有層または粘膜下層に留まり、長径は1cm以下 |
| T2 | 病変は胃の固有筋層に達するか、長径が1cmを超える |
| T3 | 病変は胃の臓側腹膜(漿膜)下層に及ぶ |
| T4 | 病変は胃の漿膜を貫通するか、他の臓器に浸潤する |
N因子
| N0 | リンパ節転移なし |
|---|---|
| N1 | リンパ節転移あり |
M因子
| M0 | 遠隔転移や、領域リンパ節を超えるリンパ節への転移なし |
|---|---|
| M1 | 遠隔転移や、領域リンパ節を超えるリンパ節への転移あり |
ステージ
| ステージI | T1 | N0 | M0 |
|---|---|---|---|
| ステージII | T2あるいはT3 | N0 | M0 |
| ステージIII | T4 | N0 | M0 |
| あらゆるT | N1 | M0 | |
| ステージIV | あらゆるT | あらゆるN | M1 |
小腸
T因子
| T0 | 原発ははっきりしない |
|---|---|
| T1 | 病変は小腸の粘膜固有層または粘膜下層に留まり、長径は1cm以下 |
| T2 | 病変は小腸の固有筋層に達するか、長径が1cmを超える |
| T3 | 病変は小腸の臓側腹膜(漿膜)下層に及ぶが、漿膜を超えない |
| T4 | 病変は小腸の漿膜を貫通するか、他の臓器に浸潤する |
N因子
| N0 | リンパ節転移なし |
|---|---|
| N1 | 12個未満のリンパ節転移を認め、長径はいずれも2cm未満 |
| N2 | 12個以上のリンパ節転移を認めるか、長径は2cm以上 |
M因子
| M0 | 遠隔転移や、領域リンパ節を超えるリンパ節への転移なし |
|---|---|
| M1 | 遠隔転移や、領域リンパ節を超えるリンパ節への転移あり |
ステージ
| ステージI | T1 | N0 | M0 |
|---|---|---|---|
| ステージII | T2あるいはT3 | N0 | M0 |
| ステージIII | T4 | あらゆるN | M0 |
| あらゆるT | N1あるいはN2 | M0 | |
| ステージIV | あらゆるT | あらゆるN | M1 |
大腸および直腸
T因子
| T0 | 原発ははっきりしない |
|---|---|
| T1 | 病変は大腸あるいは直腸の粘膜固有層または粘膜下層に留まり、長径は2cm以下T1a 病変は長径が1cm未満T1b 病変は長径が1~2cm以下 |
| T2 | 病変は大腸あるいは直腸の固有筋層に達するか、長径が2cmを超える |
| T3 | 病変は大腸あるいは直腸の臓側腹膜(漿膜下層)か、周囲の組織に及ぶ |
| T4 | 病変は大腸あるいは直腸の漿膜を貫通するか、他の臓器に浸潤する |
N因子
| N0 | リンパ節転移なし。 |
|---|---|
| N1 | リンパ節転移あり。 |
M因子
| M0 | 遠隔転移や、領域リンパ節を超えるリンパ節への転移なし |
|---|---|
| M1 | 遠隔転移や、領域リンパ節を超えるリンパ節への転移あり |
ステージ
| ステージI | T1 | N0 | M0 |
|---|---|---|---|
| ステージIIA | T2 | N0 | M0 |
| ステージIIB | T3 | N0 | M0 |
| ステージIIIA | T4 | N0 | M0 |
| ステージIIIB | あらゆるT | N1 | M0 |
| ステージIV | あらゆるT | あらゆるN | M1 |
病理組織学的分類(グレード:Grade)
神経内分泌腫瘍の分類には、腫瘍の分化度と増殖能に基づいたWHO分類も広く用いられています。
- 分化度とは腫瘍の分化の成熟の度合いを示し、高分化型では腫瘍細胞は正常の内分泌細胞に似た形や構造をとりますが、低分化型では腫瘍細胞は未熟で正常の内分泌細胞と異なる形や構造をとります。
- 腫瘍の増殖能を評価するための指標として、Ki-67指数か核分裂像を用います。Ki-67指数とは、細胞分裂のときに生じるタンパク質であるKi-67に陽性を示す細胞の比率です。核分裂像は、細胞が細胞分裂によって増殖する過程の比較的早い段階で認められる現象で、顕微鏡の400倍率で観察した際の、10視野で認められた核分裂像の合計数で評価します。
2019年版WHO分類
| 分類 | Ki-67指数 | 核分裂像 | |
|---|---|---|---|
| 高分化型 | NET G1 | <3% | <2 |
| NET G2 | 3~20% | 2~20 | |
| NET G3 | >20% | >20 | |
| 低分化型 | NEC G3 | >20% | >20 |
NETに対する治療
手術
神経内分泌腫瘍のなかでも、転移がない場合や、転移があっても数が限られている場合など、病変が完全切除可能と考えられる場合には手術が行われます。また、転移などがあって病変が完全に取りきれなくても、手術によって腫瘍の量を減らすことで、症状や経過の改善が期待できると考えられる場合には、可能な範囲で病変を切除することがあります8。
ラジオ波焼灼術(ラジオはしょうしゃくじゅつ)・肝動脈塞栓術(かんどうみゃくそくせんじゅつ)
ラジオ波焼灼術とは、超音波装置で観察しながら腫瘍の中に電極のついた針を挿入し、電流を流して腫瘍の周囲に熱を発生させ、腫瘍細胞を凝固し死滅させる治療です。また、肝動脈塞栓術とは足の付け根の動脈からカテーテルを挿入し、腫瘍へ流れ込む細い血管まで進め、先端から塞栓物質を注入して腫瘍への血流を遮断する治療であり、しばしば腫瘍に対する「兵糧攻め」に例えられます。
いずれの治療も主に肝細胞がんに対して行われる治療ですが、機能性NETでは主に肝転移がホルモン産生を促し、様々なホルモン症状を引き起こすため、症状や経過の改善を期待して、可能な範囲で肝転移に対してラジオ波焼灼術や肝動脈塞栓術を行うことがあります。
薬物療法
転移をきたすなど進行した状態で発見された場合や手術後の再発に対しては、一般的に薬物療法が行われます9,8。
ホルモン製剤(ソマトスタチンアナログ)
ソマトスタチンは脳の視床下部や膵臓、消化管の内分泌細胞から産生されるホルモンの一種で、ソマトスタチン受容体に結合することで、他のさまざまなホルモンの働きを抑える働きがあります。ソマトスタチンアナログは人工的なホルモン製剤であり、NETに高頻度で認められるソマトスタチン受容体に結合することで、ソマトスタチンと同様にさまざまなホルモンの働きを抑える働きがあり、以前から機能性NETでみられるホルモン症状を改善するために使用されてきました。しかし、近年になってこのソマトスタチンアナログには神経内分泌腫瘍の増殖自体を抑える効果があることが明らかになり10,11、神経内分泌腫瘍の進行抑制のために使われるようになってきました。近年では薬剤の改良が進み、4週に1度の皮下注射あるいは筋肉注射で効果が得られることから、身体への負担も小さく、その使用頻度はますます増えてきています。
分子標的薬(エベロリムス、スニチニブ)
腫瘍細胞には様々な分子(タンパク質や遺伝子)が発現し、細胞の増殖をはじめとした多様な働きに関与しています。これらのうち特定の分子に結合することで、腫瘍細胞の増殖などを抑制し、腫瘍の進行を遅らせる薬剤が分子標的薬です。NETにはmTOR注3という分子を治療のターゲットとしたエベロリムスの有用性が示されているほか12,13、膵臓原発のNETにはVEGF注4という分子を治療のターゲットとしたスニチニブの有用性が示されており14、進行したNETの治療に広く用いられています。
注3哺乳類ラパマイシン標的タンパク質。腫瘍細胞が刺激を受けると、このmTORが活性化され、細胞分裂や血管の誘導(これを血管新生と言います)、エネルギー産生などが活発になり、腫瘍細胞の増殖が促進されます。
注4血管内皮増殖因子。腫瘍細胞はVEGFを産生することで血管新生を促進し、血管から栄養や酸素を取り込もうとします。その結果として、腫瘍の増殖や転移が促進されます。
細胞障害性抗がん剤(ストレプトゾシンなど)
分子標的薬などに対して、従来から用いられている抗がん剤は細胞障害性抗がん剤と呼ばれ、NETに対しても積極的に用いられています。なかでもストレプトゾシンは広く用いられてきた薬剤の一つで、細胞に取り込まれた後にDNAの合成を阻害し、腫瘍の増殖を抑えます。細胞障害性抗がん剤は古くから用いられてきましたが、近年では改めて有用性が見直される傾向にあります15。一般に、ストレプトゾシンは他の細胞障害性抗がん剤と組み合わせることで相乗作用を期待する併用療法が主流で、なかでも5-FUとの併用は最も広く用いられている治療のひとつです。
放射性核種標識ペプチド治療(Peptide receptor radionucleotide therapy: PRRT)
PRRTとは、放射線(β線)を放出する放射性物質と結合したソマトスタチンアナログを用います。この薬品は投与された後、NETに高頻度で認められるソマトスタチン受容体に結合し、腫瘍の内部で微量の放射線を放出して腫瘍の増殖を抑えます。海外では、まず消化管原発のNETに対する有用性が示され16、現在では膵原発のNETなどにも適応が拡がっています。この流れを受けて、日本でも2021年からPRRTの治療が認められるようになりました。(くわしくはこちら)
NECに対する治療
NECは増殖スピードが早く、一般に転移など進行した状態で発見されることが多く、薬物療法の対象となることが大半です。その一方で、NECには小細胞肺癌と同様の治療が効きやすいことが知られており17、シスプラチンやカルボプラチンといった細胞障害性抗がん剤を中心とした薬物療法が行われます18。これらの抗がん剤は細胞に取り込まれた後にDNAの複製を阻害し、腫瘍細胞の自滅を導くことで、腫瘍の増殖を抑える作用があり、シスプラチン+イリノテカン、シスプラチン+エトポシド、カルボプラチン+エトポシドといったように、他の抗がん剤と組み合わせて投与されます。
治験・臨床試験
当院ではよりよい治療法の確立を目指して、治験・臨床試験を実施しています。参加可能な試験の有無については、担当医にご相談ください。
参考文献
- Dasari A, Shen C, Halperin D, et al. Trends in the Incidence, Prevalence, and Survival Outcomes in Patients With Neuroendocrine Tumors in the United States. JAMA Oncol 2017;3時13分35-42.
- Konukiewitz B, Schlitter AM, Jesinghaus M, et al. Somatostatin receptor expression related to TP53 and RB1 alterations in pancreatic and extrapancreatic neuroendocrine neoplasms with a Ki67-index above 20. Modern pathology : an official journal of the United States and Canadian Academy of Pathology, Inc 2017;30:587-98.
- Hijioka S, Hosoda W, Matsuo K, et al. Rb Loss and KRAS Mutation Are Predictors of the Response to Platinum-Based Chemotherapy in Pancreatic Neuroendocrine Neoplasm with Grade 3: A Japanese Multicenter Pancreatic NEN-G3 Study. Clinical cancer research : an official journal of the American Association for Cancer Research 2017;23時46分25-32.
- Modlin IM, Lye KD, Kidd M. A 5-decade analysis of 13,715 carcinoid tumors. Cancer 2003;97:934-59.
- Hauso O, Gustafsson BI, Kidd M, et al. Neuroendocrine tumor epidemiology: contrasting Norway and North America. Cancer 2008;113時26分55-64.
- Ito T, Igarashi H, Nakamura K, et al. Epidemiological trends of pancreatic and gastrointestinal neuroendocrine tumors in Japan: a nationwide survey analysis. Journal of gastroenterology 2015;50:58-64.
- Yao JC, Hassan M, Phan A, et al. One hundred years after "carcinoid": epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2008;26:3063-72.
- 日本神経内分泌腫瘍研究会. 膵・消化管NEN診療ガイドライン第二版. 2019.
- Pavel M, O'Toole D, Costa F, et al. ENETS Consensus Guidelines Update for the Management of Distant Metastatic Disease of Intestinal, Pancreatic, Bronchial Neuroendocrine Neoplasms (NEN) and NEN of Unknown Primary Site. Neuroendocrinology 2016;13時17分2-85.
- Rinke A, Muller HH, Schade-Brittinger C, et al. Placebo-controlled, double-blind, prospective, randomized study on the effect of octreotide LAR in the control of tumor growth in patients with metastatic neuroendocrine midgut tumors: a report from the PROMID Study Group. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2009;27:4656-63.
- Caplin ME, Pavel M, Cwikla JB, et al. Lanreotide in metastatic enteropancreatic neuroendocrine tumors. The New England journal of medicine 2014;371:224-33.
- Yao JC, Shah MH, Ito T, et al. Everolimus for advanced pancreatic neuroendocrine tumors. The New England journal of medicine 2011;364:514-23.
- Yao JC, Fazio N, Singh S, et al. Everolimus for the treatment of advanced, non-functional neuroendocrine tumours of the lung or gastrointestinal tract (RADIANT-4): a randomised, placebo-controlled, phase 3 study. The Lancet 2016;387:968-77.
- Raymond E, Dahan L, Raoul JL, et al. Sunitinib malate for the treatment of pancreatic neuroendocrine tumors. The New England journal of medicine 2011;364:501-13.
- Dilz LM, Denecke T, Steffen IG, et al. Streptozocin/5-fluorouracil chemotherapy is associated with durable response in patients with advanced pancreatic neuroendocrine tumours. Eur J Cancer 2015;51:1253-62.
- Strosberg J, Wolin E, Chasen B, et al. NETTER-1 phase III: Progression-free survival, radiographic response, and preliminary overall survival results in patients with midgut neuroendocrine tumors treated with 177-Lu-Dotatate. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2016;34(suppl):abstr 194.
- Sorbye H, Welin S, Langer SW, et al. Predictive and prognostic factors for treatment and survival in 305 patients with advanced gastrointestinal neuroendocrine carcinoma (WHO G3): the NORDIC NEC study. Ann Oncol 2013;24:152-60.
- Garcia-Carbonero R, Sorbye H, Baudin E, et al. ENETS Consensus Guidelines for High-Grade Gastroenteropancreatic Neuroendocrine Tumors and Neuroendocrine Carcinomas. Neuroendocrinology 2016;13時18分6-94.