トップページ > がんゲノム医療 > 治療選択肢の可能性を求めて(患者申出療養)
治療選択肢の可能性を求めて(患者申出療養)
遺伝子パネル検査による遺伝子プロファイリングに基づく複数の分子標的治療に関する患者申出療養について
研究目的
遺伝子パネル検査後の治療選択肢を増やす
がん遺伝子パネル検査結果によりアクショナブルな遺伝子異常を有する患者を対象に、それぞれの遺伝子異常に対応する適応外薬を添付文書に基づいて投与し、治療経過についてのデータを収集する。
- 2019年10月1日から開始
- 複数の分子標的薬をひとつのプロトコール内で行うマスタープロトコール
- 治療効果の散逸を避け、有効性と安全性の情報を蓄積する
- 本試験結果を参考に、治験“立案“につながることが期待される
研究実施体制
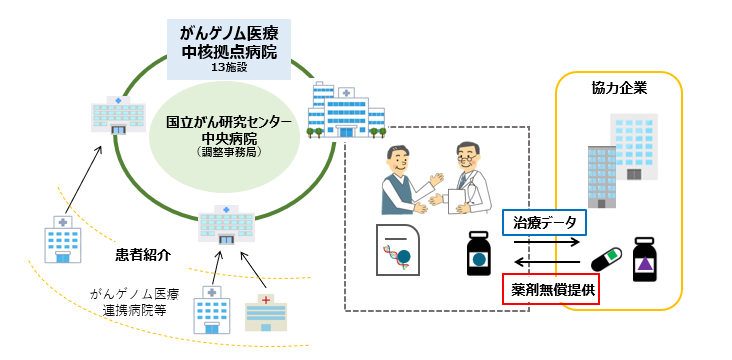
- 国立がん研究センター中央病院が全体の調整事務局となり、がんゲノム医療中核拠点病院13施設で行う多施設共同研究
- 賛同が得られた企業から薬剤無償提供を受け、患者の負担軽減をはかる
対象(主な適格規準)
- 登録時の年齢は問わない(ただし15歳未満は添付文書に小児用法用量の記載がある薬剤のみ登録可)
- 固形腫瘍
- 保険適用または評価療養として実施されたがん遺伝子パネル検査の結果、がんゲノム医療中核拠点病院/拠点病院のエキスパートパネルで適応外薬が推奨された場合(エビデンスレベルD以上)
- 実施中の治験または先進医療の対象でない
対象となるがん遺伝子パネル検査
| 保険適用/評価療養 | OncoGuideTM NCCオンコパネルシステム |
| FoundationOneR CDx がんゲノムプロファイル | |
| FoundationOneR Liquid CDx がんゲノムプロファイル | |
| Guardant360 CDx がん遺伝子パネル | |
| GenMineTOP がんゲノムプロファイリングシステム | |
| 先進医療 | NCCオンコパネル |
| TodaiOncoPanel | |
| OncomineTM Dx Target Test マルチCDxシステム | |
| TruSight Oncology 500 | |
| FoundationOneR CDx がんゲノムプロファイル |
試験組み入れ方法

- エキスパートパネルの判断 (がんゲノム医療中核拠点病院/拠点病院)
分子標的薬がエビデンスレベルD以上で推奨される(C-CATレポートに本試験が記載されていても、エキスパートパネルで推奨されなければ対象とはならない)
- 研究責任医師/分担医師の判断 (がんゲノム医療中核拠点病院)
治験や先進医療への参加が優先される
実施中の治験または先進医療の対象かどうか?
がん種横断的な第1相試験などを含め、治療選択肢が検索される
本試験への参加
●主要評価項目:16週までの奏効割合
●各医薬品コホート:80例(測定可能病変あり 50例/なし 30例)
参加施設(実施医療機関)
| 実施医療機関名 | 小児登録可能 注 |
|---|---|
| 国立がん研究センター中央病院 | 〇 |
| 北海道大学病院 | 〇 |
| 東北大学病院 | 〇 |
| 国立がん研究センター東病院 | - |
| 慶應義塾大学病院 | - |
| 東京大学医学部附属病院 | - |
| 公益財団法人がん研究会有明病院 | - |
| 静岡県立静岡がんセンター | - |
| 名古屋大学医学部附属病院 | 〇 |
| 京都大学医学部附属病院 | 〇 |
| 大阪大学医学部附属病院 | - |
| 岡山大学病院 | - |
| 九州大学病院 | 〇 |
注:〇の施設のみ小児患者(15歳未満の患者)登録可能
- 本研究の詳細は、臨床研究実施計画・研究概要公開システムをご確認ください。
https://jrct.mhlw.go.jp/latest-detail/jRCTs031190104(外部サイトにリンクします)
医薬品リストと登録状況
2025年11月25日現在
| 分類 | 一般名 | 販売名 | 製造販売業者等 | 小児 | 登録状況 | |
|---|---|---|---|---|---|---|
| ALK阻害薬 | セリチニブ | ジカディア錠150mg | ノバルティスファーマ株式会社 | ― | 登録終了 | |
| BCR/ABL阻害薬 | イマチニブメシル酸塩 | グリベック錠100mg | ノバルティスファーマ株式会社 | ― | 登録終了 | |
| mTOR阻害薬 | エベロリムス | アフィニトール錠2.5mg/5mg アフィニトール分散錠2mg/3mg | ノバルティスファーマ株式会社 | 対象 | 登録中 | |
| BRAF阻害薬 | ダブラフェニブメシル酸塩 | タフィンラーカプセル50mg/75mg | ノバルティスファーマ株式会社 | ― | 登録終了 | |
| MEK阻害剤 | トラメチニブ ジメチルスルホキシド付加物 | メキニスト錠 0.5mg/2mg | ノバルティスファーマ株式会社 | ― | 登録終了 | |
| マルチキナーゼ阻害薬 | パゾパニブ塩酸塩 | ヴォトリエント錠200mg | ノバルティスファーマ株式会社 | ― | 登録中 | |
| 併用療法 | BRAF阻害薬 | ダブラフェニブメシル酸塩 | タフィンラーカプセル50mg/75mg | ノバルティスファーマ株式会社 | ― | 登録終了 |
| MEK阻害剤 | トラメチニブ ジメチルスルホキシド付加物 | メキニスト錠 0.5mg/2mg | ||||
| マルチキナーゼ阻害薬 | ニロチニブ塩酸塩水和物 | タシグナカプセル50mg/150mg/200mg | ノバルティスファーマ株式会社 | 対象 | 登録中 | |
| JAK阻害剤 | ルキソリチニブリン酸塩 | ジャカビ錠5mg/10mg | ノバルティスファーマ株式会社 | 対象 | 登録中 | |
| MET阻害剤 | カプマチニブ塩酸塩水和物錠 | タブレクタ 150mg/200mg | ノバルティスファーマ株式会社 | ― | 登録中 | |
| ALK阻害薬 | アレクチニブ塩酸塩 | アレセンサカプセル150mg | 中外製薬株式会社 | 対象 | 登録中 | |
| 抗HER2ヒト化モノクローナル抗体 | トラスツズマブ(遺伝子組換え) | ハーセプチン注射用150 | 中外製薬株式会社 | ― | 登録終了 | |
| PD-L1 ヒト化モノクローナル抗体 | アテゾリズマブ(遺伝子組換え) | テセントリク点滴静注1200mg | 中外製薬株式会社 | ― | 登録終了 | |
| チロシンキナーゼ阻害剤 | エヌトレクチニブ | ロズリートレクカプセル 100mg/200mg | 中外製薬株式会社 | 対象 | 登録中 | |
| ヒト型抗ヒトPD-1モノクローナル抗体 | ニボルマブ(遺伝子組換え) | オプジーボ点滴静注240mg | 小野薬品工業株式会社 | ― | 登録終了 | |
| 併用療法 | BRAF阻害剤 | エンコラフェニブ | ビラフトビカプセル50mg | 小野薬品工業株式会社 | ― | 登録終了 |
| MEK阻害剤 | ビニメチニブ | メクトビ錠15mg | ||||
| チロシンキナーゼ阻害剤 | クリゾチニブ | ザーコリカプセル200mg/250mg | ファイザー株式会社 | ― | 登録中 | |
| チロシンキナーゼ阻害剤 | ポナチニブ塩酸塩錠 | アイクルシグ 15mg | 大塚製薬株式会社 | ― | 登録終了 | |
| CDK04月06日阻害剤 | アベマシクリブ | ベージニオ錠 50mg/100mg/150mg | 日本イーライリリー株式会社 | ― | 登録終了 | |
| PARP阻害剤 | ニラパリブ | ゼジューラ錠 100mg | 武田薬品工業 株式会社 |
― | 登録終了 | |
| FGFR阻害剤 | ペミガチニブ | ペマジール錠 4.5mg | インサイト・バイオサイエンシズ・ジャパン合同会社 | ― | 登録終了 |
薬剤はすべて企業からの無償提供
- 医薬品リストのPDF版はこちら患者申出療養 医薬品リスト(PDF:332KB)をご覧ください。
保険外併用療養費制度、患者申出療養とは
わが国の公的医療保険のもとでは、原則として、保険適用の療養と、保険適用がされていない療養を同時に併用することは許されていません。ただし、例外として、厚生労働大臣から、治験や先進医療といった評価療養、患者申出療養という制度の下で行うことが許された保険適用がなされていない療養については、例外的に保険診療と同時に併用することができます(保険外併用療養費制度といいます)。その保険適用外の療養にかかる費用は、患者さんから徴収することが可能となっています。詳しくは厚生労働省のホームページ(https://www.mhlw.go.jp/content/12400000/001471580.pdf(PDF:1.27MB)外部サイトにリンクします)をご確認ください。先に述べた患者申出療養とは、困難な病気と闘う患者の思いに応えるため、先進的な医療について、患者さんの申出を起点とし、安全性・有効性等を確認しつつ、身近な医療機関で迅速に受けられるようにするものです。患者さんの申出をもとに、臨床研究中核病院が臨床研究を立案し、患者さんの希望する療養を臨床研究として実施する制度です。
制度に関した詳細は、厚生労働省のページ(https://www.mhlw.go.jp/moushideryouyou/外部サイトにリンクします)をご確認ください。
遺伝子パネル検査による遺伝子プロファイリングに基づく複数の分子標的治療に関する患者申出療養立案の背景、詳細および注意点について
がん遺伝子パネル検査を行った場合、その結果に基づいて適応外薬が推奨される割合は、米国の研究データによると、9%程度とされています(図1)。先に説明したように、もし患者さんが適応外使用を希望する場合には、治験や先進医療などの、適応外使用が許される臨床試験に参加する必要があります。
図1 がん遺伝子パネル検査の結果に応じた治療方針(MSK-IMPACT;468遺伝子のパネル、N=10,945例)
平成30年11月22日患者申出療養評価会議(参考資料4)を改変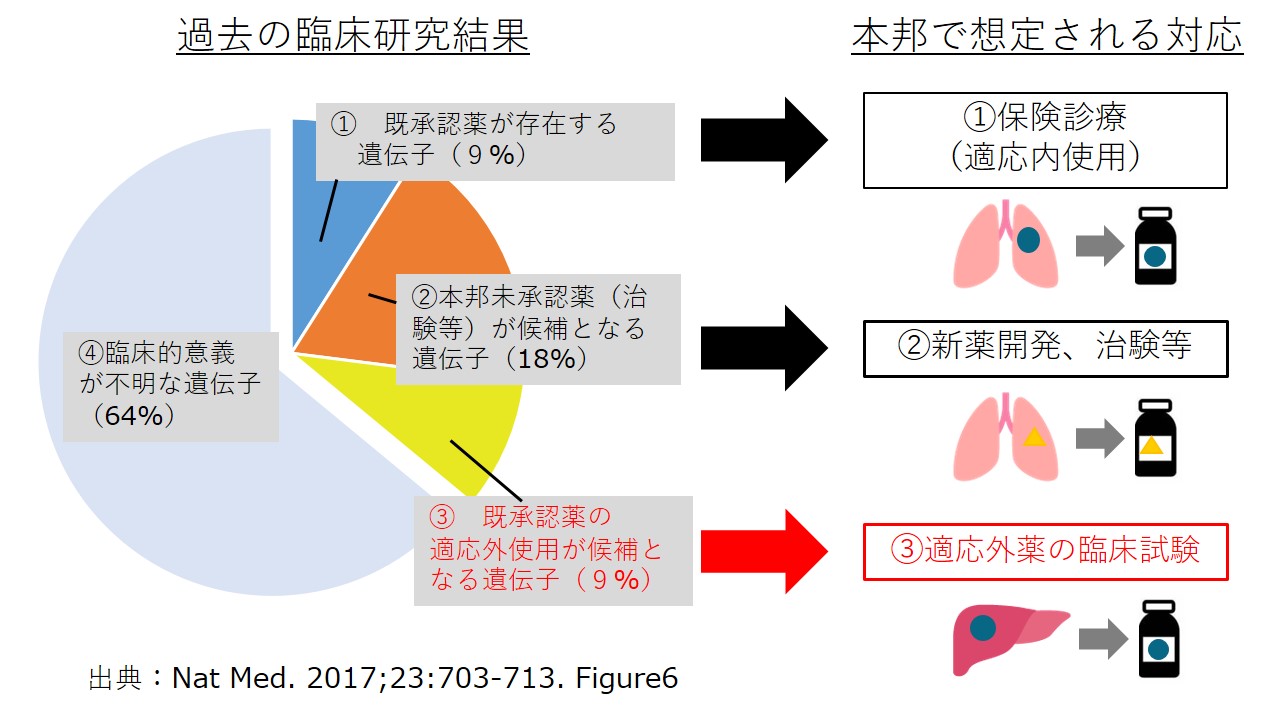
ただし、適応外薬が推奨されたものの、国内で実施可能な治験などの対象とならない方も一定の割合でいらっしゃいます。そのため、今回、国立がん研究センター中央病院が計画したのが、そのような治験などの対象とならない方へ治療機会を検討する臨床試験(研究)です。
対象となるがん遺伝子パネル検査は、保険診療又は先進医療で実施可能ながん遺伝子パネル検査で、検査結果に対する専門家会議 (エキスパートパネルと呼ばれています) によって、研究で使用可能な医薬品が推奨された場合に、その投与を検討できます。
(遺伝子パネル検査による遺伝子プロファイリングに基づく複数の分子標的治療に関する患者申出療養)
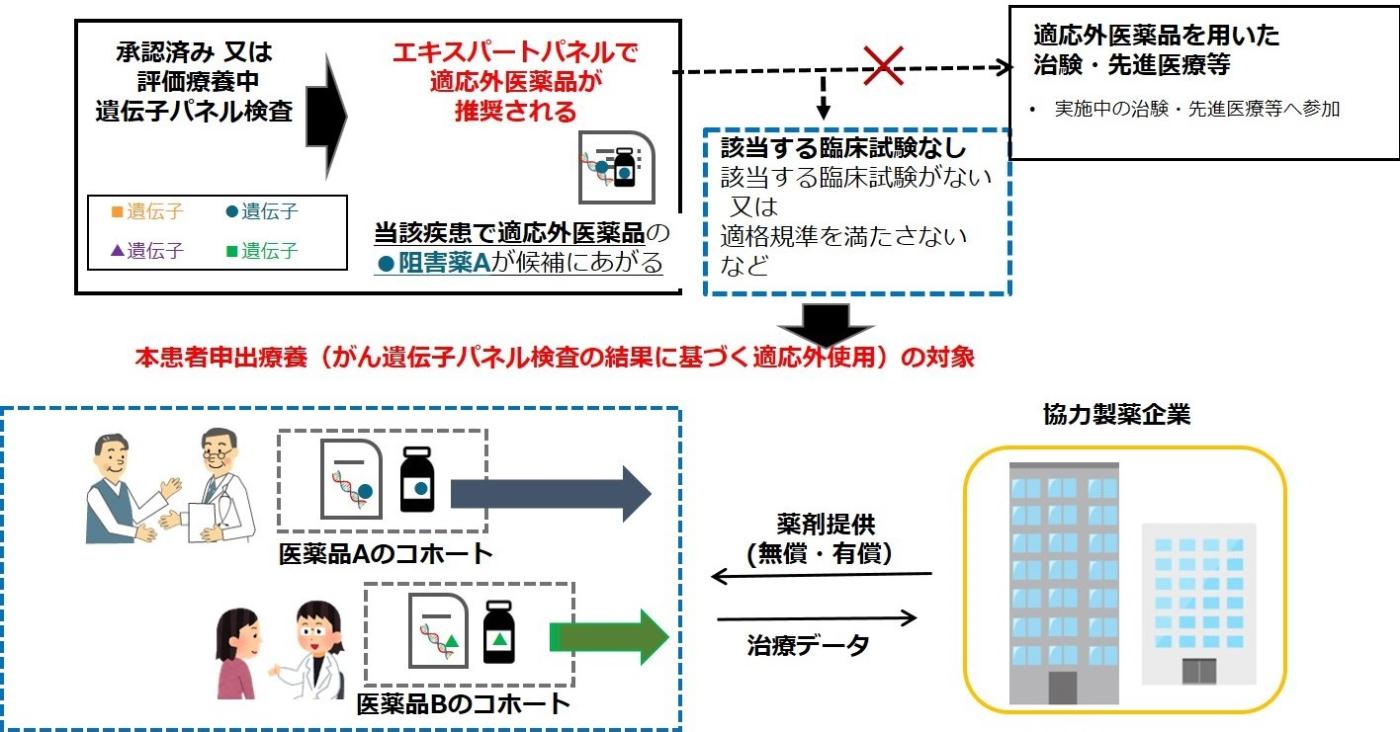
- 国立がん研究センター中央病院が全体の調整事務局となり、がんゲノム医療中核拠点病院で行う多施設共同研究。
- 無償提供に同意いただいた製薬企業の医薬品は、医薬品に関しては患者の費用負担なく実施が可能となる。
がん遺伝子パネル検査の結果により本研究の対象となっている医薬品が推奨された患者さんは、当院のような実施中の医療機関へ紹介をされることで、研究参加が検討されます。ただし、仮に、同じ医薬品や類似した医薬品が推奨されている場合であって、治験や先進医療が実施されている場合、一般的には治験等の方が、より薬事承認などにつながる研究になります。そのため、そういった治験を含めて総合的に検討の上、治療を検討します。(図2)
本試験への参加を検討いただく際に、注意点がいくつかありますので、以下に列挙します。
- 本試験に参加するにあたっては、患者さんの病気に対して治療した成績が十分にはない適応外薬を投与することから、安全性が不明な部分も多くあります。未知の副作用が出現するかもしれません。そのため、患者さんにより安全に治療を受けていただくため、本研究に参加する患者さんの体調などの条件には、一定の制限を設けさせていただいています。
- 本試験に登録されても、すぐに医薬品が投与できるわけではありません。本試験に登録された後に、治療開始前に医薬品提供の製薬企業における再チェックが必要な場合があります。そのため、実際に投与が可能になるまで、1ヵ月半程度時間を要する可能性があります。原則として、その投与開始までの間、別の抗がん剤治療を受けていただくことはできません。
- 患者申出療養という国の制度の下で実施していただくため、がんゲノム情報センターに、既に実施されたがん遺伝子パネル検査のデータ提出、さらに過去から今後の治療データを登録することについて、同意していただくことが必要です。
- 本試験に参加することで、費用が必要になることがあります。本来は、今回対象となる医薬品と研究運用に関わる費用を、患者さんにご負担いただくことになります。医薬品は複数種類あるとご説明いたしましたが、薬剤費にしたら4週間あたり約25万円から165万円強に相当する医薬品(注)までが対象になっています。しかし、本試験においては、2025年4月時点で対象となる医薬品は、全て製薬企業から無償提供されています。ただし、臨床試験実施に係る費用については、参加される患者さんお一人お一人から、別途いただくことになります。受診する医療機関によって異なりますが、国立がん研究センター中央病院では、37万円程度、投与開始日に一括でご負担いただくことになります。(注:2020年4月1日時点の薬価計算による試算)
- 定期診療・検査や入院などにかかる費用については、保険診療で行われます(ご自身の保険に応じた自費負担分は支払いが必要です)。
- 2021年1月の患者申出評価会議で承認された変更事項として、本試験は小児の患者さんも対象となるよう、改訂しております。小児患者さんへ投与可能となる薬剤は本邦で小児用法用量のある薬剤に限られておりますので、ご注意ください。
- 現時点では、全国のがんゲノム医療中核拠点病院13施設で実施可能です。(小児登録可能な施設は6施設)
がん遺伝子パネル検査が2019年6月より保険診療で実施可能となりました。しかし、実際にその結果として治療の選択肢に結びつくのは1割弱の患者さんです。
がん遺伝子パネル検査の結果に基づいて治療薬が推奨された患者さんの中で、治験や他の臨床試験に参加できない患者さんに対し、本試験を通じて適応外薬の治療を提供することで、少しでも多くの患者さんに治療の機会を提供できるよう、国立がん研究センター中央病院は、今後も研究センターとしての役割を担っていきます。
これまでの実績
- メキニスト・タフィンラー
論文発表:Tatsunori S, Kuniko S, Makoto T, et al. Phase II trial of dabrafenib and trametinib administration in patients with BRAFV600E/R or non-V600 BRAF mutated advanced solid tumours: the BELIEVE trial (NCCH1901). eClinical Medicine. 2024;69:102447.
学会発表: Phase II Trial of Dabrafenib and Trametinib in Patients with BRAFV600E/R or Non-BRAFV600 Mutated Advanced Solid Tumors: Results From the BELIEVE trial (NCCH1901). ASCO 2023.
同薬剤の適応拡大に際するプレスリリースはこちら - オプジーボ
学会発表:Phase II trial of nivolumab in advanced solid tumors based on genomic profiling: BELIEVE trial (NCCH1901) subcohort. JSMO 2025. - ビラフトビ・メクトビ
学会発表:Phase II trial of encorafenib and binimetinib in patients with BRAFV600E/R or non-BRAF V600 mutated advanced solid tumors: Results from the BELIEVE trial (NCCH1901). ESMO 2024. - メキニスト
学会発表:Phase II trial of trametinib in patients with advanced solid tumors harboring genomic alterations in the MAPK pathway: Results from the BELIEVE trial (NCCH1901). ASCO 2025 - テセントリク
学会発表:Phase II trial of atezolizumab in patients with advanced solid tumors: Results of atezolizumab cohort in the BELIEVE trial (NCCH1901). ESMO 2025 - その他
Ando Y, Shimoi T, Sunami K, et al. Progress Report of a cross-organ and biomarker-based basket-type clinical trial: BELIEVE trial. Cancer Sci. 2024;115時55分5-563.
患者申出療養制度を利用した治療機会提供の取り組み-NCCH1901試験を通じて。JSMO 2024。