肺がん
更新日 : 2026年1月5日
肺がんの診断から治療まで
肺がんが疑われる場合は、大きく1. 画像検査、2. 生検検査、3. 病理検査の3つの検査を行い、確定した診断に基づいて、さまざまな要因を考慮したうえで治療方針を決めます。検査から治療開始までは2週間から1ヶ月程度を要することが多いです。
肺がんが疑われた際の代表的な検査
- 画像検査:がんの部位や広がりを確認するために胸部X線、CT、PET-CT、MRIなどを行います。
- 生検検査:がんの確定診断のために、細胞や組織を採取するための検査です。気管支鏡、胸腔鏡、経皮的針生検などが該当します。
- 病理検査:2の検査で採取した細胞や組織を顕微鏡で観察し、がんの確定診断やがんのタイプ(組織型)を決定するための検査です。
国立がん研究センター中央病院呼吸器内科受診から治療開始までの大まかな流れ
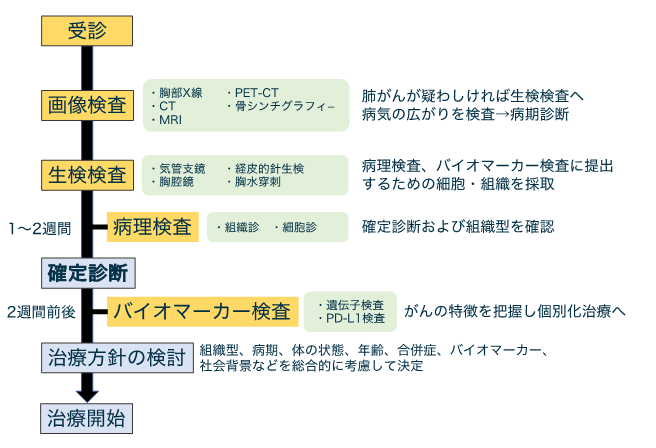
診断
肺がんの診断では、各種検査の結果から、組織型診断、病期診断、バイオマーカー診断(遺伝子変異、PD-L1発現)を行います。
それぞれの検査についてはがん情報サービスのホームページ(https://ganjoho.jp/public/cancer/lung/diagnosis.html)〇もご参照ください。
組織型診断
肺がんは非小細胞肺がんと小細胞肺がんの大きく2つの分類に分けられます。
非小細胞肺がんは、さらに腺がん、扁平上皮がん、大細胞がんに分類されます。小細胞肺がんは非小細胞肺がんと比べて増殖速度が早く、転移や再発をしやすい腫瘍です。
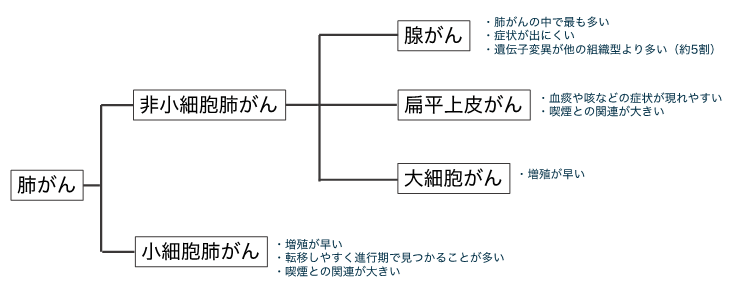
病期診断(呼吸器外科HPにリンク)
病気の広がりを病期(ステージ)と言います。呼吸器外科のホームページもご参照ください。
(呼吸器外科HP:肺がんのステージ)
バイオマーカー検査
タンパク発現や遺伝子変異などの、治療効果を予測する指標となるものをバイオマーカーと言います。治療の方針を立てるためにがん遺伝子検査、PD-L1検査などを行います。
- がん遺伝子検査
がん細胞の発生や増殖に関わる遺伝子に変異(異常)があるかを調べる検査です。
検査の結果、遺伝子変異のどれかが陽性と判定された場合、その遺伝子の変異に適した分子標的薬を用いて治療をすることができます(詳細は分子標的治療薬)。 - PD-L1検査
がん細胞の表面にPD-L1というタンパクがあるかを調べる検査を行い、使用する薬を検討することがあります(詳細は免疫チェックポイント阻害薬)。
ゲノム検査
非小細胞肺がんでは、初回診断時にがん遺伝子検査が行われます。しかし、現時点で使用可能な分子標的治療薬がない遺伝子変異も含めると、がんと関連する遺伝子は数百種類あると言われています。標準治療がない、または終了した(見込みも含む)などの条件を満たす場合に、「がんゲノム医療」として、がんゲノムプロファイリング検査が行われることがあります。次世代シークエンサー(NGS)を用いて1回の検査で多数(多くは100以上)の遺伝子を同時に調べることができます。解析結果について複数の専門家で構成される委員会(エキスパートパネル)によって検討され、遺伝子変異が見つかり、その遺伝子変異に対して効果が期待できる薬(開発段階も含む)がある場合には、臨床試験・治験など(臨床試験・治験について)でその薬の使用を検討できます。
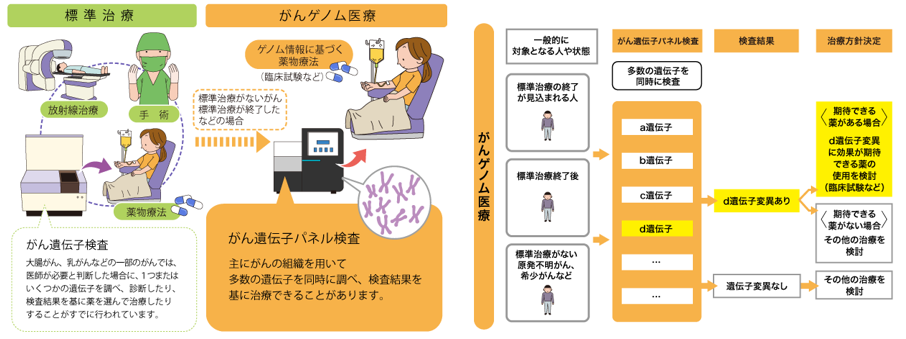
がん情報サービスより転載
非小細胞肺癌の治療について
周術期治療
臨床病期I期・II期およびIIIA期の一部の患者さんでは手術が治療の中心となります。肺がんの手術については呼吸器外科のHPもご参照ください(呼吸器外科:区域切除について)。
手術で完全に切除することが期待できる非小細胞肺がんの患者さんを対象として、がんが治る可能性を上げることを目的として、手術の前もしくは手術の後、またはその両方に抗がん剤治療や免疫チェックポイント阻害薬による治療を行うことがあります。
腫瘍の大きさが2cm未満のIA期を除き、術後再発を抑えるために術後に抗がん剤治療を追加することが検討されます(術後治療)。
IIIA期などの患者さんに対しては術前、または術前・術後の両方に化学療法と免疫チェックポイント阻害薬の併用を行うことがあります。
一部の患者さんでは術前に化学放射線療法を行うことがあります。
1.術前治療/術前・術後治療
手術の後に化学療法を行う術後補助療法の有効性が報告されており、これまでは手術の後に化学療法を行うことがより一般的でした。一方、手術の前にプラチナ製剤に加えて免疫チェックポイント阻害薬という種類の抗がん剤を併用する治療を行うことで、再発までの期間が延長することが示されました。これが「がんが治る可能性が上がる」ことにつながるかはまだわかっていませんが、その可能性が期待されています。
術前治療のみを行う場合と術前・術後の両方に治療を行う場合があります。
術前治療のみを行う場合には、プラチナ製剤を含む抗がん剤とニボルマブ(オプジーボ®)の併用療法を3週ごとに最大3回投与した後に手術を行います。
術前・術後の両方に治療を行う場合には、プラチナ製剤を含む抗がん剤とペムブロリズマブ(キイトルーダ®)またはデュルバルマブ(イミフィンジ®)の併用療法を3週ごとに最大4回投与した後に手術を行い、術後ペムブロリズマブ(キイトルーダ®)を3週ごとに最大13回(約1年間)またはデュルバルマブ(イミフィンジ®)を4週ごとに最大12回投与します。
また、一部の患者さんでは、手術の前に放射線治療と化学療法を併用して行うことを治療の選択肢の1つとして検討する場合があります。
2.術後治療
非小細胞肺がんに対する手術で完全切除された(がんが取り切れた)患者さんのうち、手術のみでがんが治る患者さんは病気の進行度などにより異なり30から80%程度です。手術後に抗がん剤治療を追加することで、再発の割合を10%程度減らすことができます。
I期(2cm未満のIA期を除く)・IIA期の患者さんにはテガフール・ウラシル(ユーエフティ®)を、II期・III期の患者さんにはシスプラチン+ビノレルビン(ナベルビン®)併用療法が用いられます。非扁平上皮癌ではビノレルビンの代わりにペメトレキセドが用いられることもあります。テガフール・ウラシル(ユーエフティ®)は毎日内服し、副作用が許容範囲内であれば2年間内服します。シスプラチン+ビノレルビン(ナベルビン®)もしくはペメトレキセド併用療法は、点滴を3から4週間ごとに行います。副作用が許容範囲内であれば、最大で4回繰り返します。
アテゾリズマブ(テセントリク®)は免疫チェックポイント阻害薬の一つです(免疫チェックポイント阻害薬について)。非小細胞肺がんに対する手術で完全切除された患者さんのうち、腫瘍検体でPD-L1が陽性のIIB期・III期の患者さんについては、シスプラチン+ビノレルビン(ナベルビン®)などを1から4サイクル実施したのち、再発がなければアテゾリズマブ(テセントリク®)を3週間毎に点滴で最長1年間投与(地固め療法)することで、さらに再発の割合を減らす(10から20%)ことが明らかになっています。
現在、進行期や転移巣のあるEGFR遺伝子変異陽性やALK融合遺伝子陽性の非小細胞肺がんの患者さんでは、分子標的薬(EGFR阻害薬やALK阻害薬)による薬物治療が行われています(分子標的治療薬について)。
完全に切除されたII期以上のEGFR遺伝子変異陽性の非小細胞肺がん患者さんを対象に、術後補助療法としてオシメルチニブ(タグリッソ®)を3年間内服することで、再発までの期間を延長する効果が得られることが分かりました。比較的副作用が少なく、脳転移などへ高い効果が期待できる可能性があり、治療の選択肢と考えられています。
同じように、完全に切除されたIB期以上のALK融合遺伝子陽性の非小細胞肺がん患者さんを対象に、術後補助療法としてアレクチニブ(アレセンサ®)を2年間内服することで、従来のプラチナ併用療法と比較して再発までの期間を延長することが分かり、治療の選択肢となっています。
いずれも、がんが治る可能性を上げるか、という術後補助療法としての意義はまだはっきりしていません。また、治癒している可能性のある患者さんも含め高額な薬を2年または3年間内服していただく必要があることも問題です。
化学放射線療法
IIIA期の一部やIIIB・IIIC期など遠隔転移がなくとも、がんの場所や大きさ、広がり、患者さんの状態などにより手術ですべてを取り除くことが不可能な非小細胞肺がんに対しては、手術に代わって、根治を目指した「化学放射線療法」が検討されます。化学放射線療法は化学療法と放射線治療を併用する治療法であり、使用される化学療法にはシスプラチン+ビノレルビン(ナベルビン®)やカルボプラチン+パクリタキセル(タキソール®)などの組合せがあり、それぞれ4週ごと、もしくは毎週投与します。高齢の患者さんや全身状態が優れない場合はカルボプラチン単剤連日投与が行われることもあります。放射線治療は原発巣とリンパ節転移を含めた範囲に、6週間かけて、30回程度に分割した合計60Gy(グレイ)の放射線を照射します。通常、土日祝日を除き連日治療が行われます。放射線照射は放射線科医師が、病変に対して十分な線量がかかる一方で正常組織にかかる線量を抑えられる様に微調整しながら、3D-CRT(3次元原体照射)、IMRT(強度変調放射線治療)などの技術を用いて、三次元的に計画して行います(放射線治療科:診療について)。
地固め療法
化学放射線療法完遂後に肺がんの悪化が無かった患者さんには、デュルバルマブ(イミフィンジ®)を4週間ごとに、最大1年間まで点滴投与することで、根治の可能性が向上すると考えられています。デュルバルマブ(イミフィンジ®)を使用した患者さんの5年生存率は40%程度と報告されています。肺がんの性質によっては効きづらい可能性や、間質性肺炎や自己免疫疾患がある場合には副作用が強く出てしまう可能性があるので使用が適さない患者さんもいます。現在、化学放射線療法後に使用出来る免疫チェックポイント阻害薬はデュルバルマブ(イミフィンジ®)だけですが、他の薬剤との併用の有効性が期待されており、複数の治験が行われています。
また、EGFR遺伝子変異のある患者さんには、オシメルチニブ(タグリッソ®)の内服を継続する有効性が示され、保険適応となっています。再発までの期間を延長することが示されましたが、これががんが治る可能性をあげるのか、ということはわかっていません。また、決まった治療期間はなく、高額な薬を飲み続けた場合の結果であることにも注意が必要です。
IV期および術後再発非小細胞肺がんに対する薬物治療
遠隔転移を有するIV期および術後再発の非小細胞肺がんの患者さんに対する治療の中心は、分子標的薬、免疫チェックポイント阻害薬、細胞障害性抗がん剤などの薬物治療です。ドライバー遺伝子変異のある患者さんでは分子標的薬が使用され、それ以外の患者さんでは免疫チェックポイント阻害薬、細胞障害性抗がん剤または免疫チェックポイント阻害薬と細胞障害性抗がん剤の併用が行われます。
1.分子標的治療薬
遺伝子は細胞の設計図で、何らかの理由により特定の遺伝子に変異が生じると、がんになってしまうことがあります。このような遺伝子の変異を「ドライバー遺伝子変異」といいます。肺がんでは、ほとんどの場合、ドライバー遺伝子変異はがん細胞のみにみられ、「がん家系」や「がん体質」といった遺伝性腫瘍とは異なります。(C-CAT:遺伝性腫瘍と遺伝カウンセリング) がん細胞にドライバー遺伝子変異がある場合、ドライバー遺伝子変異により生じるタンパクを標的とした分子標的薬により、がん細胞の増殖を効率的に抑えることができます。
(1) EGFR(エクソン19欠失変異、L858R変異)
EGFR遺伝子変異は、日本人を含むアジア人では、肺腺がんの約40%で認められます。非喫煙者の腺がんで多くみられます。複数の遺伝子変異のパターンがあり、代表的なもの(Common mutation)は、エクソン19欠失変異で約45%、L858R変異で約40%と報告されています。EGFR遺伝子変異に対する薬剤としては複数のEGFR阻害薬が承認されており、第一世代としてゲフィチニブ(イレッサ®)、エルロチニブ(タルセバ®)、第二世代としてアファチニブ(ジオトリフ®)、第三世代としてオシメルチニブ(タグリッソ®)、ラゼルチニブ(ラズクルーズ®)が使用可能です。いずれもEGFR遺伝子変異が見つかった患者さんの初回治療として使用可能ですが、現在ではオシメルチニブ(タグリッソ®)を用いることが一般的です。エルロチニブ(タルセバ®)にラムシルマブ(サイラムザ®)の点滴を併用する治療法も同程度に有効であると考えられています。これらの治療薬により、がんの病巣が治療前に比べて明らかに縮小する割合は10人中7~8人、半数の患者さんは1年半以上にわたって効果が持続します。
第三世代の薬剤であるラゼルチニブ(ラズクルーズ®)は、EGFRとMETの二重特異性(Bispecific)抗体であるアミバンタマブ(ライブリバント®)との併用で承認され、本邦でも使用可能です。従来の標準治療であるオシメルチニブ(タグリッソ®)と比較して、効果の持続期間が長く、生存期間を延長することが報告されていますが、皮膚障害、浮腫、血栓症などの特徴的な副作用も強くなるため注意が必要です。アミバンタマブは皮下注射製剤(リブロファズ®)も承認され、まもなく使用可能になる見込みです。
また、これまで、EGFR阻害薬が無効になった後に投与されていたプラチナ製剤+ペメトレキセド(アリムタ®)を、一次治療として、オシメルチニブ(タグリッソ®)と併用する治療法も選択肢になります。同時併用によって順番に投与する(オシメルチニブが無効になった後に点滴の治療に切り替える)より、平均として生存期間を延長することが示されました。一方、副作用は増強され、どちらを選択するかは主治医の先生ともご相談ください。
EGFR遺伝子変異に対する薬剤が無効となった場合、次の標準的な治療は点滴の抗がん剤です。初回治療でプラチナ製剤+ペメトレキセド(アリムタ®)の治療を受けていない場合、上述のアミバンタマブ(ライブリバント®)を追加することで、効果の持続期間を延長することが示されました。
近年、薬の効果を弱める新たな遺伝子変異(C797S変異など)に対する薬剤、抗体薬物複合体の研究・開発が進められ、複数の治験が実施中です。
(2) EGFR (エクソン19欠失変異、L858R変異以外の変異)
EGFR遺伝子変異のうち、 エクソン19欠失変異とL858R変異以外の遺伝子変異はUncommon mutationと言われています。
EGFR遺伝子変異の4から10%を占めるエクソン20挿入変異は、従来のEGFR遺伝子変異に対する薬剤が有効ではないことが知られています。EGFRとMETの二重特異性(Bispecific)抗体であるアミバンタマブ(ライブリバント®)と化学療法(カルボプラチン、ペメトレキセド)との併用の有効性が示され、本邦でも承認され、利用可能です。この治療により、がんの病巣が治療前に比べて明らかに縮小した割合は10人中6人、半数の患者さんで6ヶ月以上効果が持続したと報告されています。アミバンタマブではインフュージョンリアクションと呼ばれる、投与後早期のアレルギーのような反応が見られることがあり、最初のサイクルは数日に分けて投与され、以後は3週間ごとに投与されます。その他、複数の薬剤が研究され、治験が実施中です。
それ以外のUncommon mutationとしてはエクソン18のG719X変異、E709X変異、エクソン18 欠失変異、エクソン19 挿入変異、S768I変異、エクソン21のL861Q変異などがあります。分子標的治療薬の効果はさまざまですが、一般的には、エクソン19欠失変異やL858R変異と比較すると少し効きにくいとされています。過去の治療歴の報告では、ゲフィチニブ(イレッサ®)またはエルロチニブ(タルセバ®)による治療で、がんの病巣が治療前に比べて明らかに縮小する割合は10人中4から5人程度、アファチニブ(ジオトリフ®)では10人中7人程度です。海外の試験結果ですが、オシメルチニブ(タグリッソ®)による治療では、がんの病巣が治療前に比べて明らかに縮小する割合は10人中5人程度、半数の患者さんで8カ月以上効果が持続しました。ただし、それぞれの報告によってUncommon mutationの種類や治療効果が異なっており、治療薬の選択は主治医と良く相談することをお勧めします。
(3) ALK
ALK融合遺伝子は肺腺がんの3~5%に認められます。2011年にクリゾチニブ(ザーコリ®)が承認され、現在はアレクチニブ(アレセンサ®)、セリチニブ(ジカディア®)、ロルラチニブ(ローブレナ®)、ブリグチニブ(アルンブリグ®)と複数の薬剤が承認されています。ALK融合遺伝子が見つかった患者さんの最初の治療としてはアレクチニブ(アレセンサ®)、ロルラチニブ(ローブレナ®)、が最も推奨されており、がんの病巣が治療前に比べて明らかに縮小する割合は10人中9人、半数の患者さんで3年以上効果が持続します。その他、ブリグチニブ(アルンブリグ®)も選択肢です。これらの薬剤が無効となった後の治療については、十分なデータがなく、明確な基準はありませんが、プラチナ製剤併用療法や、他のALK阻害薬が選択されることが一般的です。
(4) ROS1
ROS1融合遺伝子は非小細胞肺がんの約1~2%に見られ、ほとんどは非喫煙者の非扁平上皮非小細胞肺がんです。現在、クリゾチニブ(ザーコリ®)、エヌトレクチニブ(ロズリートレク®)、レポトレクチニブ(オータイロ®️)、タレトレクチニブ(イブトロジー®)が使用可能です。
ALK阻害薬として保険承認されていたクリゾチニブ(ザーコリ®)が、ROS1融合遺伝子陽性の非小細胞肺がんにも有効であることが示され、2017年にROS1融合遺伝子陽性肺がんにも使えるようになりました。この治療薬でがんの病巣が治療前に比べて明らかに縮小する割合は10人中7人、半数の患者さんで1年半以上効果が持続します。その後、NTRK阻害薬として保険承認されていたエヌトレクチニブ(ロズリートレク®)も2020年からはROS1陽性肺がんにも保険承認されています。
レポトレクチニブ(オータイロ®️)はクリゾチニブやエヌトレクチニブが無効となった患者さんにも有効な可能性があり、2024年に本邦でも使用可能となりました。
さらに、タレトレクチニブ(イブトロジー®️)も有効性が示され、2025年に本邦でも承認され、使用可能です。
これらの薬剤の効果が乏しくなった後の治療は、プラチナ製剤併用療法が基本となりますが、新たな分子標的治療薬の治験も実施されています。
(5) BRAF
BRAF遺伝子の変異は、非小細胞肺がんの約1~3%に見られます。特に腺がんが多く、喫煙者に多い傾向が見られます。肺がん以外にも悪性黒色腫や大腸がんで認められ、複数のタイプの変異が知られています。このうち、肺がんにおけるBRAF遺伝子変異の約半数を占めるBRAF V600E変異に対して治療開発が進められています。BRAF阻害薬であるダブラフェニブ(タフィンラー®)とMEK阻害薬であるトラメチニブ(メキニスト®)との併用が標準治療となっています。この治療薬でがんの病巣が治療前に比べて明らかに縮小する割合は10人中7人、半数の患者さんで10ヶ月以上効果が持続しました。ダブラフェニブ(タフィンラー®)、トラメチニブ(メキニスト®)併用療法が無効となった段階では、プラチナ製剤併用療法を標準的な治療として提案しています。
(6) MET
MET遺伝子の変異には、MET エクソン14欠失変異と、METタンパクの増加の二つが知られています。MET エクソン14欠失変異は非小細胞肺がんの約2%で見られます。性別・喫煙などとの関連は見られず、比較的高齢者に多い、肉腫様がんでも頻度が高いといった特徴があります。MET阻害薬としてはテポチニブ(テプミトコ®)、カプマチニブ(タブレクタ®)、グマロンチニブ(ハイイータン®)が承認されています。この治療薬でがんの病巣が治療前に比べて明らかに縮小する割合は10人中4から5人、半数の患者さんで1年半以上効果が持続しました。これらの薬剤の効果が乏しくなった段階では、標準的な治療としてプラチナ製剤併用療法を提案しています。またMETタンパクの増加も治療標的とされており、近年、治療薬として、METとEGFRの二重特異性(Bispecific)抗体であるアミバンタマブ(ライブリバント®️)、抗体薬物複合体の研究が進められています。なお、アミバンタマブ(ライブリバント®️)はEGFR 遺伝子変異(エクソン19欠失変異、L858R変異、エクソン20挿入変異)への使用が保険承認されていますが、MET遺伝子変異に対する有効性はまだ十分に証明されておらず、使用できません。
(7) RET
RET融合遺伝子は非小細胞肺がんの約3%の頻度で存在すると報告されています。RET阻害薬であるセルぺルカチニブ(レットヴィモ®)が2021年9月に保険承認されています。セルペルカチニブ(レットヴィモ®)は、初めて治療を受ける患者さんで、がんの病巣が治療前に比べて明らかに縮小する割合は10人中8から9人、治療歴のある患者さんでは10人中6人程度です。また、他の治療薬やセルペルカチニブ(レットヴィモ®)が無効になった後の薬剤も開発が進められています。
(8) KRAS
KRAS遺伝子変異は、肺がんを含めた多くのがんにおいて発がんに関与するドライバー遺伝子変異として知られてきました。中でも、KRAS G12C変異は非小細胞肺がんにおける重要な遺伝子変異の1つで、全世界では肺腺がんの約13%、日本人では非扁平上皮がんの約4.5%の患者さんに見られます。この変異を標的とした分子標的治療薬は、長らく有効性が示されるような治療の開発には結びつきませんでした。しかし、2022年1月にKRAS G12C阻害薬であるソトラシブ(ルマケラス®)が保険承認され、肺がん治療に使えるようになりました。この薬剤は、他の抗がん剤治療が無効となった患者さん(2次治療以降)で使用します。ソトラシブ(ルマケラス®)はがんの病巣が治療前に比べて明らかに縮小する割合は10人中3から4人、半数の患者さんで11ヶ月以上効果が持続しました。
(9) NTRK
NTRK融合遺伝子は小児を含むさまざまながんで存在することが知られていますが、非小細胞肺がんでは1%未満と希な遺伝子変異です。NTRK融合遺伝子があるがんに対する治療薬としては、がんの種類によらず、エヌトレクチニブ(ロズリートレク®)、ラロトレクチニブ(ヴァイトラックビ®)が現在承認されています。これらの治療薬でがんの病巣が治療前に比べて明らかに縮小する割合はどちらも10人中7人程度です。これらの薬剤が無効となった段階での標準的な治療としては、プラチナ製剤併用療法を提案しています。
(10) HER2
HER2 タンパクは細胞の表面に存在し、細胞の増殖に関わる分子の一つで、HER2タンパクを特異的に狙った薬物治療 (分子標的薬)の開発が進んでいます。日本人肺がん患者さんの約3から5%にこのHER2の変異が指摘されています。2023年8月にトラスツズマブデルクステカン(エンハーツ®)がHER2遺伝子変異を有する非小細胞肺癌に対して保険承認されました。トラスツズマブデルクステカン(エンハーツ®)はこれまで乳がんと胃がんに対して保険承認されていた薬剤(抗体薬物複合体)です。HER2遺伝子変異を有する非小細胞肺がんに対して、病巣が治療前に比べて明らかに縮小する割合は10人中5人、半数の患者さんで約10ヶ月効果が持続しました。
さらに、HER2遺伝子変異を標的とした内服薬のゾンゲルチニブ(ヘルネクシオス®️)も有効性が示されました。病巣が治療前に比べて明らかに縮小する割合は10人中7人、半数の患者さんで約12ヶ月効果が持続しました。いずれの薬剤も、現在はプラチナ製剤を含む抗がん剤治療が無効となった患者さん(2次治療以降)で使用します。
またHER2遺伝子変異を標的とした内服薬のセバベルチニブ(hyrnuo®️)も米国では承認されており、本邦での承認も期待されています。
(11) NRG1
NRG1融合遺伝子は肺がんの約0.5%に認められ、粘液産生性肺腺がんでは3割程度に見られると報告されています。現在はNRG1融合遺伝子を有する肺がんの患者さんに保険診療で使用可能な分子標的薬はありません。NRG1融合遺伝子変異陽性がんにはERBB(HER)シグナル伝達が関与しており、HER2/HER3を標的とした二重特異性抗体であるゼノクツズマブ(ビゼングリ®️)の有効性が検証されました。治療歴のあるNRG1融合遺伝子陽性の非小細胞肺癌に対して、病巣が治療前に比べて明らかに縮小する割合は10人中約3人、半数の患者さんで約7ヶ月効果が持続しました。米国で承認に至っていますが、本邦では現在未承認です。また、ERBB受容体ファミリー阻害薬であるアファチニブ(ジオトリフ®)の治療が期待されています。また、新規薬剤の開発も進んでいます。
(12) CLIP1-LTK
非小細胞肺がんの約0.4%に認められる遺伝子変異で、細胞のがん化に直接関与することが本邦で発見され、2021年に報告されました。ロルラチニブ(ローブレナ®)が有効であった症例が報告されていますが、現時点でCLIP1-LTK融合遺伝子を有する肺がんの患者さんに保険診療で使用可能な分子標的薬はありません。CLIP1-LTK融合遺伝子を有する肺がんに対するロルラチニブ(ローブレナ®)の医師主導治験が準備中です。
(13) SMARCA4欠損腫瘍
SMARCA4遺伝子の異常はさまざまながん種で認められます。そのうち、胸部(縦隔や肺)から発生し、未分化な形態をもつ腫瘍として、SMARCA4欠損胸部腫瘍があります。明確な治療法は確立されていませんが、腫瘍のできる場所から、非小細胞肺がんとして治療をされることが多いです。一般的に進行が早く、薬物治療が効きにくいですが、免疫チェックポイント阻害薬が有効である可能性があり、当院からも報告しています。新たな治療標的と考えられ、新規の治験も計画されています。
2.免疫チェックポイント阻害薬
がん免疫療法とは、もともと身体に備わっている、主にリンパ球によるがんに対する免疫力を賦活化、あるいは再活性化することでがん細胞を攻撃する治療です。もともとがん細胞には、リンパ球などの免疫細胞の攻撃を逃れる仕組みがあります。免疫チェックポイント阻害薬は、がん細胞が免疫から逃れるためのブレーキ(免疫回避)を解除して、本来の免疫の力を取り戻す治療法です。肺がんに対する免疫療法としては、抗PD-1/PD-L1抗体、抗CTLA-4抗体の免疫チェックポイント阻害薬が保険適用となっています。
免疫チェックポイント阻害薬は従来の細胞障害性抗がん剤とは異なる、特徴的な副作用、免疫関連有害事象(immune related adverse events: irAEs)が見られることがあります。肺障害、ホルモンの異常、腸炎などが報告されています。発生頻度自体は従来の抗がん剤に比較して高いわけではありませんが、診断・治療に難渋することも多くあります。
(1) PD-1/PD-L1阻害薬単剤療法
切除不能・進行非小細胞肺がんの治療に単剤で用いられる免疫チェックポイント阻害薬は抗PD-1抗体であるニボルマブ(オプジーボ®)、ペムブロリズマブ(キイトルーダ®)、セミプリマブ(リブタヨ®️)と抗PD-L1抗体であるアテゾリズマブ(テセントリク®)、デュルバルマブ(イミフィンジ®)です。どの薬剤を使うかは、それまでの治療歴やがんの特徴(PD-L1というタンパクの値)などによって決められます。対象、投与スケジュールはそれぞれ異なりますが、効果や副作用はいずれも同程度です。がんの病巣が治療前に比べて明らかに縮小する割合は、初回治療では10人中3から4人、他の治療が無効になった患者さんでは、10人中1から2人程度とされています。
(2) PD-1/PD-L1阻害薬+CTLA-4阻害薬併用療法
免疫チェックポイント阻害薬の併用療法としてニボルマブ(オプジーボ®)とイピリムマブ(ヤーボイ®)の併用療法および、さらにこれに2サイクルのプラチナ製剤併用化学療法を追加した治療が保険承認されています。ニボルマブを3週ごと、イピリムマブを6週ごとに点滴投与します。さらに、2023年にデュルバルマブ(イミフィンジ®︎)とトレメリムマブ(イジュド®︎)と最大4サイクルのプラチナ製剤併用化学療法を併用する治療が保険承認されました。
どちらの治療もPD-L1発現率によらず、進行期非小細胞肺がんに対して使用することができます。がんの病巣が治療前に比べて明らかに縮小する割合は10人中3から4人とされています。
(3) 免疫チェックポイント阻害薬+細胞障害性抗がん剤
免疫チェックポイント阻害薬は細胞障害性抗がん剤と組み合わせて投与されることがあります。複数の組み合わせがあり、それぞれの組み合わせ同士の優劣についてはわかっていませんが、いずれもプラチナ製剤(シスプラチンもしくはカルボプラチン)ともう1剤の抗がん剤、および免疫チェックポイント阻害薬を併用します。血管新生阻害剤と呼ばれる薬剤を併用することもあります。いずれの治療も、がんの病巣が治療前に比べて明らかに縮小する割合は10人中4~6人程度です。一般的にプラチナ製剤は最大4回投与し、治療効果が確認され、副作用が許容範囲内である場合には免疫チェックポイント阻害薬を含む一部の薬剤のみに減らして、継続します。
3.細胞障害性抗がん剤
細胞障害性抗がん剤はプラチナ製剤(シスプラチン、カルボプラチン、ネダプラチン)を含む複数の薬剤を組み合わせる場合(プラチナ製剤併用療法)と、一種類だけで用いられる場合(単剤治療)があります。一般的にプラチナ製剤併用療法の方が有効な可能性は高い反面、副作用が強い傾向があります。年齢や全身状態、臓器機能・合併症などを踏まえて治療を選択します。以下に代表的な薬剤を記載します。
(1) プラチナ製剤併用療法
肺がん治療に用いられるプラチナ製剤にはシスプラチン、カルボプラチン、ネダプラチンがあります。いずれも他の薬剤との組み合わせで使用されます。シスプラチンとカルボプラチンは概ね同じように使用されますが、シスプラチンの方が吐き気などの副作用が強く、カルボプラチンの方が血液の減少(骨髄抑制)が強く出る傾向があります。ネダプラチンは下記のドセタキセルとの組み合わせでのみ用いられ、扁平上皮がんに対して使用されることがあります。
(2) ペメトレキセド(アリムタ®)
ペメトレキセド(アリムタ®)は非扁平上皮がんに効果が高いことが知られているため、主に非扁平上皮がんに使用される薬剤です。シスプラチンやカルボプラチンとの併用や、単剤で使用されることもあり、年齢や全身状態に応じて選択されます。
プラチナ製剤との併用の場合には、血管新生阻害剤であるベバシズマブ(アバスチン®)を追加することがあります。プラチナ製剤+ペメトレキセド(アリムタ®)±ベバシズマブ(アバスチン®)を3週間ごとに4コース行った後、効果と副作用に応じペメトレキセド(アリムタ®)±ベバシズマブ(アバスチン®)による維持療法を3週間ごとに、治療効果が確認され、副作用が許容範囲内である間継続します。単剤治療の場合も3週間ごとに、治療効果が確認され、副作用が許容範囲内である間は継続します。
(3) パクリタキセル(タキソール®)/ナブパクリタキセル(アブラキサン®)
パクリタキセル(タキソール®)、ナブパクリタキセル(アブラキサン®)は扁平上皮がん、非扁平上皮がんともにカルボプラチンとの併用や、単剤で使用されます。いずれも微小管阻害剤です。パクリタキセル(タキソール®)はアルコールの成分を含んでおり、アルコール不耐のある患者さんなどでナブパクリタキセル(アブラキサン®)を使用します。プラチナ製剤との併用の場合は、3週間ごとに4コース投与します。ナブパクリタキセル(アブラキサン®)は分割投与のため8日目、15日目にも投与があります。非扁平上皮がんに対しては、カルボプラチン+パクリタキセル(タキソール®)にベバシズマブ(アバスチン®)を追加することがあります。
単剤の場合には、いずれの薬剤も毎週投与し、治療効果が確認され、副作用が許容範囲内である間は継続します。
(4) ドセタキセル(タキソテール®) ±ラムシルマブ(サイラムザ®)
ドセタキセル(タキソテール®)は微小管阻害剤で、多剤併用療法後の二次治療以降の治療として用いられます。ラムシルマブ(サイラムザ®)は、ベバシズマブ(アバスチン®)と同じ血管新生阻害剤ですが、ベバシズマブ(アバスチン®)とは異なり扁平上皮がんにも使用することができます。ベバシズマブ(アバスチン®)と同様、喀血の既往がある方は出血のリスクが高まるため使用できません。また70歳以上の患者さんや全身状態が悪い患者さん(PS≥2)に対してのラムシルマブ(サイラムザ®)の有効性は認められていません。ドセタキセル(タキソテール®) ±ラムシルマブ(サイラムザ®)を3週間ごとに治療効果が確認され、副作用が許容範囲内である間、継続します。ラムシルマブ(サイラムザ®)を併用する場合は、骨髄に対する副作用が強く白血球が減少するため、白血球増加作用のあるG-CSF製剤(ジーラスタ®など)を併用することがあります。
(5) その他の抗がん剤
3次治療以降の治療については、十分なデータ、根拠が示されていません。全身の状態などを踏まえて、肺がんに有効とされている薬剤のうち、それまでに使用した薬剤とは異なるタイプの薬剤を選択して治療することがあります。下記の抗がん剤は単剤療法で検討されます。いずれも単剤療法としては治療効果が確認され、副作用が許容範囲内である間は継続します。
注射剤
ゲムシタビン(ジェムザール®): 代謝拮抗剤
ビノレルビン(ナベルビン®):微小管阻害剤
内服薬
テガフール・ギメラシル・オテラシルカリウム(TS-1®):代謝拮抗剤
4.抗体薬物複合体(Antibody-drug conjugate, ADC)
抗体薬物複合体(Antibody-drug conjugate, ADC)とは抗体と細胞障害性抗がん剤を結合させた薬剤です。抗体はそれぞれ特定のタンパクを認識して結合する特徴があります。がん細胞に特徴的なタンパクを認識する抗体を用いることで、選択的に細胞障害性抗がん剤を届けるため、全身への有害事象が少ない上効果も高まることが知られています。非小細胞肺がんの治療では、HER2遺伝子変異陽性に対するトラスツズマブデルクステカン(エンハーツ®)が2次治療として承認されています。また、他にも様々な種類の抗体薬物複合体の開発が進んでいます。非小細胞肺がんに対し開発が進んでいるものとしては、ダトポタマブデルクステカン(TROP2に対する抗体薬物複合体、ダトロウェイ®)、Telisotuzumab Vedotin(c-Metに対する抗体薬物複合体)、パトリツマブデルクステカン(HER3に対する抗体薬物複合体)などが挙げられます。現在、複数の治験が行われており、適応となる患者さんの治療選択肢となります。
小細胞肺がんの治療
小細胞肺がんは進行が速く、遠隔転移を起こしやすい為に手術の適応になることは稀ですが、リンパ節転移のないI期の患者さんでは手術を施行し、その後に抗がん剤治療を追加します。病変が一側の胸郭内と鎖骨上窩リンパ節までの転移で根治的放射線治療が可能な限局型の患者さんでは、抗がん剤と放射線治療の併用を行います。さらに進行した進展型の患者さんの場合には、抗がん剤と免疫チェックポイント阻害薬を使って治療します。
小細胞肺がんの化学放射線療法
小細胞肺がんに対する化学放射線療法では、シスプラチンとエトポシドによるプラチナ製剤併用療法と同時に放射線治療を行います。薬物治療は3から4週ごとに最大4回、放射線治療は1日2回、計30回(15日間)で行われることが多いです。腫瘍の大きさ、全身の状態などを踏まえ、薬物治療を先行した後に放射線を行う場合、放射線を1日1回、計30回行う場合、シスプラチンの代わりにカルボプラチンを用いる場合などがあります。
化学放射線療法後に、抗PD-L1抗体のデュルバルマブ(イミフィンジ®)を最大2年間点滴投与することで、根治の可能性が向上すると考えられています。本邦でも保険承認され、使用可能です。
プラチナ製剤併用療法+抗PD-L1抗体
進展型小細胞肺がんでは、手術や放射線治療で病気を治すことはできず、抗がん剤で病気による症状の出現を可能な限り抑え、より良い生活を送っていただくことを治療の目標とします。 シスプラチンまたはカルボプラチンとエトポシドによるプラチナ製剤併用療法に抗PD-L1抗体であるアテゾリズマブ(テセントリク®)またはデュルバルマブ(イミフィンジ®)の3種類の薬剤を組み合わせる治療の有効性が近年示され、現在の標準治療となっております。プラチナ製剤、抗PD-L1抗体の種類による効果の差は明確には示されていませんので、実際に使用する薬剤については、担当医とよくご相談ください。がん病巣が治療前と比較してあきらかに小さくなる割合は10人中7-8人とされています。3日間の点滴治療で、3週間毎に行い、4回繰り返します(導入療法)。その後、抗PD-L1抗体のみを3~4週間毎に継続していきます(維持療法)。治療効果が確認され、副作用が許容範囲内である間、継続していきます。
アムルビシン(カルセド®)
初発の小細胞肺がんに対して抗がん剤治療を行うも、残念ながら再発してしまった患者さんに対しては、アムルビシン(カルセド®)が標準治療とされています。がん病巣が治療前と比較して明らかに小さくなる割合は10人中5人とされています。初回抗がん剤治療終了後から再発までの期間が3か月以内だと、効果が多少劣ることが知られています。3日間の点滴治療で、3週間毎に行い、治療効果が確認され、副作用が許容範囲内である間、継続していきます。
タルラタマブ (イムデトラ®)
二重特異性T細胞誘導(BiTE)抗体で、小細胞がんに多く発現するデルタ様リガンド3(DLL3)とTリンパ球に発現するCD3をつなぐことで、Tリンパ球ががん細胞を攻撃し、効果を示します。二次治療後に悪化した患者さんを対象とした試験で、有効性・安全性が示されました。国内でも保険承認され、使用可能です。一次治療(プラチナ製剤を含む化学療法)後の患者さんにも有効性が示され、今後、対象が広がる可能性が考えられています。また、抗PD-L1抗体やプラチナ製剤などの抗がん剤と組み合わせる開発も進められています。
BiTEによる治療では、サイトカイン放出症候群(CRS:cytokine releasing syndrome)などの特徴的な副作用があり、重症化する可能性もあるため、注意が必要です。
開発中の治療薬
1. イフィナタマブデルクステカン(I-DXd/DS-7300)
小細胞肺がんなどに多く発現するB7-H3に対する抗体と抗がん剤(トポイソメラーゼI阻害剤)を組み合わせた抗体薬物複合体(ADC)で、がん細胞に効率よく抗がん剤を送り届けることを可能にし、がんの縮小を認めたことが報告され、開発が進んでいます。
2. Lurbinectedin
アルキル化薬に分類される細胞障害性抗がん剤で、DNAに作用して合成を阻害し、がんに対する効果を示します。小細胞肺がんに対する二次治療として、米国では2020年に承認され使用されていますが、本邦では未承認で、治験が行われています(当院では実施しておりません)。